
лекции для нехимиков-2
.pdf
Тема №4. ТЕРМОДИНАМИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Из всех известных видов энергии теплота Q, в отличие от остальных, не может полностью перейти в другой вид энергии, т.к. она представляет собой энергию беспорядочного движения микрочастиц. Хаотическое движение нельзя полностью перестроить в упорядоченное. Наукой о движении тепла является термодинамика.
Химическая термодинамика – раздел химии, изучающий энергетику химических и фазовых превращений и направление протекания процессов в физико-химических системах.
1. Основные понятия. 1-й закон термодинамики
Объектом исследования в т/д-ке является выделяемая произвольно система. Все, что находится вовне – окружающая среда. Т/д-кая система – совокупность тел, способных обмениваться друг с другом энергией и веществом и по-разному взаимодействующих со средой.
Закрытая система обменивается с ОС энергией, но не веществом. Открытая система обменивается с ОС энергией и веществом. Изолированная система не обменивается с ОС ни энергией, ни веществом.
Величины, характеризующие систему (параметры) делятся на две группы:
1)интенсивные (величина которых не зависит от количества вещества) – Т, р, См.;
2)экстенсивные (величина которых зависит от количества вещества) – m, V.
В термодинамике используется система общефизических законов (начал). Нулевым законом термодинамики называют следующее утверждение: две системы, находящиеся в

термическом равновесии с третьей системой, состоят в термическом равновесии друг с другом.
Любое изменение одного или нескольких параметров системы называется термодинамическим процессом. В таких процессах меняется внутренняя энергия системы U – она определяется суммарным запасом энергии составляющих систему молекул, атомов, электронов, ядер и т.д. и складывается в основном из кинетической энергии указанных частиц и энергии взаимодействия между ними. Абсолютное значение внутренней энергии U ни измерить, ни рассчитать нельзя, можно только определить ее изменение в результате термодинамического процесса ΔU. ΔU является функцией состояния системы – величина не зависит от пути процесса и определяется только начальным и конечным состоянием системы
ΔU = U2 – U1.
Изменение внутренней энергии определяется 1-м началом термодинамики. Теплота, подводимая к системе извне, тратится на изменение внутренней энергии системы и совершение системой работы против внешних сил
Q = ΔU + A = ΔU + pΔV.
Другие формулировки:
Ни работа, ни теплота не являются функциями состояния и зависят от пути процес-
са.

Втермодинамике используются также величины, тождественные сумме нескольких термодинамических параметров. Функция состояния, равная сумме U + pV, называется энтальпией Н.
Вхимии как правило осуществляются два типа условий при проведении реакции: изобарные (р=const), и изохорные (V=const). Изменение энтальпии изобарного процесса:
ΔH = ΔU + pΔV.
При р=const (открытая система) и в отсутствие других видов работ, кроме работы расширения, теплота равна изменению энтальпии:
Qp = ΔU + pΔV = ΔH.
Если процесс проходит при постоянном объеме и в отсутствие других видов работ, выделившаяся или поглощенная теплота соответствует изменению внутренней энергии:
QV = ΔU.
Поскольку большинство реакций идут в открытых системах, далее под тепловым эффектом реакции мы будем подразумевать изменение энтальпии системы.
2. Термохимия
Раздел химической термодинамики, в котором изучаются теплоты химических реакций и их зависимость от различных физико-химических параметров, носит название термохимии.
Здесь пользуются термохимическими уравнениями реакций, в которых указаны агрегатные состояния веществ, их полиморфные модификации (где необходимо) и величина теплового эффекта.
Н2(г) + 1/2О2(г) = Н2О(г) + 242 кДж.
Q и ΔH имеют разные знаки, т.к. энтальпия характеризует тепловые изменения в системе, а теплота – в ОС.
В экзотермическом процессе Q > 0, ΔH<0, а в эндотермическом Q<0, ΔH>0. Агрегатное состояние указывается т.к. его изменение вносит дополнительные энер-
гозатраты или энерговыделение для системы.
Н2О(г) = Н2О(ж) + 44 кДж. Следовательно:
Н2(г) + 1/2О2(г) = Н2О(ж) + 286 кДж.
Тепловые эффекты реакций можно не только измерить (в калориметре), но и рассчитать по закону Гесса (1840 г.).
Тепловой эффект химической реакции не зависит от промежуточных стадий реакции (пути процесса), а определяется только состоянием исходных веществ и продуктов реакции.

Основываясь на законе Гесса ΔH реакции можно рассчитать двумя путями.
СО(г)
Н1 = a |
Н2 = b |
С(графит)  СО2(г)
СО2(г)
Н3 = ?
ΔH3 = ΔH1 + ΔH2.
Фактически, одним из следствий закона Гесса является закон Лавуазье – Лапласа, часто применяющийся в расчетах:
ΔH реакции можно также рассчитать, используя стандартные величины энтальпий образования реагирующих веществ и продуктов реакции. Стандартная энтальпия реакции образования вещества. (ΔfH°298) – это тепловой эффект образования 1 моль соедине-
ния из простых веществ в их устойчивой модификации при температуре 25° С (298 К), и в стандартном состоянии, т.е. при р=1 атм (101325 Па). fH°298(простых веществ) = 0.
Зная fH°298 всех исходных веществ и продуктов реакции, можно вычислить изменение энтальпии любой реакции в стандартных условиях согласно следствию из закона Гесса:
rH°298 = Σνi fH°298(продуктов) –Σνj fH°298(исх. веществ)
Температурная зависимость энтальпии
Далеко не все химические реакции осуществляются при стандартных условиях и энтальпии реакции различаются в зависимости от температуры системы, следовательно, чтобы рассчитать реальное значение теплового эффекта реакции нужно знать температурную зависимость энтальпии веществ, которая тесно связана с понятием теплоемкости вещества.
Мольной теплоемкостью С называется количество теплоты, необходимое для нагревания 1 моль вещества на 1 градус.
С меняется с температурой сложным образом, что выражается эмпирическим поли-
номом:
с = а + bT + dT2 +…
Обычно используют величину С при постоянном давлении:
сp = dH/dT.
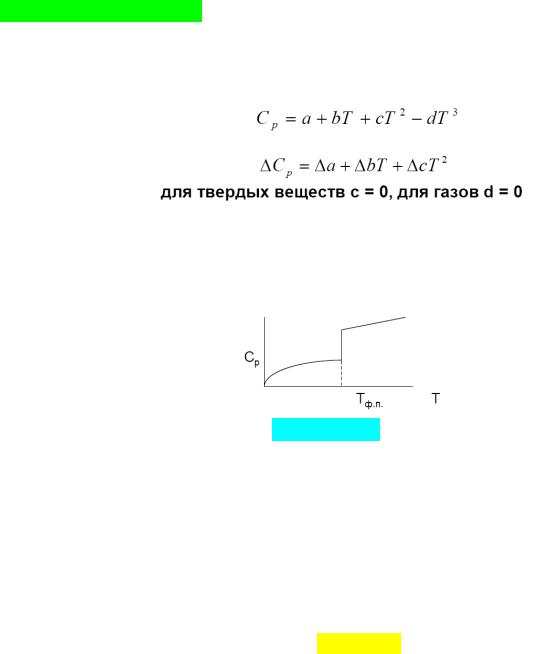
Графически увеличение энтальпии при изменении температуры от Т1 до Т2 равно площади под кривой ср(Т) (если в системе помимо хим. реакции осуществляется фазовый переход, то С системы меняется скачком),
а аналитически это выглядит так (ур. Кирхгофа):
Т
rН°Т2 = rН°298 + ∫ΔrсрdT + ΣΔH°ф.п.(продуктов) – ΣΔH°ф.п.(исх. веществ).
298
Здесь rср = Σνiср(продуктов) –Σνjср(исх. веществ).
3. Энтропия и второе начало термодинамики
Расчет одной энтальпии реакции не отвечает на вопрос: пойдет ли процесс самопроизвольно или он принципиально невозможен. Чтоб на него ответить нужно разобраться с еще одной функцией состояния системы – энтропией. Под энтропией понимается такое свойство системы, изменение которого при обратимом процессе равно отношению теплоты к температуре протекания процесса:
ΔS = Q/T.
Сама функция была введена в термодинамику Рудольфом Клаузиусом, но суть ее была раскрыта много позже Людвигом Больцманом.

Число микросостояний, посредством которых осуществляется данное микросостояние, связано в термодинамической вероятностью, которая определяет энтропию системы: она тем выше, чем больше существует способов реализации макросостояния. Поэтому энтропия является мерой неупорядоченности системы.
S = k·lnω (ур. Больцмана),
где ω – термодинамическая вероятность данного состояния системы (число микросостояний для данного макросостояния), k – постоянная Больцмана (1,38·10–23 Дж/К).
Всякому веществу можно приписать абсолютное значение энтропии, т.к. в идеальном кристалле при 0 К атомы должны находиться в единственном, самом низком энергетическом состоянии, вероятность которого равна 1, а энтропия – 0 (постулат Планка или 3-й закон термодинамики).
Расчет энтропии ведут не формуле Больцмана, а по уравнению классической термодинамики с учетом теплоемкостей и теплот фазовых переходов.

Тпл |
Ткип |
Т |
SТ = S298 + ∫(ср(тв)/Т)dT + ∫(ср(ж)/Т)dT + ∫(ср(г)/Т)dT + ΣΔH°ф.п.Тф.п..
298 |
Тпл |
Ткип |
rS° = ΣνiS°(продуктов) –ΣνjS°(исх. веществ).
Во многих случаях изменение энтропии можно оценить качественно:
1)энтропия всегда увеличивается при переходе из конденсированного состояния в газообразное;
2)она возрастает при растворении твердого или жидкого вещества;
3)чем сложнее состав вещества, тем больше его энтропия;
4)в химических реакциях энтропия возрастает, если в результате увеличивается количество газообразных веществ.
Второе начало термодинамики регламентирует принципиальную возможность протекания процесса, существуют несколько формулировок, например такая: в изолированных системах самопроизвольно идут процессы, при которых происходит увеличение энтропии.
Другие формулировки:
В открытых и закрытых системах на направление процесса влияет еще и изменение энтальпии.
4. Энергия Гиббса
Любая система стремится к минимуму энтальпии и максимуму энтропии. В термодинамике имеется функция состояния, объединяющая энергетический (ΔH<0) и энтропийный (ΔS>0) факторы самопроизвольности процесса – изменение энергии Гиббса G.
ΔG = ΔH – TΔS.

Величина ΔG характеризует ту часть изменения внутренней энергии, которая может быть превращена в полезную работу.
Основная ценность этой функции заключается в том, что ее изменение при постоянной температуре и давлении определяет однозначно термодинамическую вероятность протекания данного процесса в определенном направлении.
Если
ΔG<0 – прямая реакция идет самопроизвольно;
ΔG = 0 – в системе достигнуто состояние равновесия;
ΔG > 0 – самопроизвольная прямая реакция при данных условиях невозможна.
ΔG можно рассчитать из табличных данных по энергиям Гиббса образования веществ по аналогии с энтальпией.
rG°298 = Σνi fG°298(продуктов) –Σνj fG°298(исх. веществ).
fG°298(простых веществ) = 0.
Второй способ основан на формуле:
rG°298 = rH°298 – T·ΔrS°298.
Данный способ позволяет оценить изменение энергии Гиббса процесса при нестандартной температуре, правда при этом не учитываются температурные зависимости энтальпии и энтропии реакции.

Тема №5.
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Химическая термодинамика позволяет определить принципиальную возможность протекания процессов. Но она не показывает как в реальности будет происходить процесс, его механизм и скорость. Например, смесь газообразных водорода и кислорода термодинамически неустойчива и должна самопроизвольно превращаться в воду, однако без внешнего воздействия и в отсутствие катализатора водород с кислородом практически не будут реагировать даже в течение миллионов лет. Время в химию вводит химиче-
ская кинетика.
Химическая кинетика изучает закономерности протекания химических реакций во времени, с ее помощью можно оптимизировать процессы и изучать их механизм.
Основные задачи химической кинетики:
1)расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача);
2)определение механизмов реакций по кинетическим кривым (обратная задача).
Основные различия между химической термодинамикой и кинетикой:
1. В химической термодинамике нет времени, она предсказывает только конечный
результат процесса. Химическая кинетика изучает только изменяющиеся (динамические) системы.
2.Равновесные свойства определяется состоянием как исходных веществ, так и продуктов реакции. Для термодинамики важны левая и правая части химического уравнения. Скорость реакции определяется только состоянием исходных веществ. Для кинетики важна только левая часть уравнения реакции.
3.Термодинамические свойства определяются термодинамической активностью веществ, кинетические свойства – их концентрацией.
Кинетика несколько различно описывается для процессов в гомогенных и гетерогенных системах.
1. Основные положения
Впроцессе химической реакции разрываются старые связи и образуются новые, для
ееосуществления необходимо:
٧столкновение частиц; ٧наличие у частиц достаточной для реакции энергии (преодоление взаимного
отталкивания электронов оболочек атомов); ٧оптимальная ориентация частиц друг относительно друга.
