
лекции для нехимиков-2
.pdf
Тема №7. КОРРОЗИЯ МЕТАЛЛОВ (дополнение)
Коррозия металлов – это разрушение металлов в результате физико-химического взаимодействия с окружающей средой.
Существует множество классификаций и видов коррозии.
По механизму процесса различают два типа коррозии металлов: химическую и электрохимическую.
По характеру разрушения:
–точечная, пятнистая, сплошная;
–язвенная (питтинг) распространяется вглубь металла; межкристаллитная протекает по границам кристаллических зерен;
Внешне язвенная и межкристаллитная коррозии практически не отличаются от местной – точечной. Однако, эти виды коррозии опаснее поверхностной.
Наблюдается еще много видов коррозии: газовая, атмосферная, почвенная, био и так далее. Они являются частными случаями химической или электрохимической коррозии.
1. Химическая коррозия
Химическая коррозия представляет собой самопроизвольное разрушение металлов в среде окислительного газа (например, кислорода, галогенов) при повышенных температурах или в жидких неэлектролитах. Механизм процессов коррозии этого типа сводится к окислительно-восстановительной реакции, в результате которой электроны переходят непосредственно от частиц восстановителя (металла) к частицам окислителя из окружающей среды, т.е. процессы окисления и восстановления не разделены пространственно.
Уравнение реакции окисления металлов кислородом при повышенных температурах можно записать в общем виде:
nMe + m/2 O2↔MenOm.
Эта реакция в соответствии с законами химической термодинамики может протекать при условии, если изменение энергии Гиббса меньше нуля: G0 < 0. Так как по определению изменение энергии Гиббса образования простых веществ равна нулю, то G0 процесса окисления металлов равна G0298 образования соответствующих оксидов. В основном, для всех металлов G0298 их оксидов меньше нуля, что говорит о возможности протекания реакции окисления металла при атмосферном давлении кислорода.
Первой стадией процесса окисления металла кислородом является адсорбция кислорода на поверхности металла. Адсорбция при наличии сродства между металлом и кислородом переходит в химическое взаимодействие с образованием оксидных пленок. Образование пленок на металлах приводит к самоторможению коррозионного процесса, если продукты коррозии обладают защитными свойствами (пассивация).
Образующиеся на поверхности металла оксидные пленки условно делятся по толщине:
1)тонкие – δ = 0,2÷40 нм;
2)средние – δ = 40÷500 нм;
3)толстые – δ = >500 нм.
Тонкие пленки (продукты начальной стадии окисления). Наблюдаются и изучаются с помощью специальных инструментальных методов (электронная микроскопия).

Средние пленки. Видимая часть светового спектра лежит в пределах 368–732 нм, поэтому пленки могут исследоваться оптическими методами по цветам побежалости (интерферометрия), а также рентгеноструктурным анализом.
Толстые пленки. Изучаются обычно весовыми методами.
Свойства оксидных пленок в отношении коррозии были сформулированы правилом Пиллинга и Бедворта (1923 г.): защитными свойствами обладают те оксиды, молярный объем которых превышает объем израсходованного металла.
Коэффициент Пиллинга–Бедворта:
K |
ПБ |
|
Mокс Ме |
|
Vокс |
|
||
|
|
A |
n |
окс |
V |
, |
||
|
|
|
Me |
|
|
Ме |
||
где Mокс – относительная молекулярная масса оксида; AMe – относительная атомная мас-
са металла; n – число атомов металла в формуле оксида; Ме и окс – плотность металла и оксида; Vокс и VМе – объем оксида и металла.
При образуются оксиды, которые в принципе не могут играть защитную роль, так как не закрывают всей поверхности металла, доступной для окисления, и коррозия определяется скоростью чисто химической реакции.
Как показывает практика, защитными свойствами обладают оксиды с
KПБ 1,2 2,5.
При KПБ 2,5 пленки являются с одной стороны слабо связанными с подложкой, с другой трещиноватыми за счет внутренних напряжений. Кроме того они, как правило, летучи.
Коэффициенты Пиллинга–Бедворта KПБ оксидов
Вещество |
A, |
M, |
ρ, |
KПБ |
Веще- |
A, |
M, |
ρ, |
KПБ |
|
г моль 1 |
г см 3 |
|
ство |
г моль 1 |
г см 3 |
|
||
Na |
22,98 |
|
0,971 |
|
Cr |
52,00 |
|
7,160 |
|
Na2O |
61,96 |
|
1,403 |
0,933 |
Cr2O3 |
152,00 |
|
5,210 |
2,009 |
Ca |
40,08 |
|
1,550 |
|
V |
50,94 |
|
6,100 |
|
CaO |
56,08 |
|
3,370 |
0,644 |
V2O3 |
149,88 |
|
4,870 |
1,843 |
Al |
26,98 |
|
2,710 |
|
Fe |
55,85 |
|
7,860 |
|
Al2O3 |
101,96 |
|
3,970 |
1,290 |
Fe2O3 |
159,70 |
|
5,240 |
2,145 |
Ti |
47,90 |
|
4,500 |
|
W |
183,85 |
|
19,230 |
|
TiO2 |
79,90 |
|
3,830 |
1,960 |
WO3 |
231,85 |
|
6,470 |
3,748 |
В подавляющем большинстве случаев ды обладают защитными свойствами.
При образовании монолитной пленки продуктов коррозии контроль за общей скоростью принадлежит тому процессу, для которого характерна наименьшая скорость диффузии.
В случае KПБ 1 скорость коррозии определяется скоростью химической реакции, то есть скоростью взаимодействия металла с окислителем. Такой контроль называется кинетическим. При кинетическом контроле m(прирост массы образца в процессе окисления) являются линейной функцией времени окисления τ
m m0 k

где k – константа скорости реакции; m0 – начальная масса оксида.
При диффузионном контроле реакции окисления металла зависимость прироста массы металла от времени опыта определяется уравнением:
ln m 1lnk 1ln S 2 2
где m – привес массы, г; S – площадь, через которую диффундирует вещество в реакции, см3; τ – время, с; k’ – константа скорости реакции.
Квнутренним факторам газовой коррозии следует отнести следующие.
1.Природа (свойства) металла (сплава).
Этот фактор является важнейшим: именно свойства металла такие, как электронная структура, потенциалы ионизации и сродство к электрону, магнитная восприимчивость и так далее определяют взаимодействия металла с окислителями.
2. Фазовый (структурный) состав.
Дефекты имеющиеся в объеме кристалла выходят на границу раздела, где и концентрируются. Таким образом, граница раздела между кристаллитами становится энергетически более обогащенной или более реакционно-способной. Это является причиной межкристаллитной и питтинговой коррозии (не только химической, но и электрохимической).
3. Механические напряжения.
Любое искажение кристаллической решетки приводит к увеличению ее дефектов. Именно это происходит при механической обработке металлов (прокат, ковка, протяжка, токарная или фрезерная обработка и так далее). Увеличение количества дефектов неизбежно приводит к росту числа активных участков и, следовательно, к возрастанию скорости коррозии.
4. Остаточные деформации.
Остаточные деформации всегда возникают при неравномерном нагреве изделия и некоторых операциях с ним, например, при сварке. Они также увеличивают скорость коррозии металлов и сплавов.
Квнешним факторам коррозии относятся следующие.
1.Состав и состояние газовой среды.
Сухой, чистый воздух содержит (об. %): N2 – 78,09; O2 – 20,95; CO2 – 0,032; Ar – 0,932; Σ Ne, He, Kr – 0,0024. Локально (вблизи промышленных предприятий) состав воздуха существенно отличается от стандартного. В нем присутствуют зачастую выше ПДК такие примеси , как CO, NO, NO2, HCl, NH3, SO2, SO3 и так далее. При повышенной температуре металлы могут взаимодействовать с этими примесями. Например:
Me + CO2 → MeO + CO;
Me + NO2 → MeO + NO;
3Me + SO2 → 2MeO + MeS.
Константы скорости подобных реакций различны, различны и свойства образующихся пленок. Так, скорости окисления Fe, Co, Ni возрастают в ряду H2O → CO2 → O2 → SO2. Медь устойчива в SO2, но неустойчива в O2. Железо неустойчиво во всех средах, а Cr устойчив.
2. Температура.
При кинетическом и диффузионном контроле аналитическая температурная зависимость имеет одинаковый вид
|
m |
|
|
Eр |
|
|
|
|
A exp |
|
|
|
|
|
s |
RT |
|
|||
υ = |
|
|
|
. |
||
|
|
|
|
|
||
Здесь υ – скорость коррозии; Δm – привес массы образца в результате коррозии; S – рабочая площадь образца; ρ – плотность образующегося оксида; Δτ – время опыта; ΔEp – энергия активации процесса.
Это уравнение является основным уравнением газовой коррозии. По величинам A и ∆E можно сделать вывод о типе контроля и способах защиты от коррозии.
3. Темп температурного режима.
Коэффициенты теплового расширения металлов и оксидов существенно различаются. Поэтому при резком повышении температуры, как правило, происходят либо отслаивание пленки от металла, либо растрескивания пленки. И то, и другое ведет к увеличению скорости коррозии. Аналогичная ситуация может наблюдаться и при охлаждении.
2. Электрохимическая коррозия
Электрохимическая коррозия металлов представляет собой самопроизвольное разрушение металлов в средах, проводящих электрический ток. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное растворение металла и катодное восстановление окислителя. Окислительный (анодный) и восстановительный (катодный) процессы пространственно разделены. В этом случае переход зарядов происходит не хаотически, а направленно. В этом и заключается принципиальное различие между химической и электрохимической коррозией.
Электрохимическая коррозия протекает: а) в электролитах – в водных растворах солей, кислот, щелочей, в морской воде, в расплавах солей и щелочей; б) в атмосфере любого влажного газа; в) в почве.
Самопроизвольное протекание процесса электрохимической коррозии сопровождается уменьшением изменения энергии Гиббса (ΔG0 < 0).
При электрохимической коррозии металлов для расчетов процессов, протекающих на анодных и катодных участках корродирующего металла, удобно пользоваться электрохимическими данными – электродными потенциалами.
По механизму протекания электрохимическая коррозия существенно отличается от химической, и по существу обеспечивается работой гальванических элементов. Схематически растворение металла (коррозию) в растворах электролитов можно рассматривать как результат действия большого количества микроскопических короткозамкнутых гальванических элементов, у которых анодные и катодные процессы локализуются на различных участках корродирующей поверхности металла, соприкасающейся с электролитом, и постоянно чередуются.
В основе работы коррозионных гальванических элементов лежат следующие факто-
ры.
1.Наличие адсорбционной пленки влаги (толщина 1 – 5 монослоев) или макропленки (за счет дождя, росы, тумана). Адсорбционной пленкой воды покрыто все в воздухе. Влага растворяет газы, содержащиеся в воздухе. При этом pH становится 4–5.
2.Контакт разнородных металлов (в сплавах – кристаллитов).

3.Энергетическая неоднородность границ раздела (шероховатость поверхности, неметаллические включения в металле – оксиды, сульфиды, карбиды и так далее, термические напряжения, остаточные деформации и т.д.).
Меn+ ок-ль электролит
(металл) А е К (металл)
Как и в любом гальваническом элементе окислительно-восстановительные реакции при электрохимической коррозии могут протекать в том случае, если φокисл-ля. > φвосст-ля.. Причина электрохимической коррозии – наличие в окружающей среде окислителя с более положительным электродным потенциалом, чем электродный потенциал металла.
На анодных участках короткозамкнутых коррозионных микрогальванических эле-
ментов всегда протекает процесс окисления металлов:
Ме0 – nе → Men+,
на катодных – восстановление окислителя. Окислителями при коррозии служат молекулы кислорода О2, хлора Cl2, ионы H+, Fe3+, NO3– и др.
Процессы коррозии металлов, у которых на катодных участках осуществляется процесс восстановления (ионизация) кислорода, растворенного в электролите, называют процессами коррозии металлов с кислородной деполяризацией. С кислородной деполяри-
зацией корродируют металлы, находящиеся во влажной атмосфере; металлы, соприкасающиеся с водой и нейтральными водными растворами солей; металлы, находящиеся в грунте.
Катодный процесс коррозии металлов с кислородной деполяризацией включает следующие последовательные стадии:
1 – растворение кислорода воздуха в электролите; 2 – диффузию молекул растворенного кислорода в объеме электролита к катодным
участкам корродирующего металла; 3 – восстановление (ионизацию) кислорода:
а) в нейтральных и щелочных растворах О2 + 4е +2Н2О → 4ОН–;
б) в кислых растворах О2 + 4е + 4Н+ → 2Н2О;
4 – диффузию и перенос ионов ОН– от катодных участков корродирующего металла вглубь раствора.
В большинстве случаев наиболее медленной (затрудненной) стадией катодного процесса является диффузия молекул растворенного кислорода к поверхности металла.
Процесс коррозии металлов с кислородной деполяризацией возможен, если
Men 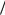 Me0 O2
Me0 O2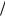 4OH .
4OH .
Процессы коррозии металлов, у которых на катодных участках осуществляется процесс восстановления ионов водорода, принято называть коррозией металлов с водородной деполяризацией. С водородной деполяризацией корродируют металлы, соприкасающиеся с растворами кислот, например, стальные железнодорожные цистерны, в которых перевозят кислоты, металлические баки и различные аппараты на химических заводах, металлическое оборудование цехов гальванических покрытий и т.д.

Катодный процесс коррозии металлов с водородной деполяризацией в кислых средах включает следующие стадии.
1 – диффузию (подвод) гидратированных ионов водорода Н+·Н2О к катодным участкам корродирующего металла;
2– восстановление гидратированных водородных ионов: Н+·Н2О + е →Надс. + Н2О;
3– рекомбинацию (моляризацию) адсорбированных на металле атомов водорода:
Надс. + Надс. = Н2;
4 – диффузию и перенос молекулярного водорода от катодных участков вглубь раствора, а затем его выделение в атмосферу.
Медленной стадией сложного электрохимического процесса восстановления водорода является вторая стадия процесса, т.е. восстановление гидратированных водородных
ионов. Упрощенно уравнение второй стадии можно представить так: 2Н+ +2е → Н2.
Скорость катодного процесса выделения водорода возрастает с увеличением температуры и концентрации ионов водорода (снижение рН). На скорость этого процесса заметно влияет природа катодных участков. Чем ниже перенапряжение выделения водорода на катодных участках, чем больше площадь катодных участков и большее число микрокатодов на поверхности металла, тем больше скорость восстановления ионов водорода, а значит и больше скорость растворения анодных участков корродирующей поверхности металла.
При большой затрудненности реакции рекомбинации атомов водорода (третья стадия) увеличивается возможность растворения Надс. в металле с последующей диффузией водорода вглубь металла, что приводит к появлению водородной хрупкости. Процесс коррозии металла с водородной деполяризацией возможен, если
Men  Me0 2Н
Me0 2Н  Н2 .
Н2 .
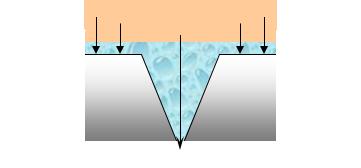
Рассмотрим процессы протекающие при атмосферной коррозии металла, если на поверхности металла имеются неровности, царапины, щели (коррозия при неравномерной аэрации, т.е. неравномерном доступе кислорода воздуха).
Во влажной атмосфере на поверхности металла конденсируются водяные пары. В образовавшейся пленке влаги растворяются газы, жидкости и твердые вещества из воздуха, в результате чего раствор становится электропроводным и коррозия протекает по электрохимическому механизму.
Восстановитель – металл, окислитель – растворенный кислород O2  4OH = +0,805 В.
4OH = +0,805 В.
Коррозия возможна, если φ0Меn+/Me < O2 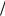 4OH . Коррозионный процесс описывается урав-
4OH . Коррозионный процесс описывается урав-
нениями:
А(–) Ме – nе → Меn+; К(+) O2 + 4е + 2H2O → 4OH–.
Найдем распределение катодных и анодных участков на поверхности металла.
Для процесса восстановления О2 наиболее медленной является стадия диффузии молекул растворенного в воде кислорода или кислорода из воздуха к поверхности металла. Поэтому там, где слой электролита наиболее тонок, концентрация кислорода выше, и катодный процесс на таких участках будет протекать с наибольшей скоростью. В данном случае такими участками будут участки поверхности около щели. В растворе на этих участках будут накапливаться продукты катодного процесса – ОН–-ионы. Металл в глубине щели, где катодный процесс затруднен, становится анодом и разрушается. Там на-
капливаются продукты анодного процесса Men+-ионы. Если корродирует сталь, в резуль-
тате протекающих в растворе вторичных процессов:
Fe2+ + 2ОН– → Fe(OH)2,
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
образуется обычный продукт атмосферной коррозии железа – ржавчина FeО(OH).
Следовательно, в данном случае
|
О2 |
причиной |
разделения |
катодных |
и |
|
|
||||
|
|
анодных участков является неодина- |
|||
|
|
||||
К |
К |
ковый доступ кислорода воздуха |
к |
||
|
|
различным |
участкам |
поверхности |
|
|
|
корродирующего металла, т.е. нерав- |
|||
|
|
номерная аэрация. |
|
|
|
А
3.Методы защиты металлов от коррозии
Для металлов термодинамически устойчивым является окисленное (ионное) состояние, в которое металлы неизбежно переходят с течением времени. Используя разнообразные методы можно замедлить этот процесс, но ликвидировать полностью невозможно.
Существуют следующие методы защиты от коррозии:
модифицирование среды;
модифицирование металла;
неметаллические покрытия;
металлические покрытия;
электрохимическая защита.
Некоторые методы защиты используются в случае химической коррозии, некоторые для обоих механизмов.
Рассмотрим некоторые методы.
1.Увеличение сопротивления металла путем нанесения на металл различных покрытий (органических, например, лакокрасочных; неорганических, например, оксидных и т.д.).
2.Нанесение металлических покрытий. Они могут быть катодными (покрытие менее активным металлом) и анодными (покрытие более активным металлом). При нарушении покрытия коррозия протекает так же, как при любом контакте двух металлов.
3.Обработка коррозионной среды. Нейтрализация кислых сред – кислых шахтных вод и кислых грунтов (в целях защиты газо- и трубопроводов) производится с помощью оксида кальция. Обескислороживание (деаэрация) воды осуществляется: нагреванием раствора (термическая деаэрация) и продуванием раствора инертным газом. Обработка коррозионной среды производится также применением замедлителей коррозии (ингибиторов) жидких коррозионных сред. Ингибиторы уменьшают скорость коррозии, главным образом, за счет увеличения анодной или катодной поляризации.
4.Электрохимическая защита – протекторная (контакт защищаемого металла с более активным металлом-протектором), а также катодная или анодная защита (с помощью подключения к внешнему источнику тока).
5. Легирование – введение в металл добавок хрома, никеля и др. металлов, способствующих переходу сплава в пассивное состояние.
При этом пассивность наступает в результате образования на поверхности металла особых беспористых нерастворимых пленок (оксидов, иногда гидроксидов и солей). Такие пленки свободно пропускают электроны, но не пропускают ионы металла в раствор, т.е. резко тормозят процесс окисления и, следовательно, увеличивают анодную поляризацию. В результате скорость коррозии уменьшается практически до нуля. Пассивные
пленки могут образоваться на поверхности под действием сильных окислителей (О2, HNO3 конц. и H2SO4 конц., ионов Cr2O72–, NO2– и некоторых других).
Нарушение пассивности может происходить при механическом повреждении пассивной пленки, повышении температуры, действии энергичных активаторов электрохимической коррозии – ионов Cl–, Br–, I– которые, сорбируясь на поверхности оксидной пленки вытесняют и замещают в ней ионы кислорода, за счет чего оксидная пленка на металле растворяется, что приводит к образованию пор с соответствующим ускорением анодного процесса, т.е. коррозии металла.
