
курсовая работа, топт, химия
.doc
АННОТАЦИЯ
Курсовая работа по курсу «ТОПТ». Челябинск: ЮУрГУ, 2011
Курсовая работа состоит из решения семи задач и заключения. Описывается решение задач по соответствующим разделам. В заключении подводится итог проведенной работы.
СОДЕРЖАНИЕ
1. ЗАДАНИЯ...……………………………………………………………….4
2. УСЛОВИЕ………………………………………………………………....5
3. РЕШЕНИЕ…..……………………………………………………………..6
4. ЗАКЛЮЧЕНИЕ…………………………………………………………..11
Задания:
-
Построить графики зависимостей lnP от 1/Т и рассчитать величины постоянных коэффициентов в интегральных уравнениях Клаузиуса – Клапейрона для фазовых равновесий.
Аж=Агаз, Атв=Агаз.
-
Вычислить теплоты испарения, возгонки и плавления вещества, считая постоянными в исследованном интеграле температур.
-
С помощью полученных аналитических зависимостей р=ƒ(Т), рассчитать точные координаты тройной точки, характеризующей трехфазное равновесие Атв=Аж=Агаз.
-
Построить диаграмму фазовых равновесий в координатах Р – Т, проведя линии по расчетным значениям Р и Т и нанеся на график экспериментальные точки и линию двухфазового равновесия Атв=Аж.
-
Определить количественно влияние внешнего давления на температуру плавления вещества, определив величину ∆Т/∆Р.
-
Рассчитать нормальные температуры кипения и плавления вещества и температуры плавления вещества А при давлении Р.
-
Результаты расчетов представить в сводной таблице. Сделать выводы по курсовой работе.
Условие:
Таблица
Равновесие Атв=Аж=Агаз.
|
Твердое состояние |
Жидкое состояние |
Условия |
||
|
Т, К |
Р, Па |
Т, К |
Р, Па |
|
|
268,2 269,2 270,2 271,2 272,2 |
401,2 437,2 475,2 517,2 533,2 |
269,2 272,2 273,2 275,2 278,2 283,2 288,2
|
505 533,2 573 656 760 982 1600
|
М=18 г/моль dтв=0,918г/см3 dж=1,000 г/см3 Р=40,5 *105Па |
Решение:
1. Согласно уравнению Клаузиуса - Клапейрона для равновесий
Атв = Агаз и Аж = Агаз
имеем в предположении постоянства теплот сублимации и испарения
![]()
![]()
Равновесие А(тв)=А(газ)
401,2
437,2
475,2
517,2
533,2
|
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ |
|||
|
Т,К |
Р(тв),Па |
х= |
y=lnp |
|
268,2 |
401,2 |
3,73 |
5,99 |
|
269,2 |
437,2 |
3,71 |
6,08 |
|
270,2 |
478,2 |
3,7 |
6,17 |
|
271,2
|
517,2 |
3,69 |
6,25 |
|
272,2 |
533,2 |
3,67 |
6,28 |
Равновесие А(ж)=А(газ)
|
Т,К |
Р(ж), Па |
х= |
y=lnp |
|
269,2 275,2 278,2 283,2 288,2
|
505 |
1,98 |
6,22 |
|
272,2 |
533,2 |
3,67 |
6,28 |
|
273,2 |
573 |
3,66 |
6,35 |
|
275,3 |
656 |
3,63 |
6,49 |
|
278,2 |
760 |
3,59 |
6,63 |
|
283,2 |
982 |
3,53 |
6,89 |
|
288,2 |
1600 |
3,47 |
7,38 |
Построим график зависимости lnp от 1/Т.
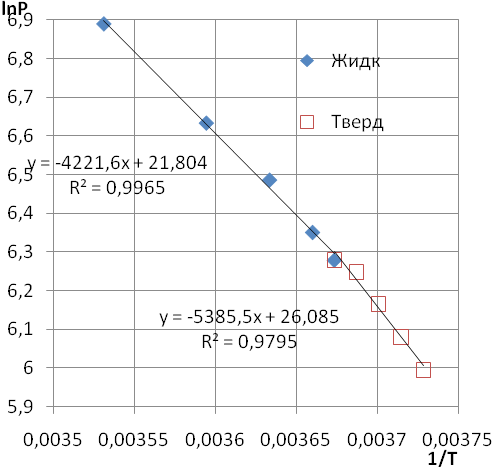
Рис.1 Графическое представление постоянных уравнения Клаузиса-Клапейрона
Из графика получаем постоянные А и А (угловые коэффициенты прямых),
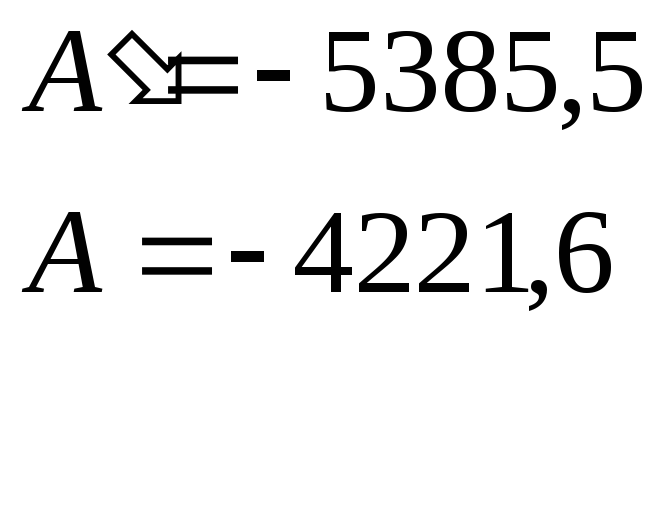
И постоянные интегрирования
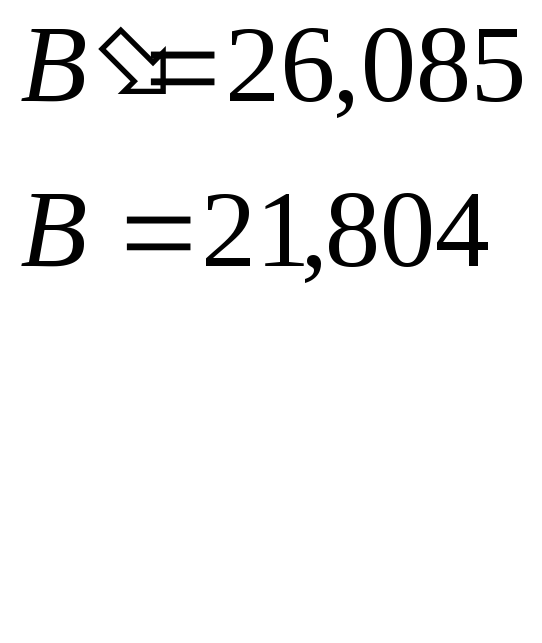
Таким образом, в исследованном интервале температур зависимости упругости пара над твердым и жидким веществом описываются уравнениями (Па)
![]() (1) или
(1) или
![]()
![]()
![]() (2) или
(2) или
![]()
2. Теплоту возгонки (сублимации) и испарения определяем по величинам А и А
∆Нвозг=–R*A=–8,314*(-5385,5)=44775 Дж/моль;
∆Нисп=–R*A=–8,314*(-4221,6)=35098 Дж/моль.
Теплоту плавления вещества вычисляем, используя закон Гесса,
∆Нсубл.= ∆Нпл.–∆Нисп,
Отсюда ∆Нпл.= ∆Нсубл.–∆Нисп,
∆Нпл=44775–35098= 9677Дж/моль.
3.4.Точные координаты тройной точки можно определить, приравняв правые части уравнений (1) и (2):
ln p(тв) = ln p(ж)
![]()
![]()
Отсюда температура трехфазного равновесия Т0 :
Т0= 5385,5-4221,6= 1163,9= 271,9 К
26,085-21,804 4,281
Т0=271,9 К
Давление паров трехфазного равновесия
Атв=Аж=Агаз
Вычисляем, подставив Т0 =271,9 К в уравнение (1) или (2),
![]()
Координаты тройной точки:
Р0 = 533,7 Па; Т0 = 271,9К.
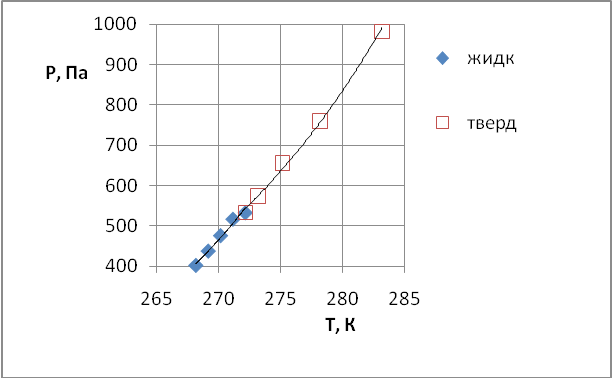
Рис.2 Диаграмма фазовых равновесий (Р-Т- диаграмма) чистого вещества А:
линия ОА – двухфазное равновесие Атв=Агаз,
линия ОК – двухфазное равновесие Аж=Агаз,
линия ОВ – двухфазное равновесие Атв=Аж
точка О характеризует параметры трехфазного равновесия Атв=Аж=Агаз.
5. Оценить
влияние внешнего давления на температуру
плавления вещества можно по знаку и
величине производной
![]() Найти ее можно с помощью уравнения
Найти ее можно с помощью уравнения
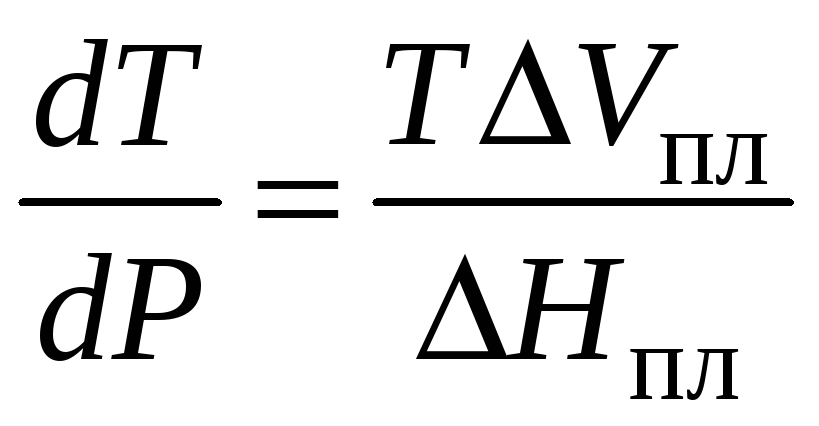 (3),
в котором
(3),
в котором
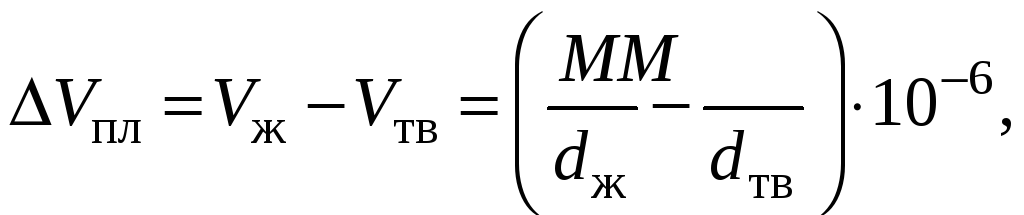
где М – молекулярная масса исследуемого вещества, г/моль;
dтв, dж – плотности твердого и жидкого вещества, г/см3.
В данном расчете можно воспользоваться найденной ранее температурой трехфазного равновесия То = 271,9,4 К, представляющей одновременно температуру плавления вещества при давлении р0 = 533,7 Па
Тогда:
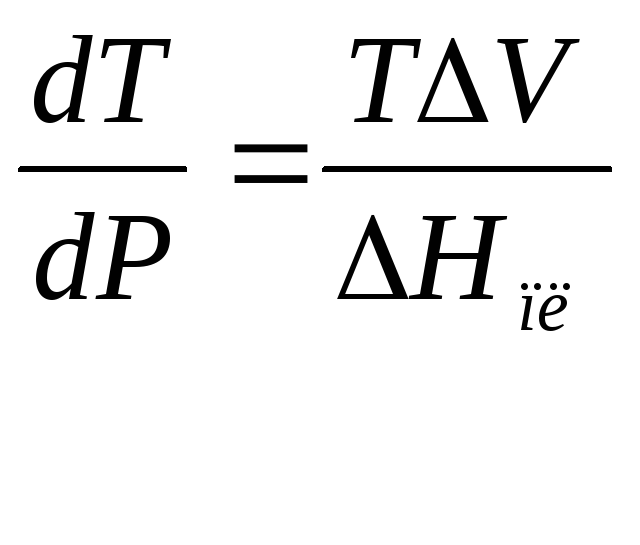
В котором
Vпл=Vж-Vтв
=![]()
Значит:
![]()
271,9*1,61*10 в минус 6 деленное на 9677 = 0,045*10в минус 6
Так как ![]() > 0, то следует сделать вывод, что с
ростом давления температура плавления
должна увеличиваться.
> 0, то следует сделать вывод, что с
ростом давления температура плавления
должна увеличиваться.
6. Нормальную (при Рвн = 1 атм = 1,013105 Па) температуру кипения рассчитываем по формуле (2) с учетом того, что всякая жидкость закипает тогда, упругость ее паров равна внешнему давлению Р(ж) = Рвн
![]()
Отсюда получаем
![]()
Линия двухфазного
равновесия будет практически вертикальной
прямой ОВ,
исходящей из тройной точки. Поэтому
можно принять приближенно, что
![]() .
.
Тогда при расчете нормальной температуры плавления вещества (при Рвн = 1 атм = 1,013105 Па)
dT = ∆ T = T0-T0 = T0-271,9 = 0,02*10-6 К
dP ∆ P P0-P0 1,013*105-533,7 Па
T0= (1,013*105-533,7)* -0,02*10-6+271,9=228,7 К
Нормальная температура плавления вещества T0=271,9 К, то есть увеличение внешнего давления до 1 атм приводит к уменьшению температуры плавления .
Температура плавления вещества при давлении 40,5*105 (Па) вычисляется аналогично расчету нормальной температуры плавления вещества.
dT = ∆ T = Tρ-T0 = Tρ-271,9 = 0,02*10-6 К
dP ∆ P P-P0 40,5*105-1,013*105 Па
Tρ= (40,5*105-1,013*105)* 0,02*10-6+271,9=792,4 К
Температура плавления вещества при давлении 40,5*105 (Па) Тр=792,4К, то есть увеличение внешнего давления до 40,5*105 (Па) приводит к увеличению температуры плавления на 2 градуса.
Заключение:
1)Построили график зависимости lnp от 1/T и рассчитали величины постоянных коэффициентов в уравнениях для Клаузиса – Клапейрона.
2) Вычислили теплоты испарения, возгонки и плавления вещества, считая их постоянными.
3)Рассчитали точные координаты тройной точки.
4)Построили диаграмму фазовых равновесий в координатах.
5) Определили количественно влияние внешнего давления на температуру плавления вещества.
6)Рассчитали нормальные температуры кипения и плавления вещества.
Результаты расчетов приведены в сводной таблице.
|
A |
A |
-5385,5 |
|
A |
-4121,6 |
|
|
B |
B |
26,085 |
|
B |
21,804 |
|
|
Теплота испарения |
∆Hисп. |
35098Дж/моль |
|
Теплота возгонки |
∆Hвозг. |
44775Дж/моль |
|
Теплота плавления |
∆Hпл. |
9677Дж/моль.
|
|
Координаты тройной точки |
P |
533,7Па |
|
T |
271,9К. |
|
|
Температура плавления |
Tпл. |
228,7 |
|
Температура кипения |
Tкип. |
524,2 |
