
4. Основные элементы физической химии
При сварке плавлением между расплавленным металлом, шлаком и окружающей газовой средой протекают сложные физико-химические процессы.
Условия взаимодействия между реагентами в зоне реакции весьма своеобразны и имеют следующие особенности:
1) высокую и быстро изменяющуюся температуру в зоне сварки;
2) кратковременность взаимодействия реагентов;
3) хорошо развитую поверхность взаимодействия.
Чтобы получить металл шва заданного химического состава, нужно уметь управлять ходом металлургических процессов, для чего совершенно необходимо знать основные законы физической химии.
М. В. Ломоносов дал определение физической химии как науки об исследовании химических процессов с помощью физических методов.
В настоящее время физическая химия превратилась в обширную отрасль знаний о наиболее общих законах химических превращений. Одним из важнейших разделов физической химии является химическая термодинамика.
Первое начало? термодинамики.
В термодинамике рассматриваются процессы, связанные с тепловыми явлениями.
Процессы, протекающие в тепловых машинах, изучает техническая термодинамика,
тепловые явления, сопровождающие химические реакции,— химическая термодинамика.
Химическая термодинамика построена, главным образом, на двух началах, или законах, вытекающих из обобщения многовекового человеческого опыта, причем ни одно из следствий этих законов не противоречит опыту.
Начала термодинамики справедливы для любого тела или группы тел. При этом будем иметь в виду, что тело или группа тел, находящихся во взаимодействии и мысленно обособленных от окружающей среды, называются системой.
В основу первого начала термодинамики положен закон сохранения энергии, впервые сформулированный М. В. Ломоносовым (1748 г.). Согласно этому закону взамен энергии одного вида, исчезающей в каком-либо процессе, появляется энергия другого вида в количестве, строго эквивалентном первому.
Техническая термодинамика
Существует несколько эквивалентных формулировок первого начала термодинамики
В любой изолированной системе запас энергии остаётся постоянным. Это — формулировкаДж. П. Джоуля(1842 г.).
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
В окружающем нас мире энергия проявляется в виде механической работы, теплоты и внутренней энергии тела. ?
Среди различных форм энергии, встречающихся в химических процессах, особое значение имеет внутренняя энергия U, которая находится в скрытом виде в каждом веществе и слагается из энергии поступательного, колебательного и вращательного движений элементарных частиц и энергии взаимодействия этих частиц.?
Количество внутренней энергии системы зависит не только от природы составляющих ее веществ и их массы, но и от состояния системы, т. е. от внешних условий, в которых она находится.
Из внешних условий, влияющих на величину внутренней энергии системы, следует учитывать объем V, давление р и температуру Т. Эти три переменных фактора определяют термодинамическое состояние системы и могут изменяться в любом физико-химическом процессе.Следовательно,U = f (V, р, Т).
Поскольку внутренняя энергия зависит от количества вещества, ее относят к молю этого вещества. Единицей же ее измерения обычно является тепловая единица — калория. ?
Изменение внутренней энергии не зависит от пути перехода системы из одного состояния в другое, а определяется лишь параметрами начального и конечного состояний этой системы.
Формами превращения внутренней энергии при изменении состояния системы являются теплота и механическая работа. Изменение внутренней энергии может происходить за счет подвода к системе или отвода от нее тепла. Оно может явиться и результатом работы, совершенной самой системой или над ней.
Тепло: Q = q * t
где q – тепловой поток,
t – время.
варианты теплообмена системы с окружающим миром:
Если
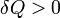 ,
то это означает, что тепло к системеподводится.
,
то это означает, что тепло к системеподводится.Если
 ,
аналогично — теплоотводится.
,
аналогично — теплоотводится.Если
 ,
то система не обменивается теплом с
окружающей средой и называетсяадиабатически
изолированной.
,
то система не обменивается теплом с
окружающей средой и называетсяадиабатически
изолированной.
Работа: A = F * Δs = p * ΔV
где F – сила,
Δs – перемещение,
p – давление,
ΔV – изменение объема.
Внутренняя энергия: ΔU = c * m * Δt,
где c – удельная теплоемкость,
m – масса материала.
Частные случаи проявления первого начала термодинамики:
при изобарном процессе (р=const)
![]()
при изохорном процессе (
 )
)
![]()
при изотермическом процессе

![]()
Здесь
![]() —массагаза,
—массагаза,![]() —молярная
массагаза,
—молярная
массагаза,![]() —молярная
теплоёмкостьпри постоянном объёме,
—молярная
теплоёмкостьпри постоянном объёме,![]() —давление,объёмитемпературагаза соответственно, причём последнее
равенство верно только для идеального
газа.
—давление,объёмитемпературагаза соответственно, причём последнее
равенство верно только для идеального
газа.
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Это определение особенно важно для химической термодинамики (ввиду сложности рассматриваемых процессов). Иными словами, внутренняя энергия является функцией состояния: р, V и T.
ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
Термохимия.
Термохимия– раздел химической термодинамикио тепловых эффектах химических и физико-химических процессов.
Тепловой эффект химической реакции это количество теплоты, которое выделяется или поглощается в процессе реакции (экзо- и эндотермические реакции).
Реакции, протекающие с выделением тепла, называются экзотермическими, а с поглощением —эндотермическими.
Тепловой эффект относят, как правило, к одному молю прореагировавшего исходного вещества при стехиометрическомсоотношении реагирующих компонентов.
Тепловой эффект, определенный при постоянном давлении, называется изобарным тепловым эффектом, а при постоянном объеме – изохорным тепловым эффектом.
Абсолютное большинство реакций, протекающих в природе, происходит при постоянном давлении, так как окружающая атмосфера практически является бесконечно упругой и давление, оказываемое ею на систему, остается постоянным, независимо от изменения её объема; поэтому в термохимии обычно пользуются изобарными тепловыми эффектами.
На характер протекания химических реакций влияют законы технической термодинамики.
Если химическая реакция идет без изменения объема, то на преодоление сил внешнего давления работа не затрачивается (А = 0) и, следовательно, подвод или отвод тепла из системы реализуется в виде изменения внутренней энергии вещества (нагрев или охлаждение.
Такой процесс наблюдается при
взаимодействии твердых или жидких
веществ без образования газовой фазы;
изменение объема этих веществ настолько
мало, что им можно пренебречь. Если
химическая реакция протекает при
постоянном давлении,часть
энергии системыможетрасходоваться
на совершение работы расширения. В
этом случае наблюдается изменение
объема наΔV
и совершается работа![]() Тогда изменение внутренней энергииU
можно выразить так:U=QP+A
Тогда изменение внутренней энергииU
можно выразить так:U=QP+A
При переходе системы из одного состояния в другое в условиях постоянного давления комбинированным показателем состояния вещества является
![]()
Эта термодинамическая функция называется энтальпией, или теплосодержанием. Она представляет собой сумму внутренней энергии U и работы расширения, или объемной энергии pV, переданной в окружающую среду.Поэтому энтальпию иногда называютэнергосодержанием.
Следовательно, уравнение теплового
эффекта реакции можно представить так:
![]()
Иначе говоря, поглощенная теплота в процессах, протекающих при постоянном давлении, расходуется на приращение энтальпии.
Таким образом, тепловой эффект реакции при постоянном давлении отличается от теплового эффекта реакции при постоянном объеме на величину совершенной работы: QP = Qv + p*V
Закон Гесса и вычисление теплового эффекта реакций.
При разработке проектов технологических процессов, сопровождаемых химическими превращениями, важно знать их тепловые эффекты химических реакций.
Эти эффекты определяют с помощью
калориметра, но в нем можно осуществить
далеко не все реакции. В таких случаях
тепловой эффект реакций можно установить,
пользуясь законом
Г. И. Гесса (1840 г.), согласно которому
тепловой
эффект реакции не зависит
от
пути ее (промежуточных стадий), а лишь
от начального и конечного состояний.
Такое утверждение справедливо
при условии, что реакции протекают при
постоянном объеме или постоянном
давлении. Тогда из уравнений![]()
следует, что тепловые эффекты превращений действительно не зависят от пути перехода из одного состояния в другое, так же, как и изменение функций состояния U и Н.
На примере реакции сгорания углерода рассмотрим применение закона Гесса для вычисления теплового эффекта реакции. Сгорание углерода до углекислоты можно провести двумя путями:
1) непосредственным, прямым сгоранием по реакции
![]()
2) последовательно, в две стадии, по реакциям

В соответствии с законом Гесса суммарный тепловой эффект двух последних реакций равен тепловому эффекту полного сгорания, так как оба пути имеют одинаковое начальное (С и 02) и конечное(СО2) состояния. Тогда
![]()
Пользуясь термохимическими таблицами, с помощью закона Гесса можно вычислить тепловые эффекты любых реакций, если известны энтальпии всех веществ, участвующих в реакциях.Тогда тепловой эффект реакции равен алгебраической сумме энтальпий веществ реакции с учетом коэффициентов химического уравнения.
Обычно в таблицах термодинамических свойств веществ даны стандартные энтальпии (тепловые эффекты при постоянном давлении), отнесенные к 25 °С (298 °К) и внешнему давлению р =1am. Таким образом,
![]()
Для вычисления тепловых эффектов реакций при температурах, отличающихся от стандартных, нужно знать теплоемкости реагирующих веществ и зависимость их от температуры.
Вычисление теплоемкостей веществ.В физической химии обычно пользуются
понятиемистинной
теплоемкости, определяемой
как бесконечно малое количество тепла,
которое нужно подвести к веществу для
повышения его температуры на бесконечно
малую величину:

В зависимости от того, к какому количеству вещества относится истинная теплоемкость, она может быть атомной — кал/(г-атом • °С) или молекулярной — кал/(моль • °С).
Различают теплоемкость при постоянном объеме cv и теплоемкость при постоянном давлении ср. Последняя всегда больше, так как при постоянном давлении теплота расходуется не только на нагревание, но ина совершение работы. Более конкретную зависимость междуср ису можно получить, отнеся в обоих процессах подведенное тепло к одному молю вещества и к 1 °С.
![]()
Теплоемкость вещества зависит от температуры, увеличиваясь с повышением последней. Эту зависимость можно выразить с помощью эмпирических уравнений вида степенных рядов:

В табл. 22 приведены уравнения для определения теплоемкости ср в зависимости от температуры некоторых веществ, участвующих в сварочных процессах.Т — абсолютная температура, °К.
……………………………………………………………………………..
Второе начало термодинамики.
Первое начало термодинамики, связывающее между собой энергетические эффекты химических процессов, еще не дает полной характеристики этих процессов, так как ничего не говорит об их направлении и возможности реализации.
Второе начало термодинамики решает вопрос о направлении естественных, самопроизвольно протекающих процессов и утверждает, что они приводят систему в более равновесное состояние.Существует несколько различных формулировок второго начала, которые на первый взгляд не связаны со сказанным. М. В. Ломоносов в 1747 г. впервые сформулировал основное положение второго начала термодинамики:Холодное тело В, погруженное в тело А, не может воспринять большую степень теплоты, чем какую имеет тело А.
Известны и иные формулировки второго начала. Например: Невозможен процесс, единственным результатом которого было бы превращение теплоты в работу.
Отсюда следует, что полностью превратить теплоту в полезную работу нельзя, и что должны существовать границы и условия, при которых это превращение будет наиболее полным.
Если с первым началом термодинамики связано появление функции состояния системы — внутренней энергии, то второе начало вводит новую функцию состояния — энтропию.
Энтропия.
Условно можно разделить процессы на два вида — необратимые и обратимые.
Для необратимых процессов характерно самопроизвольное одностороннее течение в направлении достижения равновесия.Примерами таких процессов могут быть: переход тепла от нагретого тела к холодному, химические реакции типа взрывных, взаимная диффузия газов или жидкостей, испарение перегретой жидкости и др.
Общим для этих процессов является превращение различных видов энергии в тепло с последующим равномерным распределением его между составляющими системы.
В термодинамическом смысле обратимым называется процесс, который можно провести не только в прямом, но и в обратном направлении так, что сама система и окружающая ее среда возвратятся в первоначальное состояние.
В природе вполне обратимых термодинамических процессов нет, так как всегда есть источники необратимости в виде безвозвратных потерь на трение, превращения электрической, световой и других видов энергии в теплоту. Поэтому вполне обратимые термодинамические процессы — это абстракция, идеальные предельные случаи реальных процессов.
Энтропиия - это функция, однозначно зависящая от параметров состоянияр, V, Т, названа Клаузиусом (1854 г.) и обозначенаS. S = Q/T
Для обратимых процессов изменение энтропии равно нулю:Q/T = 0
Для необратимых самопроизвольно протекающих процессов изменение энтропии больше нуля:
Q/T > 0
Последнее означает, что по мере самопроизвольного развития необратимого процесса его энтропия возрастает и достигает максимального значения в состоянии равновесия.
Примеры: полет пули, кофе с молоком.
Проблема вечного двигателя.
Следовательно, энтропия является количественной мерой необратимости процесса, мерой рассеянии энергии.
Энтропия имеет размерность такую же, как и теплоемкость кал/(моль • град), но в отличие от последнейхарактеризует количество рассеянной энергии, отнесенной к 1°температуры.
Энтропия(по одному из определений) – это показатель неупорядоченности, или хаотичности, системы. Говоря простым языком, чем больший хаос (движение) царит в системе, тем выше её энтропия. Для термодинамических систем энтропия тем выше, чем более хаотично движение материальных частиц, составляющих систему (например, молекул).
Со временем учёным стало понятно, что энтропия – понятие более широкое и может применяться не только к термодинамическим системам. В общем-то, любая система имеет определённую долю хаоса, которая может изменяться – увеличиваться или уменьшаться.
Откройте там же флакончик с духами, и запах распространится по комнате. Но ничто не заставит его вернуться обратно во флакон.
Зажгите там свечу, и она сгорит, но ничто не заставит дым снова превратиться в свечу. Всем этим процессам свойственна направленность и необратимость. Причина такой необратимости процессов, происходящих не только в этой комнате, но и во всей Вселенной, как раз и кроется во втором начале термодинамики. Все выравнивается и успокаивается. Это ведет к рассуждениям о конечности или бесконечности системы и т.п.(остывание Земли?, замедление движения звезд и планет в Галактике?, что-то или кто-то запустил это механизм? и т.д.)
Для технологических процессов важно, что процесс передачи теплоты от горячего тела к холодному, является необратимым.
О ХИМИЧЕСКОМ РАВНОВЕСИИ
Химическое равновесие соответствует состоянию покоя в химическом процессе и его достижение подчиняется второму закону термодинамики.
Равновесием называется термодинамическое состояние химической системы, не изменяющееся во времени при данных внешних условиях ее существования и характеризующееся минимальным значением изотермных потенциалов.
Равновесие химических реакций динамическое, подвижное,так как в такой системеодновременно протекают взаимно противоположные процессы: образование из исходных веществ продуктов реакции и из продуктов реакции — исходных веществ.
О совершающихся в химической системе превращениях можно судить по уравнениям реакций. Они дают наглядное представление о ходе химического процесса, позволяют установить количественные соотношения между участвующими в них веществамиивыполнять разнообразные расчеты, связанные с количественной стороной процесса.
Однако из химического уравнения неясно, какому соотношению между исходными веществами и продуктами реакции отвечает состояние равновесия и в каком положении относительно равновесия будет находиться данная реакция.
Закон действующих масс и константа равновесия. Химическое равновесие в гомогенной среде.
Моль есть количество вещества системы, содержащей столько же структурных элементов (атомов или молекул), сколько содержится атомов в углероде-12 массой 0,012 кг.
При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Количество специфицированных структурных элементов в одном моле вещества называется постоянной Авогадро (число Авогадро равно 6,02214129·1023 моль−1).
Гомогенной называется такая система, внутри которой нет поверхностей раздела, отделяющих одну часть системы от другой.Это может быть, например,газовая смесь, различные жидкие растворы и др.
Рассмотрим химическую реакцию между
газообразными веществами:
![]()
где a, b, c, d — стехиометрические коэффициенты, или число молей, веществ А, В, С, D соответственно. В таком виде химическое уравнение говорит о том, что реакция одновременно идет в обоих направлениях.
Примем, что в направлении слева направо реакция идет с положительным тепловым эффектом. Если в начальный период скорости протекания реакции в прямом и обратном направлениях не одинаковы, то по мере приближения к состоянию равновесия они становятся близкими друг к другу, а при равновесии достигают равных значений.
При заданных внешних условиях наибольшее влияние на скорость протекания реакции оказывает концентрация реагирующих веществ.
Зависимость между этими величинами четко определена законом действующих масс, согласно которому при постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждое из них влияет на скорость в степени, равной стехиометрическому коэффициенту в уравнении реакции.
Следовательно, для
состояния равновесия реакции должно
быть
![]()
где kx и k2 — константы скоростей реакции;С А, СВ, СС, CD — концентрации веществ,
представленные обязательно в молях на литр. Тогда
![]()
где Кс — константа равновесия реакции.
Таким образом, в состоянии равновесия отношение концентрации веществ, стоящих в правой части уравнения, к концентрации веществ, стоящих в его левой части, есть величина постоянная.
Если вещества, участвующие в реакции, газообразные и подчиняются уравнению идеальных газов(при малых и умеренных давлениях), то константа равновесия реакции может быть выражена иными средствами.

Здесь рс, pD, Ра, Рв - парциальные давления соответствующих газообразных веществ,am.
Химическое равновесие в гетерогенной среде.
Гетерогенной называется такая система, в которой есть поверхности раздела между частями или фазами ее. Такие системы наряду с газовой могут содержать конденсированные фазы — жидкие или твердые.
Рассмотрим возможность применения закона действующих масс к подобным системам. Для примера возьмем реакцию диссоциации углекислого кальция. Ее гетерогенный характер подтверждается тем, что в ней одновременно присутствуют два твердых и одно газообразное
вещество:
![]()
Наличие в этой реакции веществ в конденсированном, в частности в твердом, состоянии определяет особенности рассматриваемого процесса.
Над поверхностью любого из них образуется насыщенный пар, давление или упругость которого в условиях неизменности состава твердых фаз определяется только температурой процесса. Так как упругость паров Рсасо3 и Рсао для данной температуры постоянна и весьма мала, их величина не входит в уравнение равновесия и тогда

Соответственно, для таких реакций применение закона действующих масс достаточно просто: в этом случае константа равновесия реакции определяется парциальным давлением газа.
В подобных процессах при известных условиях реакция может практически дойти до конца, если, например, образующуюся газообразную углекислоту С02 непрерывно удалять из зоны реакции.
При расчете констант равновесия, например гетерогенных жидких систем или крепких растворов,часто возникают серьезные трудности. Кроме состояния равновесия, иногдатребуется найти скорость протекания реакции на различных стадиях процесса.Эта величина зависит от таких физических параметров, как вязкость, скорость диффузии, дисперсность и пр.Скорость большинства реакций, с которыми мы сталкиваемся при сварке, современными методами расчета определить затруднительно,и потому скорость реакций физико-химических процессов оценивается качественно.
Влияние давления и температуры на положение химического равновесия.
Константа равновесия любой химической реакции имеет постоянное числовое значение при неизменных внешних условиях— давлении и температуре.
Если реакция протекает без изменения числа газовых молекул, то изменение объема или давления не происходит и, соответственно, не влияет на смещение константы равновесия.
Если же реакция сопровождается изменением числа газовых молекул, то:
с возрастанием давления положение равновесия смещается в сторону уменьшения числа образующихся газовых молекул, а
с уменьшением давления — в сторону их увеличения.
На примере реакции диссоциации углекислого газа
![]()
можно заметить, что при заданной температуре увеличение давления приводит к развитию процесса образования молекул углекислого газа,
в то время как снижение давления вызывает смещение равновесия в направлении большего выхода окиси углерода.
Аналогично можно доказать, что повышение температуры смещает равновесие в направлении эндотермического процесса (идущего с поглощением тепла).
Чем значительнее тепловой эффект процесса, тем больше меняется константа равновесия и тем сильнее смещается равновесие с изменением температуры.Выводы, вытекающие из анализа зависимости константы равновесия от температуры, имеют большое значение для изучения металлургических процессов при сварке, поскольку такие процессы протекают в условиях высоких температур.
Рассмотренное влияние давления и температуры на положение химического равновесия по сути есть проявлением принципа подвижного равновесия, установленногоЛе-Шательев 1884 г. Этот принцип заключается в следующем:
Если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то последнее смещается, причем в системе протекают процессы, ослабляющие эффект внешнего воздействия. Например,повышение температуры, как мы установили, смещает положение равновесия в сторону большего выхода тех веществ, которые образуются с поглощением тепла.Тем самым ослабляется эффект внешнего воздействия — подвода тепла и повышения температуры системы. Понижение температуры системы действует в обратном направлении.
Реакция:
![]()
при развитии вправо является экзотермической, а при развитии влево – эндотермической. Поэтому она из состояния равновесия при повышении температуры будет развиваться преимущественно влево, а припонижении температуры – вправо.
Тест на сообразительность.
В какую сторону будет смещаться состояние равновесия реакции:
- Q+ 2FeO+Si↔SiO2+ 2Fe
при повышении температуры?
при понижении температуры?
Таким образом, можно сказать, что переход системы из устойчивого состояния при низкой температуре в относительно устойчивое при высокой температуре всегда сопровождается поглощением тепла (плавление, испарение, парообразование, превращение -Fe -Fe и др.).
Обратный же переход будет сопровождаться выделением тепла (затвердевание жидкого металла, конденсация пара и пр.).
Поскольку процессы сварки обычно протекают в условиях постоянства давления, то наибольшее влияние на смещение равновесия при них оказывает температура. Вычисление констант равновесия химических реакций можно проводить экспериментальным или расчетным путем. Расчетное определение их основано на использовании термодинамических данных.
