
novsu110
.pdfФедеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования
Новгородский государственный университет имени Ярослава Мудрого Факультет естественных наук и природных ресурсов
Кафедра химии и экологии
ГРАФИЧЕСКИЕ ПОСТРОЕНИЯ И РАСЧЕТЫ ПО ДИАГРАММАМ ДВОЙНЫХ СИСТЕМ
Методическое пособие
Великий Новгород
2007 г.
Грошева Л. П. Графические построения и расчеты по диаграммам двойных систем. Методическое пособие.
Методическое пособие предназначено для студентов, обучающихся приемам расчетов в химической технологии по диаграммам состояния.
В методическом пособии рассмотрены основные принципы построения диаграмм солевых систем и методы расчетов различных процессов в двухкомпонентных системах. Приведены конкретные примеры использования фазовых диаграмм в неорганической технологии. Даны контрольные задания для выполнения.
СОДЕРЖАНИЕ
Введение 1. Растворы безводных солей.
1.1Диаграммы растворимости и фазовые равновесия в двойных системах. 1.2Изменение температуры и состава раствора
2.Особенности диаграмм растворимости кристаллогидратов и расчетов по ним.
2.1.Растворимость кристаллогидратов.
3.ОБЩАЯ МЕТОДИКА РАСЧЕТОВ ПО ДИАГРАММАМ.
3.1. ПРАВИЛО СОЕДИНИТЕЛЬНОЙ ПРЯМОЙ И ПРАВИЛО РЫЧАГА.
3.2РАСЧЕТЫ ПРИ ПОМОЩИ ПРАВИЛА РЫЧАГА.
3.3АНАЛИТИЧЕСКИЙ МЕТОД РАСЧЕТА.
3.4РАСЧЕТЫ ПО КОМПОНЕНТУ, КОЛИЧЕСТВО КОТОРОГО ПОСТОЯННО (НЕИЗМЕННОМУ КОМПОНЕНТУ).
3.5РАСЧЕТЫ ПУТЕМ СОСТАВЛЕНИЯ УРАВНЕНИЯ МАТЕРИАЛЬНОГО БАЛАНСА.
КОНТРОЛЬНЫЕ ЗАДАНИЯ.
ВВЕДЕНИЕ
Выбор рациональных методов переработки солевых систем невозможен без применения физико-химических диаграмм состояния. Физико-химические диаграммы фазовых превращений водно-солевых систем являются основой для технических расчетов, позволяют критически рассмотреть существующие схемы и наметить новые пути совершенствования технологических процессов. Овладение методами расчета с помощью диаграмм состояния, является одним из важных этапов в подготовке специалиста-химика.
Данное пособие преследует цель помочь студентам в овладении методами расчета и оптимизации химико-технологических процессов с помощью фазовых диаграмм растворимости на примере солевых процессов, характерных для химической технологии. В пособии приведены примеры расчетов технологических процессов по диаграммам растворимости двойных солевых систем. В пособии рассмотрены общие методики расчетов по диаграммам растворимости: графические – с использованием правила рычага и соединительной прямой и аналитические – расчеты по компоненту, количество которого постоянно и путем составления материального баланса процесса.

1.РАСТВОРЫ БЕЗВОДНЫХ СОЛЕЙ
1.1Диаграммы растворимости и фазовые равновесия в двойных системах
Раствор одной соли в воде состоит из двух компонентов; система является двойной (двухкомпонентной). Для такой системы максимальное число степеней свободы равно:
F = 2 + 2 – 1 = 3
И, следовательно, графически она может быть изображена в виде пространственной трехмерной фигуры с координатами: давление, температура и концентрация. Принимая давление постоянным, получаем для расчетов двухмерную ортогональную проекцию на координатную плоскость температура – концентрация, т.е. обычные графики растворимости. Диаграммы растворимости двойных систем обычно строят в прямоугольной системе координат (рис. 1.1).
Рис. 1.1. Диаграмма растворимости двойной системы
На рис 1.1 точка F характеризует содержание воды (100%), а – точка Н – 100% безводной соли. Линия ВК – геометрическое место фигуративных точек растворов, насыщенных солью В (например, точка М1), а линия ОК – растворов, находящихся в равновесии со льдом. Линия ВК – кривая растворимости соли, а линия ОК отвечает условиям выделения льда в системе соль– вода.
Фигуративная точка О характеризует воду при температуре замерзания, а точка В – чистую соль при температуре плавления.
Точка К, в которой пересекаются кривые ОК и КВ, называется криогидратной. В этой эвтектической точке одной из твердых фаз является лед. В криогидратной точке в равновесии при постоянной температуре находятся раствор и две твердые фазы – соль и лед.
Кривая растворимости определяет содержание соли в насыщенном растворе для различных температур и является границей, отделяющей области ненасыщенных и насыщенных растворов. Фигуративные точки выше кривой растворимости ВК отвечают составам ненасыщенных, а ниже – пересыщенных или смесям насыщенного раствора и соли (точка М2). Область ВКЕВ соответствует насыщенным растворам и является полем кристаллизации (насыщения) соли. Область ОDК соответствует растворам, находящимся в равновесии с избытком льда, т.е. является полем кристаллизации льда. Область DЕНF характеризует составы, в которых жидкая фаза отсутствует, а твердая является смесью кристаллов соли и льда.
Поскольку состояние системы определяется двумя переменными – концентрацией С и температурой t, постольку фиксация одной из этих переменных характеризует состояние системы однозначно, ибо каждой паре С и t соответствует одна фигуративная точка. Таким образом, если один из параметров, определяющих состояние системы, задан, то система обладает меньшим на единицу числом степенней свободы, т.е. имеет место условная вариантность. Для двойной системы соль– вода, находящейся в равновесии только с собственным насыщенным паром, число степеней свободы для ненасыщенного раствора соли определяют по правилу фаз: F =2 +2 –2 –2. Следовательно, точки в области ненасыщенных растворов (выше кривой ОКВ) отвечает двухвариантному состоянию насыщения с двумя степенями свободы. Это означает, что для ненасыщенных растворов можно в известных пределах изменять произвольно температуру и концентрацию без изменения числа фаз. (пар и раствор – П и Р).
Фигуративные точки на кривой растворимости и ниже ее, изображающие насыщенные растворы, которые находятся в равновесии с избытком соли (поле ВКЕ) или льда (поле ОДК), при наличии трех фаз (пар, раствор и соль или пар, раствор и лед) имеют одну степень свободы, так как
F = 2 + 2 – 3 = 1.
Такие растворы находятся в одновариантном равновесии. В одновариантном равновесии будут также растворы в области DЕНF, отвечающие составам из смеси льда и соли (три фазы – пар, соль и лед).
В криогидратной точке К и других точках на линии DЕ, где сосуществуют четыре фазы – пар, раствор, лед и соль, число степеней свободы определится из соотношения F = 2 + 2 – 4 = 0, т.е. система не обладает ни одной степенью свободы и находится в инвариантном равновесии, так как ни один параметр не может быть изменен без изменения числа фаз.
На диаграмме растворы, находящиеся в инвариантном равновесии, изображают точкой К, в одновариантном равновесии – кривой растворимости ОКВ, а в двухвариантном равновесии – они занимают область диаграммы выше этой кривой. Линия, изображающая изменение состава жидкой фазы в процессе кристаллизации, называется путем кристаллизации, а в процессе испарения –
путем испарения.
Диаграмма растворимости позволяет проследить ход непрерывного процесса, протекающего при изменении температуры или концентрации растворов, т.е. представить графически ряд последовательных состояний равновесия между раствором и образующейся твердой фазой. Пользуясь такой диаграммой можно произвести расчеты процессов кристаллизации при охлаждении и изотермическом испарении растворов.
Рассмотрим движение фигуративной точки на диаграмме растворимости, когда из насыщенного раствора выделяется безводная соль В. По мере охлаждения насыщенного раствора фигуративная точка передвигается по пути кристаллизации ВК, пока не достигнет криогидратной точки К, в которой пересекаются кривые ВК и ОК. В точке К из раствора при отнятии тепла выделяются оба компонента в виде смеси, состоящей из льда и соли В. Точка О, в которой температура и концентрация соли в растворе равны нулю, отвечает состоянию вымерзания льда из воды. По мере увеличения концентрации соли в воде температура замерзания ее будет понижаться: фигуративная точка раствора движется вниз по кривой ОК, выражающей зависимость между изменением температуры и концентрацией раствора, равновесного со льдом. К моменту насыщения раствора солью фигуративная точка сольется с криогидратной точкой К.
1.2 Изменение температуры и состава раствора
Из раствора соль может осаждаться в результате изотермической или политермической кристаллизации. Изотермическая кристаллизация – результат испарения раствора при постоянной температуре (выпарка с кристаллизацией). Политермическая кристаллизация связана с охлаждение растворов и основана на различной растворимости веществ в растворе в зависимости от температуры.
В процессе изотермического испарения насыщенного раствора сначала выпадает один компонент, затем одновременно два, три и так до полного усыхания.
Рассмотрим изменение состава ненасыщенного раствора М в двухкомпонентной системе при изменении температуры (рис.1.1).
Нагревание раствора. При повышении температуры возможны два случая.
1. Раствор в отсутствии твердой фазы станет ненасыщенным. Насыщенный раствор М1 при повышении температуры перейдет в область ненасыщенных растворов. Фигуративная точка М1 переместиться параллельно оси ординат в положение М.
2. Раствор в присутствии твердой фазы остается насыщенным. Если насыщенный раствор М1 нагревать, то твердая фаза будет переходить в раствор. Фигуративная точка М1 будет двигаться вверх по кривой растворимости КВ до положения N.
Охлаждение раствора. Фигуративная точка ненасыщенного раствора М при понижении температуры перемещается параллельно оси ординат по направлению к кривой насыщения, вплоть до точки М1 на кривой растворимости, где раствор станет насыщенным; при дальнейшем охлаждении раствора соль начнет выпадать.
Насыщенный раствор, образующийся после выделения твердой фазы при определенной температуре кристаллизации, называется маточным.
При дальнейшем охлаждении насыщенного раствора фигуративная точка системы раствор – твердая фаза продолжит движение вниз по температурной вертикали (точки М2, М3, Мк). При этом в твердую фазу переходят новые порции соли. Маточный раствор остается насыщенным, однако состав его меняется в зависимости от температуры. На диаграмме растворимости, кроме фигуративной точки системы, появятся фигуративные точки жидкой и твердой фаз. Первая изображает состав насыщенного раствора, концентрация которого уменьшается по мере выделения соли. Поэтому она будет передвигаться по пути кристаллизации, занимая ряд промежуточных положений N2, N3, а фигуративная точка твердой фазы – по вертикали ВН, отвечающей 100%безводной соли – точки Р1, Р3.
Фигуративные точки М2, М3… отвечают составу системы, состоящей из жидкой фазы – насыщенного раствора, состав которого определяется точками N2, N3… – и твердой фазы, состав последней описывается точками Р1, Р3… Эта смесь является конечным продуктом процесса выпадения соли В из пересыщенных растворов М2, М3 при охлаждении. Так как жидкая и твердая фазы имеют одинаковую температуру, то фигуративные точки всех систем расположены на одной и той же температурной горизонтали.
При отнятии тепла в криогидратной точке будут выпадать две фазы: лед и соль без изменения концентрации жидкой фазы и температуры. Фигуративные точки системы и обеих фаз останутся на месте до исчезновения всей жидкой фазы. Дальнейшее понижение температуры вызовет движение точки системы от Мк к М4. Если точка начального раствора R находится над ветвью ОК кривой растворимости, то при достижении температуры, соответствующей пересечению вертикальной линии RR1 с кривой растворимости ОК в точке R1, начнет выпадать лед; точка раствора R будет двигаться по пути кристаллизации
R1К к точке К.
Изменение концентрации раствора при изотермическом испарении воды. По мере испарения воды при постоянной температуре относительное содержание соли в ненасыщенном растворе непрерывно увеличивается; точка раствора перемещается по температурной горизонтали из М в сторону более высоких концентраций, т.е. к точке Р, пока не попадет на кривую растворимости в точке N.
В точке N достигается состояние насыщения, при котором начинает выделяться твердая фаза. Состав твердой фазы изобразится точкой Р, соответствующей 100%-ному содержанию соли при температуре t. Дальнейшее изотермическое испарение воды не меняет состав раствора N, насыщенного при данной температуре, а уменьшает количество раствора за счет выпадения соли; фигуративная точка раствора N останется неподвижной до полного высыхания раствора. Таким образом, точка N кривой растворимости – конечный пункт изотермической кристаллизации соли. Фигуративная точка системы движется в положение Р, и чем больше выпало твердой фазы, тем ближе оказывается эта точка к точке Р. Когда вода полностью испарится из раствора, фигуративная точка системы совпадет с фигуративной точкой твердой фазы Р.
2. ОСОБЕННОСТИ ДИАГРАММ РАСТВОРИМОСТИ КРИСТАЛЛОГИДРАТОВ И РАСЧЕТОВ ПО НИМ
2.1 Растворимость кристаллогидратов
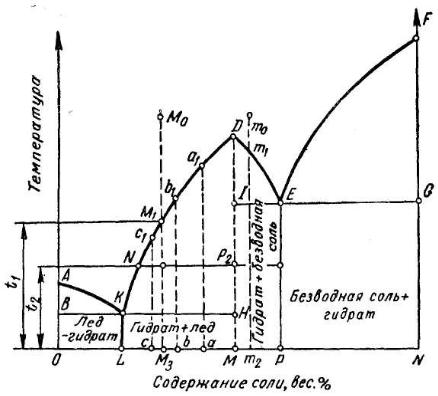
Диаграмма растворимости усложняется, если между компонентами системы происходит химическое взаимодействие. Плавный ход кривой растворимости существует до тех пор, пока твердая фаза, равновесная с раствором, остается неизменной. Если на кривой растворимости появляется излом, то это указывает, что состав твердой фазы изменился, например, образовался гидрат, двойная соль.
При образовании гидрата диаграмма двойной системы делится как бы на две части, каждая из которых имеет ординаты: вода – гидрат и гидрат – безводная соль. Для солей, образующих ряд гидратов, появление нескольких изломов на кривой растворимости, связано с изменением числа молекул кристаллизационной воды. Гидраты устойчивы до определенной температуры, называемой точкой превращения. Так, при нагревании мирабилита до 32.40С происходит отщепление кристаллизационной воды и образование безводной соли:
Nа2SО4·10Н2О ↔ Nа2SО4 + 10Н2О
(соль плавится в кристаллизационной воде).
Рис. 2.1. Кривые растворимости солей, образующих устойчивые гидраты с явным максимумом
