
- •1.Эквивалент. Эквивалентная масса. Эквивалентный объём. Закон эквивалентов.
- •2.Примеры расчёта эквивалента элемента, оксида, основания, соли, кислоты, окислителя, восстановителя.
- •4.Энергия Гиббса. Направленность самопроизвольных химических реакций.
- •12.Способы выражения состава растворов.
- •13.Осмос. Закон Вант-Гоффа. Роль осмоса в биологических явлениях.
- •14.Давление пара растворителя над раствором. Закон Рауля.
- •15.Кипение и замерзание растворов неэлектролитов.
- •Вопрос 16.
- •Вопрос 17.
- •34. Виды межмолекулярного взаимодействия.
- •35. Водородная связь, ее биологическая роль.
- •36. Комплексные соединения. Теория Вернера. Роль в живом организме.
- •37. Диссоциация комплексных соединений. Константа нестойкости комплексных ионов.
- •38. Химическая связь в комплексных соединениях (примеры).
- •39. Окислительно-восстановительные реакции. Виды окислительно-восстановительных реакций.
- •40. Важнейшие окислители и восстановители. Окислительно-восстановительная двойственность.
- •41. Стандартные электродные потенциалы. Направление протекания окислительно-восстановительных реакций.
- •II. Химия неорганических соединений, биологическая роль, применение в ветеринарии.
- •2. Способы получения галогенов. Применение.
- •3. Водородные соединения галогенов. Свойства, применение.
- •4. Хлорная вода. Получение, свойства, применение.
- •5. Хлорная известь. Получение, свойства, применение.
- •6. Кислородсодержащие кислоты галогенов. Изменение их силы и окислительной способности. Соли кислородсодержащих кислот. Применение.
- •7. Общая характеристика подгруппы кислорода.
- •8. Вода. Физические и химические свойства. Вода как растворитель. Биологическая роль воды.
- •9. Сероводород, получение и свойства. Сероводородная кислота. 1-я и 2-я константы диссоциации. Роль в окислительно-восстановительных процессах. Соли сероводородной кислоты.
5. Хлорная известь. Получение, свойства, применение.
Получение: 
Получают взаимодействием хлора с гашеной известью (гидроксидом кальция).
Химические свойства:
На воздухе хлорная известь медленно разлагается по схеме:
 .
.
 , термическое
разложение
, термическое
разложение


Применение:Широко используется для отбеливания и дезинфекции.
6. Кислородсодержащие кислоты галогенов. Изменение их силы и окислительной способности. Соли кислородсодержащих кислот. Применение.
7. Общая характеристика подгруппы кислорода.
Подгруппа кислорода, или халькогенов – 6-я группа периодической системы Д.И. Менделлева.

Сверху вниз, с нарастанием внешнего энергетического уровня закономерно изменяются физические и химические свойства халькогенов: радиус атома элементов увеличивается, энергия ионизации и сродства к электрону, а также электроотрицательность уменьшаются; уменьшаются неметаллические свойства, металлические увеличиваются (кислород, сера, селен, теллур – неметаллы), у полония имеется металлический блеск и электропроводимость. Водородные соединения халькогенов соответствуют формуле: H2R: H2О, H2S, H2Sе, H2Те – хальководороды.
8. Вода. Физические и химические свойства. Вода как растворитель. Биологическая роль воды.
Физические свойства: вода – бесцветная жидкость, без вкуса и запаха, плотность – 1 г/см3; температура замерзания – 0 °C (лед), кипения – 100 °C (пар). При 100 °C и нормальном давлении водородные связи рвутся и вода переходит в газообразное состояние – пар. У воды плохая тепло-и электропроводность, но хорошая растворимость.
Химические свойства: вода незначительно диссоциирует:

В присутствии воды идет гидролиз солей – разложение их водой с образованием слабого электролита:

Взаимодействует со многими основными оксидами, металлами:

С кислотными оксидами:

Вода - превосходный растворительдля полярных веществ. К ним относятся ионные соединения, такие как соли, у которых заряженные частицы (ионы) диссоцииируют в воде, когда вещество растворяется, а также некоторые неионные соединения, например сахара и простые спирты, в молекуле которых присутствуют заряженные (полярные) группы (-OH).
Биологическая роль воды:
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.












9. Сероводород, получение и свойства. Сероводородная кислота. 1-я и 2-я константы диссоциации. Роль в окислительно-восстановительных процессах. Соли сероводородной кислоты.
Получение:1) прямой синтез из элементов, при температуре 600 °C; 2) воздействием на сульфиды натрия и железа соляной кислотой.



10. Серная кислота. Роль в окислительно-восстановительных процессах. Соли серной кислоты. Применение.

Оксид SO2и серная кислота проявляют только окислительные свойства, что обусловлено высшей степенью окисления серы (+6)


11. Соединения серы в степени окисления +4. Роль в окислительно-восстановительных процессах (примеры). Применение.



12. Общая характеристика подгруппы азота.

Могут проявлять в соединениях степени окисления от −3 до +5.
13. Аммиак. Получение, химические свойства, применение.



14. Азотная кислота. Химические свойства. Взаимодействие с металлами. Нитраты. Обнаружение.














Обнаружение:
В колбу, соединенную с холодильником, конец которого опускают в колбу с водой, помещают исследуемую жидкость и медные опилки. Колбу нагревают на бане с минеральным маслом или на песчаной бане и жидкость выпаривают почти досуха. При достаточной концентрации азотной кислоты происходит восстановление ее медью в окись азота, которая с кислородом воздуха образует двуокись азота (оранжевые пары). Последняя, растворяясь в воде, дает азотную и азотистую кислоты, которые и обнаруживаются химическими реакциями:
3Сu + 2HNO3 = ЗСuО + 2NO + Н2O
3СuО + 6HNO3 = 3Cu(NO3)2 + 3H2O
2NO + O2 = 2NO2; 2NO2 + H2O = HNO2 + HNO3
15. Азотистая кислота и ее соли. Роль в окислительно-восстановительных процессах. Применение.
- HNO2. Соли азотистой кислоты (нитриты) получают восстановлением нитратов:
NaNO2+HCI = NaCI+HNO2.
-Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (Н2О2, KMnO4) окисляется в HNO3:
2HNO2 + 2HI → 2NO↑ + I2↓ + 2H2O;
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O;
HNO2 + Cl2 + H2O → HNO3 + 2HCl.










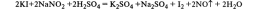




16. Биологическая роль азота и фосфора. Применение.

- Азот входит в состав хлорофилла, гемоглобина и др.

Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит.
17. Мышьяк и его соединения. Обнаружение. Влияние на живой организм. Применение.







Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство.
18. Общая характеристика элементов подгруппы углерода. Влияние на живой организм.
Применение.

- Круговорот углерода в природе включает биологический цикл, выделение СО2(=> фотосинтез).
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, попадая в лёгкие, кристаллизующихся в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз.
Малые количества германия не оказывают физиологического действия на растения, но токсичны в больших количествах. Германий нетоксичен для плесневых грибков.
Олово входит в состав желудочного фермента гастрина.
Свинец и его соединения токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение.
Широкого применения в медицине свинец не получил из-за своей высокой токсичности. Используется только Pb(CH3COO)2·3H2O, или свинцовая вода, для примочек от ссадин
В настоящее время олово в медицине не используется.
19. Кислородсодержащие соединения углерода. Цианиды.





20. Кремний¸ строение атома. Важнейшие соединения, их свойства, применение.
-Si+14 )2 )8 )4.



21. Общая характеристика элементов III группы главной подгруппы. Применение.


22. Бор. Строение атома, валентность. Важнейшие соединения. Применение
- B +5)2)3. Валентность равна 4.







23. Алюминий и его соединения. Применение.

- При взаимодействии с сильными щелочами образуются соответствующие
алюминаты:
NaOH + Al(OH)3 = Na[Al(OH)4]
С кислотами Al(OH)3 образует соли
Галогениды алюминия в обычных условиях - бесцветные кристаллические
вещества. В ряду галогенидов алюминия AlF3 сильно отличается по свойствам
от своих аналогов
Al2O3 + 6HF = 2AlF3 + 3H2O
Соединения алюминия с хлором, бромом и иодом легкоплавки, весьма
реакционноспособны и хорошо растворимы не только в воде, но и во многих
органических растворителях
AlCl3, AlBr3 и AlI3 дымят во влажном воздухе (вследствие гидролиза
- Широко применяется как конструкционный материал. Iироко используется в криогенной технике. Mатериалом для изготовления зеркал. В производстве строительных материалов как газообразующий агент. Aцетат алюминия (по крайней мере в 2003 году использовался) антисептик, оказывает вяжущее и местное противовоспалительное действие.
24. Общая характеристика элементов главной подгруппы II группы. Применение.
- Главную подгруппу II группы Периодической системы элементов составляют бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Атомы этих элементов имеют на внешнем электронном уровне два s-электрона. В хим. реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2. Все элементы этой подгруппы относятся к металлам. Кальций, стронций, барий и радий называются щелочноземельными металлами.
- Металлический бериллий применяется для изготовления окон к рентгеновским установкам, так как поглощает рентгеновские лучи в 17 раз слабее алюминия. Нитрат стронция применяют в пиротехнике, а его карбонат и оксид — в сахарной промышленности. Гидроксид и хлорид бария используются в лабораторной практике, пероксид бария — для получения пероксида водорода, нитрат и хлорат — в пиротехнике, сульфат бария — в рентгеноскопии органов пищеварения. Соединения бария ядовиты. Соли радия применяются в исследовательских целях, а также для получения радона, обладающего целебными свойствами.
25. Жесткость воды и способы ее устранения.
- Жёсткость воды - свойство воды (не мылиться, давать накипь в паровых
котлах), связанное с содержанием растворимых в ней соединений кальция и
магния, это параметр, показывающий содержание катионов кальция, магния в
воде.
- Существует два типа жесткости: временная и постоянная.
Чтобы избавиться от временной жесткости необходимо просто вскипятить
воду. При кипячении воды, гидрокарбонатные анионы вступают в реакцию с
катионами и образуют с ними очень мало растворимые карбонатные соли,
которые выпадают в осадок.
Ca2 + 2HCO3- = CaCO3v + H2O + CO2^
С последствием постоянной жесткости воды - накипью, с точки зрения химии бороться очень просто. Нужно на соль слабой кислоты воздействовать кислотой
более сильной. Последняя и занимает место угольной, которая, будучи
неустойчивой, разлагается на воду и углекислый газ. В состав накипи могут
входить и силикаты, и сульфаты, и фосфаты. Но если разрушить карбонатный
“скелет”, то и эти соединения не удержатся на поверхности.
26. Щелочные металлы. Изменение потенциала ионизации. Роль в окислительно-восстановительных процессах. Важнейшие соединения, биологическая роль, применение.
- Это элементы 1-й группы периодической таблицы химических элементов: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами..
- Энергия ионизации — разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал, представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
|
Атомный номер,название
|
Потенциал ионизации, эВ |
|
3 Литий Li |
5,32 |
|
11 Натрий Na |
5,14 |
|
19 Калий K |
4,34 |
|
37 Рубидий Rb |
4,18 |
|
55 Цезий Cs |
3,89 |
- Для всех щелочных металлов характерны восстановительные свойства.
- Гидроксиды(Для получения гидроксидов щелочных металлов в основном используют электролитические методы), Карбонаты(Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26 — 30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой).
- По содержанию в организме человека натрий (0,08%) и калий (0,23%) относятся к макроэлементам, остальные – литий (10 -4%), рубидий (10-5 %) и цезий (10-4%) – микроэлементам. Щелочные металлы в виде различных соединений входят в состав тканей животных и человека. Натрий и калий – жизненно необходимые элементы, постоянно содержатся в организме, участвуют в обмене веществ. Литий, рубидий, цезий – также постоянно содержатся в организме, однако физиологическая и биохимическая роль их мало выяснена.
- Литий используется в специальных легких сплавах, литийорганические производные широко применяются при синтезе различных классов органических соединений. Натрий используется в металлотермии. Металлический натрий и его жидкий сплав с калием используется в органическом синтезе. Как восстановитель часто применяется амальгама натрия. Из тяжелых щелочных металлов техническое применение находит только цезий, который благодаря малому потенциалу ионизации используется для создания фоточувствительных слоев в вакуумных фотоэлементах.
27. Хром. Строение атома. Возможные степени окисления. Кислотно-основные свойства. Применение.
-Cr +24)2)8)13)1
- Для хрома характерны степени окисления +2, +3 и +6.
-C увеличением степени окисления возрастают кислотные и окислительные свойства. Хром Производные Сr2+ - очень сильные восстановители. Ион Сr2+ образуется на первой стадии растворения Хрома в кислотах или при восстановлении Сr3+ в кислом растворе цинком. Гидрат закиси Сr(ОН)2 при обезвоживании переходит в Сr2О3. Соединения Сr3+ устойчивы на воздухе. Могут быть и восстановителями и окислителями. Сr3+ можно восстановить в кислом растворе цинком до Сr2+ или окислить в щелочном растворе до СrО42- бромом и других окислителями. Гидрооксид Сr(ОН)3 (вернее Сr2О3·nН2О) - амфотерное соединение, образующее соли с катионом Сr3+ или соли хромистой кислоты НСrО2 - хромиты (например, КСrО2, NaCrO2). Соединения Сr6+: хромовый ангидрид СrО3, хромовые кислоты и их соли, среди которых наиболее важны хроматы и дихроматы - сильные окислители.солей.
- Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
28. Окислительно-восстановительные свойства соединений хрома с различной степенью окисления.
- Хром химически малоактивен. В обычных условиях он реагирует только с фтором (из неметаллов), образуя смесь фторидов.
Хроматы и дихроматы
Хроматы образуются при взаимодействии СгО3, или растворов хромовых кислот со щелочами:
СгОз + 2NaOH = Na2CrO4 + Н2О
Дихроматы получаются при действии на хроматы кислот:
2 Na2Cr2O4 + H2SO4 = Na2Cr2O7 + Na2SO4 + Н2О
Для соединений хрома характерны окислительно - восстановительные реакции.
Соединения хрома (II) - сильные восстановители, они легкоокисляются
4(5гС12 + О2 + 4HCI = 4СгС1з + 2Н2О
Для соединений хрома (!!!) характерны восстановительные свойства. Под действием окислителей они переходят:
в хроматы - в щелочной среде,
в дихроматы - в кислой среде.
2Na3 [Сг(OH)6] + ЗВг2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8Н2О
5Cr2(SO4)3 + 6KMnO4 + 11H2O = 3K2Cr2O7 + 2H2Cr2O7 + 6MnSO4 + 9H2SO4
Соли хромовых кислот в кислой среде - сильные окислители:
3Na2SO3 + К2Сг2О7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
29. Амфотерность гидроксида хрома (III). Хромиты, их восстановительные свойства.
- Cr(ОН)3. CrOH + HCl = CrCl + H2O, 3CrOH + 2NaOH = Cr3Na2O3 + 3H2O
- Хроматы(III) (устар. назв. хромиты).
Для соединений хрома характерны восстановительные свойства. Под действием окислителей они переходят:
в хроматы - в щелочной среде,
в дихроматы - в кислой среде.
2Na3 [Сг(OH)6] + ЗВг2 + 4NaOH = 2Na2CrO4 + 6NaBr + 8Н2О
5Cr2(SO4)3 + 6KMnO4 + 11H2O = 3K2Cr2O7 + 2H2Cr2O7 + 6MnSO4 + 9H2SO4
Соли хромовых кислот в кислой среде - сильные окислители:
3Na2SO3 + К2Сг2О7 + 4H2SO4 = 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
30. Хромовая и дихромовая кислоты, их соли, роль в окислительно-восстановительных реакциях.
-Хромовая кислота Н2CrO4, дихромовая кислота Н2Cr2О7
- Соли - хроматы и дихроматы
- Соединения хрома (III) в щелочной среде играют роль восстановителей. Под действием различных окислителей — Cl2, Br2, H2O2, КмnO4 и др. — они переходят в соединения хрома (IV) — хроматы
Сильные окислители, такие, как KMnO4, (NH4)2S2O8 в кислой среде переводят соединения Cr (III) в дихроматы:
Таким образом, окислительные свойства последовательно усиливаются с изменением степеней окисления в ряду: Cr2+ Cr3+ Cr6+ . Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения крома. (III). Соединения хрома (VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения с промежуточной степенью окисления, т. е. соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями (например, бромом, KMnO4) проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
31. Марганец. Строение атома. Возможные степени окисления. Кислотно-основные свойства.
-Схема строения атома: Mn +25 )2 )8 )13 )2.
- Характерные степени окисления марганца: +2, +3, +4, +6, +7 (+1, +5 мало характерны)
-
32. Окислительно-восстановительные свойства соединений марганца в зависимости от степени окисления.
-Марганец — элемент VIIB (7) группы имеет валентную конфигурацию 3d54s2. В соединениях
марганец проявляет степени окисления от 0 до +7, наиболее устойчивые из них +2, +4, +6 и +7.
Соединения марганца (II) в реакциях проявляют восстановительные свойства, и в кислой и в
щелочной среде:
2MnSO4 + 5PbO2 + 6HNO3 = HMnO4 + 3Pb(NO3)3 + 2PbSO4 + 2H2O
MnSO4 + H2O2 + 2NaOH = Mn(OH)4↓ + Na2SO4
Осадок MnS при стоянии на воздухе окисляется:
MnS + O2 + 2H2O = Mn(OH)4↓ + S↓
Соединения марганца (IV) могут выступать как в качестве окислителя, так и в качестве
восстановителя. Восстановительные свойства марганец (IV) проявляет, например, при
получении перманганата калия сплавлением бертолетовой соли с оксидом марганца (IV) и
щелочью.
3MnO2 + KClO3+ 6KOH = 3K2MnO4 + KCL + 3H2O
Примером окислительных свойств соединений марганца (IV) может служить реакция диоксида
марганца с сульфатом железа (II):
MnO2 + 2FeSO4 + 2H2SO4 = MnSO4 + Fe2(SO4)3 + 2H2O
Соединения марганца (VI) обладают окислительными свойствами, но при действии более
сильных окислителей могут выступать и в роли восстановителя:
K2MnO4 + Na2SO3 + H2SO4 = MnO2↓ + Na2SO4 + K2SO4+ H2O
2K2MnO4+ Cl2 = 2KMnO4 + 2KCl
Соединения марганца (VII), соли марганцевой кислоты, перманганаты, являются одними из
самых сильных окислителей. В зависимости от рН среды перманганат – ион восстанавливается
в разной степени:
Кислая среда: MnO4 + 8H + 5е→ Mn2 + 4H20
Нейтральная среда: MnO4 + 2H2O + 3е→ MnO2 + 4OH
Щелочная среда: MnO4 + 1е→ MnO42
33. Поведение перманганата калия в различных средах (примеры). Применение.
-Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI).
Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия:
в кислой среде: 2KMnO4 + 5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O;
в нейтральной среде: 2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH;
в щелочной среде: 2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4 + H2O;
-Разбавленные растворы (около 0,1 %) перманганата калия нашли широчайшее применение в медицине как антисептическое средство, для полоскания горла, промывания ран, обработки ожогов. В качестве рвотного средства для приёма внутрь при некоторых отравлениях используют разбавленный раствор.
34. Общая характеристика триады железа. Роль в живом организме.
-Элементы триады железа (железо, кобальт, никель) находятся в побочной подгруппе VIII группы. Атомы элементов триады железа имеют на внешнем энергетическом уровне по 2 электрона, которые они отдают в химических реакциях. В своих устойчивых соединениях эти элементы проявляют степени окисления +2, +3. Образуют оксиды состава RO и R2O3. Им соответствуют гидроксиды состава RОН)2 и R(ОН)3.
В обычном состоянии железо, кобальт, никель представляют собой тяжелые серебристо-белые металлы с высокими температурами. Все эти металлы обладают превосходными механическими свойствами.
-В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (окол, катализируя процессы дыхания в клетках. Недостаток железа проявляется как болезнь организма (хлороз у растений и анемия у животных).
Кобальт участвует в ферментативных процессах фиксации атмосферного азота клубеньковыми бактериями. В организме среднего человека (масса тела 70 кг) содержится около 14 мг кобальта.
Никель относится к числу микроэлементов, необходимых для нормального развития живых организмов. Однако о его роли в живых организмах известно немного. Известно, что никель принимает участие в ферментативных реакциях у животных и растений. В организме животных он накапливается в ороговевших тканях, особенно в перьях.
35. Железо, строение атома, степени окисления. Изменение свойств соединений с изменением степени окисления железа. Роль в живом организме. Применение.
-Схема строения атома: Fe +26 )2 )8 )14 )2.
-Для железа характерны степени окисления железа — +2 и +3, реже — +6. (соответствующего оксида и гидроксида с свободном виде не существует). Ферраты — сильнейшие окислители.
- Соединения железа (II)-восстановительные свойства. Соединения железа (III) проявляет амфотерные свойства.
- В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (около 0,02 %), из которых 78 % являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов. Недостаток железа проявляется как болезнь организма (хлороз у растений и анемия у животных).
- Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо может входить в состав сплавов на основе других металлов — например, никелевых. Уникальные ферромагнитные свойства ряда сплавов на основе железа способствовуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей. Десятиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве. Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
