
- •5. Зависимость скорости химической реакции от концентрации реагентов. Кинетические уравнения реакция первого, второго и нулевого порядков.
- •6. Зависимость скорости реакции от температуры. Температурный коэффициент реакции и его особенности для биохимических процессов. Уравнение Аррениуса.
- •13. Основные положения протолитической теории кислот и оснований Бренстеда-Лоури. Теория Льюиса.
- •26.Оптические свойства: рассеивание света. Электрокинетические свойства: электроосмос и электрофорез. Строение двойного электрического слоя.
- •30. Коллоидные пав. Биологически важные коллоидные пав (мыла, детергенты, желчные кислоты). Мицеллообразование в растворах пав. Липосомы.
- •31.Окислительно-восстановительное титрование.
- •34.Окислительно-восстан системы. Потенциалы, механизм возникновения, био значение.
Основные понятия термодинамики.
Термодина́мика— раздел физики, изучающий соотношения и превращения теплоты и других форм энергии. В отдельные дисциплины выделились химическая термодинамика, изучающая физико-химические превращения, связанные с выделением или поглощением тепла, а также теплотехника. Термодинамической системой называется совокупность материальных тел, взаимодействующих, как между собой, так и с окружающей средой. Все тела находящиеся за пределами границ рассматриваемой системы называются окружающей средой. Состояния системы: -равновесное(свойства постоянны,нет потоков веществ и энергии) -термодинамически обратимое(равновесны все промежуточные стадии) -стандартное. Интенсивные параметры(зависящие от кол-ва вещества в системе- масса объем энергия) Экстенсивные параметры(не зависящие от кол-ва- температура давление плотность) Внутренняя энергия-энергия системы,слагающаяся из энергии кинетического движения,составляющих ее частицы и энергии потенциальной при таком движении. Работа-упорядоченная форма передачи энергии,с изменением параметров состояния системы. Теплота-неупорядоченная форма пердачи. Типы систем: -изолированная(не обменивается ни Е ни m) -закрытая(обмнивается только Е пример ампула) -открытая(обмен и тем и другим пример живая клетка) Процессы:-изотермические(Т постоянная)-изобарные(Р постоянно)-изохорные(v постоянно). 2. Первый закон термодинамики: превращение внутренней Е сис-мы в некотором процессе = теплоте полученное сис-мой + работа, совершенная над системой.Е не создается и не уничтож. Возможны лишь ее переходы из одного вида в другой в строго эквивалентных кол-вах. Кол-во е в космосе=const Внутренняя Е: функция состояния, приращение которой= теплоте полученной сис-мой в изохорном процессе. Тепловой эффект: кол-во теплоты, выделяемой или поглощаемой реагирующей сис-мой. Тепловой эффект=изменению внутренней Е сис-мы при изохорном процессе и изменению энтальпии при изобарном. Энтальпия: функция состояния, приращение которой = теплоте, полученное сис-мой в изобарном процессе. Н=Е+рV Закон Гесса: теплота хим р-ции, протекающей при р или V=const определяется только природой исходных в-в и продуктов р-ции и не зависит от числа и последовательности промежуточных стадий при условии, что теплоты измерены при одинаковых t. 1)теплота образования в-ва=теплоте его разложения, взятой с обратным знаком. 2)энтальпия образования=разности сумм энтальпий образования продукта р-ции и исходных в-в 3)энтальпия сгорания=разности сумм энтальпий сгорания исходных в-в и продуктов р-ции. Термохимическое ур-е: ур-е в которомпомимо формул исходных в-в и продуктов р-ции указан отвечающие этой р-ции тепловой эффект. Поступление пищи обеспечивает энергию, которая используется для выполнения различных функций организма или сохраняется для последующего использования. Пищевые вещества окисляются вплоть до конечных продуктов, которые выделяются из организма. C6H12O6 + 6O2 = 6CO2 + 6H2O Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. эндергоническая:(1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль). 3. Второе начало термодинамики. 2 закон термодинамики: невозможен самопроизвольный переход от тела менее нагретого к более нагретому. Невозможно превратить теплоту в работу не приводя никакого другого действия, кроме охлаждения источника тепла.Вечный двигатель 2-го рда невозможен т. е. Такой двигатель, результатом которого было бы получение работы за счет тепла окружающей среды. Все самопроизвольные процессы в макроскопических сис-мах протекают в направлении от менее вероятного к более вероятному состоянию сис-мы. Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия, теплопроводность, вязкое течение и другое. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. Энтропия: мера вероятности данного состояния в-ва или системы. Характеризует меру беспорядка в расположении и поведении частиц составляющих сис-му, а также меру стремления частиц занять как можно больший V. Чем больше беспорядка, тем выше энтропия. При достижении равновесия S изолированной сис-мы максимальна.Энергия Гиббса: часть внутренней Е сис-мы которая может быть использована для работы. В самопроизвольной реакции: G2-G1<0 ;S2-S1>0 Стандартная эн Гиббса ΔG = ΔH – T ΔS (G, кДж): Процесс называется самопроизвольным, если он осу–ществляется без каких-либо воздействий, когда система предоставлена самой себе. Существуют процессы, при которых внутренняя энер–гия системы не меняется (ΔЕ = 0). К таким процессам относится, например, ионизация уксусной кислоты в воде. Целый ряд самопроизвольных процессов протекает с увеличением внутренней энергии (ΔЕ > 0). Сюда отно–сятся, в частности, типичные реакции образования био–неорганических соединений альбумина (белок плазмы крови) с ионами металлов, например Сu2+.Изменение внутренней энергии АЕ для закрытых сис–тем не может служить критерием самопроизвольного про–текания процессов. Изолированная сис-ма: не обменивается со средой ни в-вом, ни Е.Закрытая сис-ма: не обменивается в-вом, но может обмениваться Е. Энтальпийный и энтропийный факторы. Выражение для свободной энергии Гиббса можно написать и в другом виде: ΔG = ΔН – ТΔS.1) Пусть ΔН < 0 (экзотермический процесс), а ТΔS > 0.Тогда из формулы ΔG =ΔН – ТΔS видно, что ΔG < 0 и процесс протекает самопроизвольно.2). ΔН> 0 (эндотермический процесс), ТΔS < 0 и тогда ΔG > 0. В этом случае самопроизвольный процесс не протекает, но может протекать при затрате энергии из окружающей среды.3) ΔН = ТΔS и тогда ΔG = 0. Наступает термодинамическое равновесие в системе.4) ΔН < 0 и ТΔS < 0, ΔН > 0 и ТΔS > 0. В этом случае значение ΔG зависит от того, какая из величин больше: ΔН или ТΔS.Если ТΔS >> ΔН, то ΔG < 0; если ТΔS << ΔН, то ΔG < 0. 4. Кинетика изучает скорость химической реакции, ее зависимость от различных факторов и механизмы реакций. Основные понятия: -Ограниченность термодинамического подхода(в термодинамике не определяется быстрота) -Гомогенность и гетерогенность реакции -Определяется по агрегатному состоянию реагентов в (одной фазе и в разных фазах) Скорость реакции- изменение концентрации вещества в единицу времени. Ʊ=∆с/∆t. Истинная скорость- положительна . Ʊист=dс/dt Химическое равновесие-когда скорости прямой и обратной реакций сравниваются. Классификация реакций: 1)по механизму: -простые- осуществляется посредством однотипных элементарных актов -сложные- разнотипные элементарные акты 2) по агрегатному состоянию: -гомогенные-все исходные вещ-ва в одной фазе, реакция идет по всему объему смеси -гетерогенные- исх. вещ-ва в разных фазах, важна площадь соприкосновения реагирующих вещ-в. Молекулярность реакции- число молекул, учавствующих в простой реакции. Кинетические уравнения: -первого порядка, V=kc (k-константа скорости реакции) -второго порядка, V=kc2
Порядок реакции- сумма показателей степеней концентраций реагирующих вещ-в. Период полупревращений- промежуток времени, в течении которого начальное кол-во реагента или его концентрация уменьшаются в 2 раза. T1/2=ln2/k
5. Зависимость скорости химической реакции от концентрации реагентов. Кинетические уравнения реакция первого, второго и нулевого порядков.
Скорость гомогенной хим. реакции определяется изменением концентрации реагирующих веществ (или продуктов реакции) в единицу времени.
Скорость прямой реакции уменьшается по мере расходования исходных веществ, а скорость обратной реакции увеличивается по мере накопления продуктов реакции. Когда скорости прямой и обратной реакции сравняются, система перейдет в состояние химического равновесия.
Истинная
скорость в
любой момент времени является только
положительной величиной и определяется
первой производной концентрации по
времени ![]() .
Если измерение истинной скорости
проводят по изменению концентрации
исходных веществ, то перед производной
ставят знак
минус:
.
Если измерение истинной скорости
проводят по изменению концентрации
исходных веществ, то перед производной
ставят знак
минус:
V=
- ![]()
Средняя
скорость : Vср
=![]()
![]()
Зависимость скорости хим.реакции от концентрации описывается кинетическим уравнением.
Порядок реакции показывает, каким образом скорость реакции зависит от концентрации реагентов. Порядок кинетического уравнения может принимать значения 0,1,2 и 3; он может быть также дробным.
Уравнения нулевого порядка:
С0 – с1= kt ;
C0-0.5 C0=kt0.5 ;
T0.5=![]() ;
;
Где с0 – начальная концентрация реагента;
с1 – концентрация реагента в момент времени t;
k – константа скорости реакции;
T0.5 – период полураспада.
Уравнения первого порядка:
ln=![]() =
- kt
;
=
- kt
;
T0.5=![]() =
=![]() ;
;
Где ct=0.5 c0
Уравнения второго порядка:
![]() -
- ![]() = kt;
= kt;
T0.5=![]() ;
;
Закон действующий масс(Закон Гульберта и Вааге): скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов. Т.е. чем больше концентрация, тем больше скорость хим.реакции.
6. Зависимость скорости реакции от температуры. Температурный коэффициент реакции и его особенности для биохимических процессов. Уравнение Аррениуса.
Правило Вант-Гоффа:
при повышении температуры на 10 градусов скорость гомогенной хим.реакции увеличивается в 2-4 раза.
![]()
где
V2
— скорость реакции при температуре Т2,
V1—
скорость реакции при температуре Т1,
![]() —
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
![]()
Теория активных соударений обобщает закономерности зависимости скорости хим.р-и от температуры:
1.Реагировать могут не все молекулы, а только находящиеся в особом активном состоянии
2.Активация молекулы происходит в результате биомолекулярного столкновения.
3.При столкновении частиц с примерно одинаковым запасом энергии происходит её перераспределение, в результате чего энергия одной из молекул достигает значения, соответствующего энергии активации.
4.Влияние температуры на скорость реакции: смещение равновесия между обычными и активными молекулами в сторону увеличения концентрации первых.
Энергетический профиль реакции (график зависимости потенциальной энергии от координаты реакции)
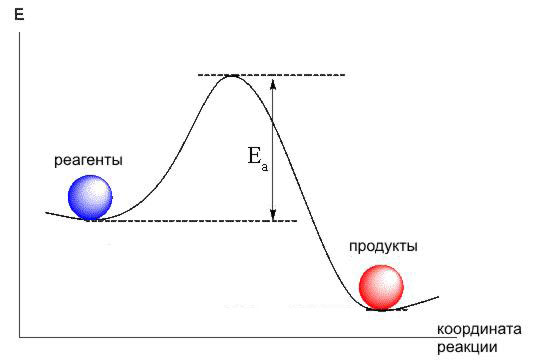
Энергия активации Еа – минимальная дополнительная энергия, которую необходимо сообщить молекуле сверх среднего её значения для того, чтобы стало возможным хим. взаимодействие.
Уравнение Аррениуса устанавливает зависимость константы скорости химической реакции k от температуры Т.
![]()
Здесь А характеризует частоту столкновений реагирующих молекул, R — универсальная газовая постоянная.
7. Катализ. Гомогенный и гетерогенный катализ. Осбенности каталитич.активности ферментов. Катализ-изменение скорости химических реакций в присутствии веществ, которые после завершения реакции остаются в неизменном виде и количестве. Увеличение скорости реакции называют положительным катализом, уменьшение – отрицательным катализом (или ингибированием). Катализаторами называют вещества, которые вызывают положительный катализ; вещества, замедляющие реакции – ингибиторами. Различают гомогенный и гетерогенный катализ. Ускорение реакции диспропорционирования пероксида водорода в водном растворе в присутствии дихромат-ионов является примером гомогенного катализа(катализатор образует одну фазу с реакционной смесью), а в присутствии оксида марганца(IV) – примером гетерогенного катализа(водный раствор пероксида водорода-жидкая фаза, оксид марганца-твердая). Катализаторы биохимических реакций имеют белковую природу и называются ферментами. Ферменты отличаются от обычных катализаторов рядом особенностей: 1)они обладают значительно более высокой каталитической эффективностью; 2)высокая специфичность, т.е. избирательность действия; 3)многие ферменты проявляют каталитическую активность только по отношению к одному субстрату; 4)ферменты проявляют максимальную эффективность только в мягких условиях, характеризующихся небольшим интервалом температур и значений рН. Активность фермента=Скорость реакции нулевого порядка. 8.Химическое равновесие. Обратимые и необратимые по направлению реакции. Химическое равновесие: динамическое состояние, при котором скорость прямой и обратной реакций равны. Константа равновесия: при постоянных внешних условиях в равновесии отношение произведение концентраций продуктов к произведению концентраций реагентов с учетом стехиометрии есть величина постоянная, не зависящая от химического состава системы. Кс связана со стандартной Е Гиббса соотношением: Принцип Ле-Шателье: воздействие какого-либо фактора (t, c, p) на равновесную систему стимулирует смещение равновесия в таком направлении, которое способствует восстановлению первоначальных характеристик системы. Термодинамические условия равновесия: G2-G1=0 S2-S1=0 Обратимая р-ция: при данных условиях самопроизвольно протекающая как в прямом, так и в обратном направлении. Условия протекания до конца: - Труднорастворимый осадок - газ - малодиссоциирующее в-во (вода) - устойчивое комплексное соединение Необртаимая р-ия: при данных условия протекает в одном направление. Положение химического равновесия зависит от следующих парамктров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1884 году французским ученым Ле-Шателье. Современная формулировка принципа Ле-Шателье такова:
|
Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия. |
9 .
Роль воды и растворов в жизнедеятельности.
Термодинамика растворения.
Раствор-это
гомогенная система переменного состава
из двух и более веществ, находящаяся в
состоянии равновесия. Классификация:
1)
взвеси(грубо-дисперсная
система): суспензии(тв.в-во в жидкости)
и эмульсии(жидк. в жидк.) 2)
коллоиды,
золи(тонко-дисперсные
системы). Значение
растворов
в жизнедеятельности:
многие хим.процессы протекают лишь при
условии, что участвующие в них вещества
находятся в растворенном состоянии.
Важнейшие биологические жидкости(кровь,
лимфа, моча, слюна, пот) являются растворами
солей, белков, углеводов, липидов в воде.
Усвоение пищи связано с переходом
питат.веществ в растворенное состояние.
Биохимические реакции в живых организмах
протекают в растворах. Биожидкости
участвуют в транспорте питат.веществ(жиров,
аминокислот, кислорода), лекарственных
препаратов к органам и тканям, а также
в выведении из организма метаболитов.
В жидких средах организма поддерживается
постоянство кислотности, концентрации
солей и органических веществ
(концентрационный гомеостаз). Самым
распространенным растворителем на
нашей планете является вода.
Особенности
воды: по
своей теплоемкости превосходит все
вещества; аномальное поведение при
охлаждении – вода уплотняется, начинает
тонуть, потом поднимается(все др.вещества
тонут при уплотнении); может
возгоняться(возгонка воды) – сублимация(при
определен.условиях лед может переходить
в пар без предварительного превращения
в жидкую воду, т.е. без плавления); вода
растворяет все вещества(вопрос только
сколько?); высокая диэлектрическая
постоянная воды(величина, показывающая
во сколько раз сила взаимодействия
между двумя зарядами в данном веществе
меньше, чем в вакууме); высокая критическая
температура; вода является амфолитом(не
кислота, не осн-е); участвует в создании
полимерных структур организма(белок,
липиды…); основа мембранного транспорта.
Термодинамика
растворения:
согласно
2-му началу термодинамики при р,
Т=const
вещества
самопроизвольно могут растворяться в
каком-либо растворителе, если в результате
этого процесса энергия Гиббса системы
уменьшается, т.е.
G=(
.
Роль воды и растворов в жизнедеятельности.
Термодинамика растворения.
Раствор-это
гомогенная система переменного состава
из двух и более веществ, находящаяся в
состоянии равновесия. Классификация:
1)
взвеси(грубо-дисперсная
система): суспензии(тв.в-во в жидкости)
и эмульсии(жидк. в жидк.) 2)
коллоиды,
золи(тонко-дисперсные
системы). Значение
растворов
в жизнедеятельности:
многие хим.процессы протекают лишь при
условии, что участвующие в них вещества
находятся в растворенном состоянии.
Важнейшие биологические жидкости(кровь,
лимфа, моча, слюна, пот) являются растворами
солей, белков, углеводов, липидов в воде.
Усвоение пищи связано с переходом
питат.веществ в растворенное состояние.
Биохимические реакции в живых организмах
протекают в растворах. Биожидкости
участвуют в транспорте питат.веществ(жиров,
аминокислот, кислорода), лекарственных
препаратов к органам и тканям, а также
в выведении из организма метаболитов.
В жидких средах организма поддерживается
постоянство кислотности, концентрации
солей и органических веществ
(концентрационный гомеостаз). Самым
распространенным растворителем на
нашей планете является вода.
Особенности
воды: по
своей теплоемкости превосходит все
вещества; аномальное поведение при
охлаждении – вода уплотняется, начинает
тонуть, потом поднимается(все др.вещества
тонут при уплотнении); может
возгоняться(возгонка воды) – сублимация(при
определен.условиях лед может переходить
в пар без предварительного превращения
в жидкую воду, т.е. без плавления); вода
растворяет все вещества(вопрос только
сколько?); высокая диэлектрическая
постоянная воды(величина, показывающая
во сколько раз сила взаимодействия
между двумя зарядами в данном веществе
меньше, чем в вакууме); высокая критическая
температура; вода является амфолитом(не
кислота, не осн-е); участвует в создании
полимерных структур организма(белок,
липиды…); основа мембранного транспорта.
Термодинамика
растворения:
согласно
2-му началу термодинамики при р,
Т=const
вещества
самопроизвольно могут растворяться в
каком-либо растворителе, если в результате
этого процесса энергия Гиббса системы
уменьшается, т.е.
G=(![]() H
- T
H
- T![]() S)<0.
(
S)<0.
(![]() H-энтальпийный
фактор,
T
H-энтальпийный
фактор,
T![]() S-энтропийный
фактор растворения). При растворении
жидких и твердых веществ
S-энтропийный
фактор растворения). При растворении
жидких и твердых веществ
![]() S>0.
При растворении газов в жидкости
S>0.
При растворении газов в жидкости
![]() S<0.
Изменение
энтальпии представляет собой алгебраическую
сумму изменения энтальпии
S<0.
Изменение
энтальпии представляет собой алгебраическую
сумму изменения энтальпии
![]() Hкр
в результате
разрушения кристаллической решетки и
изменения энтальпии
Hкр
в результате
разрушения кристаллической решетки и
изменения энтальпии
![]() Hсол
за счет
сольватации частицами растворителя
Hсол
за счет
сольватации частицами растворителя
![]() Hраств=
Hраств=
![]() Hкр
+
Hкр
+
![]() Hсол
. При растворении
газов энтальпия
Hсол
. При растворении
газов энтальпия![]() Hкр
=0, т.к. не надо затрачивать энергию на
разрушение кристаллической решетки.
При растворении может происходить
изменение и энтропии, и энтальпии.
10.
Идеальный
раствор-
энтальпия смешивания равна 0 (гомогенные
смеси углеводородов; гипотетический
раствор, где равенство всех сил
межмолекулярного взаимодействия.)
Константа
растворимости или ПР-это
произведение концентраций ионов трудно
растворимого электролита в насыщенном
растворе при данной температуре- величина
постоянная
BaCO3=
Ba
+ CO3
, Ks=[Ba][CO3]
Условия
растворения и образования осадков
Осаждение
и растворение- обменные реакции,
протекающие в растворе электролита
---1)Электролит выпадет
в осадок, если произведение концентрации
его ионов в растворе больше константы
растворимости с(Ba)*с(CO3)>Kпр[BaCO3]
2)Осадок
его растворится если все наоборот
11.
Колигативные
свойства растворов. Коллигативные
свойства растворов
— это те их свойства, которые при данных
условиях оказываются равными и
независимыми от химической природы
растворённого вещества; свойства
растворов, которые зависят лишь от
количества кинетических единиц и от их
теплового движения. Закон
Рауля и следствие из него-
Пар, находящийся в равновесии с жидкостью,
называют насыщенным. Давление такого
пара над чистым растворителем (p0) называют
давлением или упругостью насыщенного
пара чистого растворителя. Давление
пара раствора, содержащего нелетучее
растворенное вещество, прямо пропорционально
мольной доле растворителя в данном
растворе:p =
p0 · χр-ль,
где p — давление пара над раствором,
ПА;p0 — давление пара над чистым
растворителем;χр-ль —мольная доля
растворителя.Для растворов электролитов
используют несколько другую форму
уравнения, позволяющую добавить в неё
изотонический коэффициент:Δp = i · p0 ·
χв-ва, где Δp — собственно изменение
давления по сравнению с чистым
растворителем;χв-ва — мольная доля
вещества в растворе. Из закона Рауля
возникает два следствия.
Согласно одному из них температура
кипения раствора выше температуры
кипения растворителя. Это обусловлено
тем, что давление насыщенного пара
растворителя над раствором становится
равным атмосферному давлению (условие
кипения жидкости) при более высокой
температуре, чем в случае чистого
растворителя. Повышение температуры
кипения Ткип пропорционально моляльности
раствора:. Ткип=
Кэ сm где Кэ
– эбулиоскопическая постоянная
растворителя,cm-моляльная
концентрация.Согласно второму
следствию
из закона Рауля температура замерзания
(кристаллизации) раствора ниже температуры
замерзания (кристаллизации) чистого
растворителя. Это обусловлено более
низким давлением пара растворителя над
раствором, чем над растворителем.
Понижение температуры замерзания
(кристаллизации) Тзам пропорционально
моляльности раствора:
Тзам= Кк сm
где Кк - криоскопическая постоянная
раствораПонижение
температуры кристаллизации
растворов.Условием
кристаллизации является равенство
давления насыщенного пара растворителя
над раствором давлению пара над твёрдым
растворителем. Поскольку давление пара
растворителя над раствором всегда ниже,
чем над чистым растворителем, это
равенство всегда будет достигаться при
температуре более низкой, чем температура
замерзания растворителя. Так, океанская
вода начинает замерзать при температуре
около минус 2 °C.Разность между температурой
кристаллизации растворителя и температурой
начала кристаллизации раствора есть
понижение температуры кристаллизации.Повышение
температуры кипения растворовЖидкость
кипит при той температуре, при которой
общее давление насыщенного пара
становится равным внешнему давлению.
давление насыщенных паров над раствором
при любой температуре будет меньше, чем
над чистым растворителем, и равенство
его внешнему давлению будет достигаться
при более высокой температуре. Таким
образом, температура кипения раствора
нелетучего вещества T всегда выше, чем
температура кипения чистого растворителя
при том же давлении T° .Повышение
температуры кипения бесконечно
разбавленных растворов нелетучих
веществ не зависит от природы растворённого
вещества и прямо пропорционально
моляльной концентрации раствора.
Самопроизвольный переход растворителя
через полупроницаемую мембрану,
разделяющую раствор и растворитель или
два раствора с различной концентрацией
растворенного вещества, называется
осмосом.
Осмос обусловлен
диффузией
молекул растворителя через полупроницаемую
перегородку, которая пропускает только
молекулы растворителя. Молекулы
растворителя диффундируют из растворителя
в раствор или из менее концентрированного
раствора в более концентрированный.Количественно
осмос характеризуется осмотическим
давлением,
равным силе, приходящейся на единицу
площади поверхности, и заставляющей
молекулы растворителя проникать через
полупроницаемую перегородку. Оно равно
давлению столба раствора в осмометре
высотой h. При равновесии внешнее давление
уравновешивает осмотическое давление.
В этом случае скорости прямого и обратного
переходов молекул через полупроницаемую
перегородку становится одинаковыми.
Осмотическое давление возрастает с
увеличением концентрации растворенного
вещества и температуры. Вант-Гофф
предположил, что для осмотического
давления можно применить уравнение
состояния идеального газа: pV = nRТ или p
= (n/V ) RТ откуда
p = с RТ , где
p - осмотическое давление (кПа), с –
молярная концентрация раствора.
Осмотическое давление прямо пропорционально
молярной концентрации растворенного
вещества и температуре. Осмос играет
очень важную
роль в биологических процессах,
обеспечивая поступление воды в клетки
и другие структуры. Растворы с одинаковым
осмотическим давлением называются
изотоническими.
Если осмотическое давление выше
внутриклеточного,
то оно называется гипертоническим,
если ниже внутриклеточного - гипотоническим.
Изотонический
коэффициент (также
фактор Вант-Гоффа; обозначается i) —
безразмерный параметр, характеризующий
поведение вещества в растворе. Он
численно равен отношению значения
некоторого коллигативного свойства
раствора данного вещества и значения
того же коллигативного свойства
неэлектролита той же концентрации при
неизменных прочих параметрах системы.
Изоосмия-относительное
постоянство осмотического давления в
жидких средах и тканях организма,
обусловленное поддержанием на данном
уровне концентраций содержащихся в них
веществ: электролитов, белков .Это одна
из важнейших физиологических констант
организма, обеспечиваемых механизмами
саморегуляции (Гомеостаз). ГЕМОЛИЗ
- разрушение эритроцитов, сопровождающееся
выходом из них гемоглобина. Физические
причины относится действие высоких и
низких температур, ультразвука, к
химическим - гемолитические яды, нек-рые
лекарственные средства и др. Гемолиз
может возникнуть при переливании
несовместимой крови, введении
гипотонических р-ров.Плазмолиз-при
помещении клеток в гипертонический
раствор вода из клеток уходит в более
концентрированный раствор и наблюдается
сморщивание клеток.
Hкр
=0, т.к. не надо затрачивать энергию на
разрушение кристаллической решетки.
При растворении может происходить
изменение и энтропии, и энтальпии.
10.
Идеальный
раствор-
энтальпия смешивания равна 0 (гомогенные
смеси углеводородов; гипотетический
раствор, где равенство всех сил
межмолекулярного взаимодействия.)
Константа
растворимости или ПР-это
произведение концентраций ионов трудно
растворимого электролита в насыщенном
растворе при данной температуре- величина
постоянная
BaCO3=
Ba
+ CO3
, Ks=[Ba][CO3]
Условия
растворения и образования осадков
Осаждение
и растворение- обменные реакции,
протекающие в растворе электролита
---1)Электролит выпадет
в осадок, если произведение концентрации
его ионов в растворе больше константы
растворимости с(Ba)*с(CO3)>Kпр[BaCO3]
2)Осадок
его растворится если все наоборот
11.
Колигативные
свойства растворов. Коллигативные
свойства растворов
— это те их свойства, которые при данных
условиях оказываются равными и
независимыми от химической природы
растворённого вещества; свойства
растворов, которые зависят лишь от
количества кинетических единиц и от их
теплового движения. Закон
Рауля и следствие из него-
Пар, находящийся в равновесии с жидкостью,
называют насыщенным. Давление такого
пара над чистым растворителем (p0) называют
давлением или упругостью насыщенного
пара чистого растворителя. Давление
пара раствора, содержащего нелетучее
растворенное вещество, прямо пропорционально
мольной доле растворителя в данном
растворе:p =
p0 · χр-ль,
где p — давление пара над раствором,
ПА;p0 — давление пара над чистым
растворителем;χр-ль —мольная доля
растворителя.Для растворов электролитов
используют несколько другую форму
уравнения, позволяющую добавить в неё
изотонический коэффициент:Δp = i · p0 ·
χв-ва, где Δp — собственно изменение
давления по сравнению с чистым
растворителем;χв-ва — мольная доля
вещества в растворе. Из закона Рауля
возникает два следствия.
Согласно одному из них температура
кипения раствора выше температуры
кипения растворителя. Это обусловлено
тем, что давление насыщенного пара
растворителя над раствором становится
равным атмосферному давлению (условие
кипения жидкости) при более высокой
температуре, чем в случае чистого
растворителя. Повышение температуры
кипения Ткип пропорционально моляльности
раствора:. Ткип=
Кэ сm где Кэ
– эбулиоскопическая постоянная
растворителя,cm-моляльная
концентрация.Согласно второму
следствию
из закона Рауля температура замерзания
(кристаллизации) раствора ниже температуры
замерзания (кристаллизации) чистого
растворителя. Это обусловлено более
низким давлением пара растворителя над
раствором, чем над растворителем.
Понижение температуры замерзания
(кристаллизации) Тзам пропорционально
моляльности раствора:
Тзам= Кк сm
где Кк - криоскопическая постоянная
раствораПонижение
температуры кристаллизации
растворов.Условием
кристаллизации является равенство
давления насыщенного пара растворителя
над раствором давлению пара над твёрдым
растворителем. Поскольку давление пара
растворителя над раствором всегда ниже,
чем над чистым растворителем, это
равенство всегда будет достигаться при
температуре более низкой, чем температура
замерзания растворителя. Так, океанская
вода начинает замерзать при температуре
около минус 2 °C.Разность между температурой
кристаллизации растворителя и температурой
начала кристаллизации раствора есть
понижение температуры кристаллизации.Повышение
температуры кипения растворовЖидкость
кипит при той температуре, при которой
общее давление насыщенного пара
становится равным внешнему давлению.
давление насыщенных паров над раствором
при любой температуре будет меньше, чем
над чистым растворителем, и равенство
его внешнему давлению будет достигаться
при более высокой температуре. Таким
образом, температура кипения раствора
нелетучего вещества T всегда выше, чем
температура кипения чистого растворителя
при том же давлении T° .Повышение
температуры кипения бесконечно
разбавленных растворов нелетучих
веществ не зависит от природы растворённого
вещества и прямо пропорционально
моляльной концентрации раствора.
Самопроизвольный переход растворителя
через полупроницаемую мембрану,
разделяющую раствор и растворитель или
два раствора с различной концентрацией
растворенного вещества, называется
осмосом.
Осмос обусловлен
диффузией
молекул растворителя через полупроницаемую
перегородку, которая пропускает только
молекулы растворителя. Молекулы
растворителя диффундируют из растворителя
в раствор или из менее концентрированного
раствора в более концентрированный.Количественно
осмос характеризуется осмотическим
давлением,
равным силе, приходящейся на единицу
площади поверхности, и заставляющей
молекулы растворителя проникать через
полупроницаемую перегородку. Оно равно
давлению столба раствора в осмометре
высотой h. При равновесии внешнее давление
уравновешивает осмотическое давление.
В этом случае скорости прямого и обратного
переходов молекул через полупроницаемую
перегородку становится одинаковыми.
Осмотическое давление возрастает с
увеличением концентрации растворенного
вещества и температуры. Вант-Гофф
предположил, что для осмотического
давления можно применить уравнение
состояния идеального газа: pV = nRТ или p
= (n/V ) RТ откуда
p = с RТ , где
p - осмотическое давление (кПа), с –
молярная концентрация раствора.
Осмотическое давление прямо пропорционально
молярной концентрации растворенного
вещества и температуре. Осмос играет
очень важную
роль в биологических процессах,
обеспечивая поступление воды в клетки
и другие структуры. Растворы с одинаковым
осмотическим давлением называются
изотоническими.
Если осмотическое давление выше
внутриклеточного,
то оно называется гипертоническим,
если ниже внутриклеточного - гипотоническим.
Изотонический
коэффициент (также
фактор Вант-Гоффа; обозначается i) —
безразмерный параметр, характеризующий
поведение вещества в растворе. Он
численно равен отношению значения
некоторого коллигативного свойства
раствора данного вещества и значения
того же коллигативного свойства
неэлектролита той же концентрации при
неизменных прочих параметрах системы.
Изоосмия-относительное
постоянство осмотического давления в
жидких средах и тканях организма,
обусловленное поддержанием на данном
уровне концентраций содержащихся в них
веществ: электролитов, белков .Это одна
из важнейших физиологических констант
организма, обеспечиваемых механизмами
саморегуляции (Гомеостаз). ГЕМОЛИЗ
- разрушение эритроцитов, сопровождающееся
выходом из них гемоглобина. Физические
причины относится действие высоких и
низких температур, ультразвука, к
химическим - гемолитические яды, нек-рые
лекарственные средства и др. Гемолиз
может возникнуть при переливании
несовместимой крови, введении
гипотонических р-ров.Плазмолиз-при
помещении клеток в гипертонический
раствор вода из клеток уходит в более
концентрированный раствор и наблюдается
сморщивание клеток.
12. Элементы теории растворов электролитов. Сильные и слабые электролиты. Константа ионизации слабого электролита. Закон разведения Оствальда. Ионная сила раствора. Активность и коэффициент активности ионов. Электролиты в организме, слюна как электролит.
Электролиты – это вещества с ионными или сильнополярными ковалентными связями в водных растворах, подвергающиеся электролитической диссоциации, в результат чего образуются катионы и анионы.
Сильные электролиты – вещества, способные диссоциировать нацело. К ним относится большинство солей, а так же некоторые вещества молекулярного строения (HCl).
Слабые электролиты диссоциируют в незначительно степени, и преобладающей формой их является молекулярная (H2S, органические кислоты).
Количественно способность молекулярного электролита к диссоциации определяется степенью ионизации(она зависит от концентрации электролита):
α=
![]() ,
,
где Nобщ – общее число молекул в растворе; N иониз – число молекул, распавшихся на ионы.
Константа ионизации:
Kd=
![]() ,
,
Где [A],[B] – распавшиеся ионы
[AB] – не распавшееся на ионы вещество.
Закон разбавления Оствальда:
K= α2c/1- α ,
Где α – степень ионизации
С – молярная концентрация
Ионная сила раствора:
I=0.5∑сizi2,
Где сi – молярная концентрация иона в растворе, моль/л
zi – заряд иона.
Активность иона – это его эффективная концентрация.
Активность связана с молярной концентрацией следующим образом:
a=f*c,
где f – коэффициент активности
Электролиты в организме: Na и Cl участвуют в поддержании кислотно-щелочного баланса, осмотического равновесия в организме. Са играет большую роль в построении костной ткани и зубов, в регулировании кислотности крови и ее свертывании, в возбудимости мышечной и нервной ткани. К находится преимущественно в жидкостях тела и мягких тканях, где является необходимым элементом для поддержания осмотического давления, регуляции рН крови. Mg является кофактором многих ферментативных реакций, необходим на всех этапах синтеза белка. В живых организмах Fe является важным микроэлементом, катализирующим процессы обмена кислородом. Сo входит в состав витамина В12, задействован при кроветворении, функциях нервной системы и печени, ферментативных реакциях. Zn необходим для метаболизма витамина E, участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста. Mn оказывает влияние на рост, образование крови и функции половых желёз.
Слюна как электролит является сложной биохимической средой. Количество ионов Н+ и ОН" определяет рН слюны, который в норме равен 6,9. Величина водородного показателя изменяется в зависимости от характера патологического процесса в полости рта. Так. при инфекционных заболеваниях реакция слюны кислая. Из неорганических веществ в слюне содержатся анионы хлора, брома, иода, фтора. Анионы фосфатов, фтора способствуют увеличению электрохимических потенциалов, анион хлора - переносу ионных зарядов и является деполяризатором (фактор, ускоряющий анодные и катодные процессы). В слюне определяются микроэлементы: железо, медь, серебро, марганец, алюминий и др. - и макроэлементы: кальций, калий, натрий, магний, фосфор.
