
- •Государственное образовательное учреждение
- •Раздел 1. Введение в биохимию…………………………………..…..…...5
- •Раздел 1. Введение в биохимию.
- •Раздел 2. Белки: структура, свойства, функции.
- •Раздел 3. Ферменты: структура, свойства, регуляция активности.
- •При аллостерическом ингибировании активности ферментов:
- •Раздел 4. Синтез белка.
- •Раздел 5. Цикл трикарбоновых кислот.
- •Раздел 6. Энергетический обмен.
- •Раздел 7. Биохимия гормонов.
- •Раздел 8. Обмен углеводов.
- •Разел 9. Обмен липидов.
- •Раздел 10. Обмен белков.
- •Раздел 11. Биохимия печени.
- •Раздел 12. Биохимия крови.
- •Раздел 13. Биохимия соединительной ткани.
- •Раздел 14. Биохимия мышечного сокращения.
- •Раздел 15. Биохимия ротовой полости.
- •Ответы. Ответы к разделу 1:
- •Ответы к разделу 2:
- •Ответы к разделу 4:
- •Ответы к разделу 5:
- •Ответы к разделу 6:
- •Ответы к разделу 7:
- •Ответы к разделу 8:
- •Ответы к разделу 9:
- •Ответы к разделу 12:
- •12.1 2→1→3
- •Ответы к разделу 13:
- •Ответы к разделу 14:
- •Ответы к разделу 15:
Раздел 2. Белки: структура, свойства, функции.
Сравните растворимость трех пентапептидов при рН=7. Расположите их в порядке возрастания гидрофильных свойств:
1) лей – фен – иле – гли – вал;
2) глу – асп – сер – фен – иле.
3) арг – лиз – тре – гис – цис.
Расположите элементы структуры белковой молекулы в той последовательности, в которой они возникают при синтезе белка и формировании его нативной конформации.
Объединение протомеров в олигомерный белок.
Формирование α-спиралей и β-складчатых участков.
Образование пептидных связей.
Образование гидрофобных, водородных и ионных связей между радикалами аминокислот.
Напишите структурную формулу пентапептида следующего строения:
Гис – Глу - Про – Фен – Сер.
Взаимодействие субъединиц в олигомерном белке и белков с лигандами обусловлено принципом ...
Аминокислоты серин, тирозин и треонин, согласно классификации по химической природе радикала, относятся к … аминокислотам и при формировании третичной структуры могут образовывать … связи.
Аспарагиновая и глутаминовая аминокислоты, согласно классификации по химической природе радикала, относятся к … аминокислотам и при формировании третичной структуры могут образовывать … связи с радикалами следующих аминокислот …
Разделение белков методом электрофореза основано на их различии по …
В основе метода гемодиализа лежит разделение высокомолекулярных соединений от низкомолекулярных примесей с помощью …
Назовите данный трипептид:
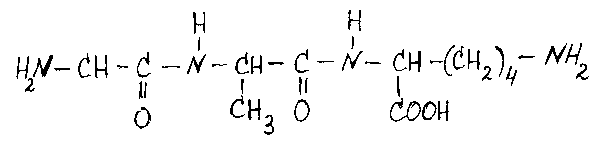
Назовите данный трипептид:
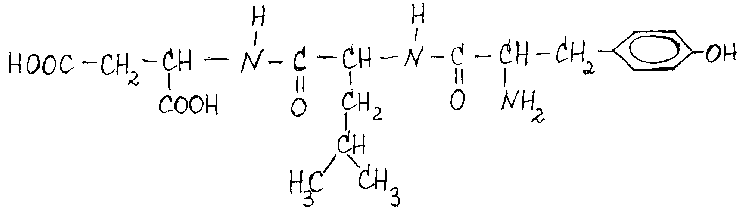
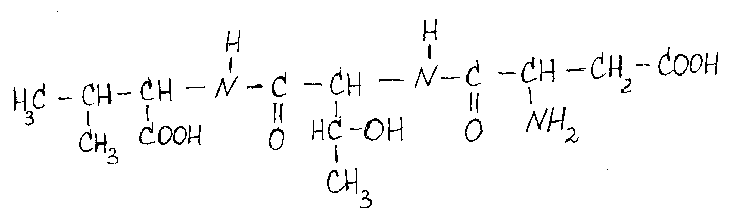 Назовите
данный трипептид:
Назовите
данный трипептид:
Подберите к каждой из аминокислот соответствующее свойство радикала (подберите к буквам соответствующие цифры):
|
1.Триптофан. |
A-Гидрофильный, |
|
2.Аспарагиновая кислота. |
положительно заряженный. |
|
3.Цистеин. |
Б-Гидрофильный, |
|
4.Лейцин. |
отрицательно заряженный. |
|
5.Аргинин. |
В-Гидрофильный, незаряженный. |
|
6.Серин. |
Г-Гидрофобный. |
Разные уровни структурной организации белков стабилизированы определёнными типами связей. Подберите к каждому пронумерованному типу связи буквенный ответ:
|
1.Ковалентные связи между карбоксильными и аминогруппами радикалов аминокислот. |
|
|
2.Связь между α- амино- и α-карбокси-группировками аминокислот. |
A-Первичная структура. |
|
3.Связь между радикалами цистеина. |
|
|
4.Водородные связи между пептидными группировками. |
Б-Вторичная структура. |
|
5.Водородные связи между радикалами аминокислот. |
В-Третичная структура. |
|
6.Гидрофобные взаимодействия радикалов аминокислот. |
|
Дан фрагмент пентапептидной цепи: серил-лизил-лейцил-цистеил-валин.
Выберите аминокислоты, которые могут участвовать в образовании:
|
|
1. Серин. |
|
А – Водородной связи. |
2. Лизин. |
|
Б – Ионной связи. |
3. Лейцин. |
|
В – Гидрофобного взаимодействия. |
4. Цистеин. |
|
|
5. Валин. |
Определите, как будут вести себя при электрофорезе в нейтральной среде следующие аминокислоты:
|
1. Лизин. |
А – Двигается к аноду. |
|
2. Триптофан. |
Б – Двигается к катоду. |
|
3. Аспартат. |
В – Останутся на линии старта. |
|
4. Глутамат. |
|
|
5. Фенилаланин. |
|
|
6. Гистидин. |
|
Какие из перечисленных факторов могут изменять конформацию белковой молекулы:
|
А – регулировать биологическую активность белков; |
|
| |
|
Б – вызывать денатурацию белка.
|
|
| |
|
Какие свойства белка обусловлены наличием в их структуре карбоксильных и аминогрупп?
гидрофильность и агрегативная неустойчивость;
термолабильность и растворимость;
способность к электрофорезу и реакциям осаждения;
амфотерность и способность к электрофорезу.
Для изучения первичной структуы белка применяется метод:
секвенирования;
рентгеноструктурного анализа;
определение коэффициента поступательного трения;
определение характеристической вязкости.
Какова особенность кислых белков?
преобладание дикарбоновых аминокислот;
равное соотношение диаминомонокарбоновых и моноаминодикарбоновых аминокислот;
преобладание диаминомонокарбоновых кислот;
белок состоит из моноамино- и монокарбоновых кислот.
Белки характеризуются:
амфотерными свойствами;
отсутствием специфической молекулярной организации;
сохранением структуры молекулы при кипячении;
неспособностью кристаллизоваться.
Первичная структура белка – это:
конфигурация полипептидной цепи;
способ укладки полипептидной цепи в определенном объеме;
порядок чередования аминокислот в полипептидной цепи;
количественный состав аминокислот в полипептидной цепи.
Вторичная структура – это:
альфа-спираль, бета-складчатость и аморфные участки;
конфигурация полипептидной цепи;
образование протомера;
способ взаимодействия нескольких протомеров в пространстве.
Третичная структура белка – это высшая ступень организации для:
олигомерных белков;
мономерных белков;
доменных белков.
Связи, стабилизирующие α-спираль:
водородные;
гидрофобные;
пептидные;
ионные.
Что такое лиганд?
мономер четвертичного белка;
часть молекулы протомера, выполняющая определенную функцию;
скопление гидрофобных аминокислот на поверхности белка;
молекула или ион, которые связываются с белком.
Что такое кластер?
скопление радикалов на поверхности белка, выполняющих функцию связывания;
мономер четвертичного белка;
небелковая часть сложного белка;
часть молекулы протомера, выполняющая определенную функцию.
Домен – это:
часть протомера, участвующая в функции связывания;
мономер четвертичного белка;
часть протомера, выпоняющая сходные функции в разных белках;
небелковая часть сложного белка.
Четвертичная структура – это:
пространственная укладка протомера;
пространственная укладка нескольких протомеров;
α-спираль и β-структура;
образование доменов.
Нативные свойства олигомерных белков проявляются при формировании:
α-спирали;
четвертичной ступени организации;
β-структуры;
третичной ступени организации.
Взаимодействие субъединиц в олигомерном белке осуществляется за счет:
всех типов слабых связей;
только ковалентных связей;
только гидрофобных связей;
ионов металлов.
Нативные свойства мономерных белков проявляются при формировании:
α-спирали;
третичной структуры;
полипептидной цепи;
четвертичной структуры;
вторичной структуры.
Скорость седиментации белка зависит от:
числа растворенных молекул;
формы молекулы белка;
ионной силы раствора;
величины молекулы и ее массы.
Изоэлектрическая точка гемоглобина равна 6,8. Куда мигрирует данный белок в среде с рН=3,0 при электрофорезе?
мигрирует к катоду;
остается на линии старта;
образует биполярный ион;
мигрирует к аноду.
Обратимая денатурация белка происходит при:
длительном нагревании;
действии сильных кислот;
кратковременном воздействии спирта;
добавлении солей тяжелых металлов.
При денатурации белка происходит:
изменение пространственной организации молекулы;
связывание ионогенных групп;
сохранение конформации белка.
Необратимая денатурация происходит при:
высаливании;
кратковременном воздействии спирта;
действии сильных кислот;
воздействии постоянного электрического поля.
Представителями хромопротеинов являются:
цитохромы;
каталаза;
гемоглобин;
миоглобин;
хлорофилл;
рибофлавин.
Какой заряд имеет белок в ИЭТ?
положительный;
отрицательный;
электрически нейтрален;
любой.
Как будет мигрировать белок при проведении электрофореза в условиях, когда pHраствора имеет более щелочное значение, чем ИЭТ?
к аноду;
к катоду;
остаётся на месте старта;
образует биполярный ион.
Что является простетической группой гемоглобина?
четыре пиррольных кольца, соединённых с железом;
протопорфирин;
железосодержащий протопорфирин.
Какой метод можно применить для фракционирования белков?
кристаллизацию;
осаждение кислотами и щелочами;
электрофорез;
высаливание.
Укажите суммарный заряд в нейтральной среде для тетрапептида
глицил-аспарагил-лизил-гистидин:
положительный;
отрицательный;
нейтральный.
Укажите направление движения пептида лиз-гли-ала-лейв процессе электрофореза на бумаге приpH=7.0:
к катоду;
к аноду;
останется на старте.
Какой процесс сопровождается потерей белком гидрофильных и приобретением гидрофобных свойств:
гидролиз;
денатурация;
диссоциация;
седиментация.
Специфичность белков обусловлена:
аминокислотным составом, их чередованием;
содержанием α-спирализованных и β-складчатых участков;
наличием определённых кластеров;
наличием небелкового компонента.
Укажите аминокислоты, радикалы которых имеют при pH=7.0 отрицательный заряд:
лизин;
серин;
треонин;
глутаминовая кислота;
аргинин;
аспарагин.
О чём позволяет судить биуретовая реакция:
о наличии белков в биологической жидкости;
о первичной структуре белка;
о наличии аминокислот в белке;
о функциях белков.
Из приведённых ниже аминокислот выберите те, радикалы которых могут участвовать в образовании водородных связей:
аспарагиновая кислота;
глицин;
глутаминовая кислота;
серин;
валин;
лизин;
гистидин.
Выберите пары аминокислот, способные образовывать связи при формировании третичной структуры белка:
серин, аланин;
аланин, валин;
глутамин, аспарагиновая кислота;
цистеин, цистеин;
гистидин, аспарагиновая кислота;
фенилаланин, аргинин;
цистеин, аланин;
глутаминовая кислота, лизин.
Что представляют собой контактные поверхности протомеров в олигомерном белке:
поверхностные участки протомеров, между аминокислотными остатками которых образуются преимущественно ковалентные связи;
поверхностные участки протомеров, комплементарные друг другу, в результате пространственного и химического соответствия между двумя поверхностями образуется большое количество слабых связей;
поверхностные участки протомеров, представленные только небелковыми группами, за счёт которых осуществляется контакт взаимодействующих полипептидных цепей;
фрагменты полипептидных цепей уложенных в пространстве в виде бета-структур.
Какие из перечисленных ниже взаимодействий обусловлены комплементарностью молекул:
белки с лигандами;
протомеры в олигомерном белке;
белок с диполями воды в растворе;
функционально связанные ферменты при формировании полиферментных комплексов;
различные белки в процессе самосборки клеточных органелл;
радикалы аминокислот при формировании третичной структуры белка.
Что представляет собой центр узнавания белка лигандом:
совокупность радикалов аминокислот, сближенных на уровне третичной структуры;
фрагмент третичной структуры;
простетическая небелковая группа;
участок белка, комплементарный лиганду.
Чем определяется растворимость белка в водной среде:
ионизацией белковой молекулы;
гидратацией белковой молекулы при растворении;
формой молекулы белка;
наличием в структуре гидрофильных аминокислот;
Что происходит с белком при денатурации:
уменьшение растворимости;
изменение степени гидратации;
осаждение;
сохранение нативной структуры;
изменение молекулярной массы;
потеря биологических свойств.
Какие из перечисленных ниже факторов могут вызвать денатурацию белка:
температура выше 600С;
взаимодействие с лигандом (субстратом, эффектором-регулятором, кофактором);
отщепление части полипептидной цепи при действии протеолитических ферментов;
значительные изменения pH;
изменение модификации белков (присоединение фосфатной, метильной или ацетильной группировки к молекуле белка);
действие солей тяжёлых металлов;
действие солей щёлочноземельных металлов.
