
- •Химическое отделение вятский государственный гуманитарный университет
- •М.А. Зайцев
- •Углеводороды
- •Виды изомерии органических соединений
- •Функциональные группы и классы органических веществ
- •Примеры названий органических веществ
- •Электронная структура атома углерода в органических соединениях
- •Химическая связь в органических соединениях
- •Длины и энергии углерод-углеродных связей
- •Классификация органических реакций
- •Углеводороды Алканы
- •Алкадиены
- •3Нссн бензол
- •Ароматические углеводороды (арены)
- •Задачи по теме
- •Цепочки превращений
- •Литература
Алкадиены
Алкадиены (диеновые углеводороды) – ненасыщенные углеводороды, молекулы которых содержат 2 двойные связи С=С.
Общая формула алкенов – СnH2n–2.
По взаимному расположению двойных связей различают следующие диеновые углеводороды.
1. Диены с кумулированными двойными связями содержат непосредственно примыкающие друг к другу двойные связи. Например:
Н2С=С=СН2 – пропадиен (аллен).
2. Диены с сопряженными двойными связями. В этом случае в соединении двойные и одинарные связи чередуются. Например:
Н2С=СН–СН=СН2 – бутадиен-1,3 (дивинил).
3. Диены с изолированными двойными связями. В этих соединениях двойные связи разделены в цепи одним и более sp3-гибридными атомами углерода. Например:
Н2С=СН–СН2–СН=СН2 – пентадиен-1,4.
Диены с изолированными двойными связями не отличаются по свойствам от алкенов.
Природа сопряженных двойных связей
Рассмотрим строение молекул алкадиенов с сопряженными двойными связями на примере молекулы бутадиена-1,3. В ней все атомы углерода находятся в состоянии sр2-гибридизации. Они лежат в одной плоскости. Четыре параллельные друг другу орбитали р-электронов перпендикулярны плоскости молекулы. При взаимодействии подвижных р-электронов двух сопряженных -связей возникает единое -электронное облако, охватывающее все 4 атома углерода. Отдельные р-электроны не закреплены попарно в определенных связях, а делокализованы, т.е. распределены по всей сопряженной системе, по всем находящимся в сопряжении связям, и простым, и кратным.
Взаимное влияние сопряженных связей проявляется в некотором выравнивании межъядерных расстояний. Длина центральной связи (0,148 нм) короче обычной -связи (0,154 нм), а кратные связи (0,136 нм) несколько длиннее обычной двойной связи (0,133 нм).
В связи с вышесказанным формулу бутадиена-1,3 часто изображают так:
![]()
Сопряженные системы обладают меньшим запасом энергии, т.е. они более устойчивы, чем соединения с изолированными двойными связями.
Способы получения
Для получения бутадиена-1,3 используют бутановую фракцию крекинг-процесса нефти или попутный нефтяной газ.
Синтетический способ получения бутадиена-1,3 из этанола был открыт в 1932 г. С.В. Лебедевым. Он заключается в одновременном дегидрировании и дегидратации этанола:
2С2Н5ОН
![]() СН2=СН–СН=СН2
+ Н2
+ 2Н2О.
СН2=СН–СН=СН2
+ Н2
+ 2Н2О.
В качестве катализаторов в этом процессе используют ZnO, Al2О3 и др.
2-Метил-бутадиен-1,3, или изопрен, впервые был получен из натурального каучука нагреванием его без доступа воздуха (сухая перегонка).
В настоящее время его получают из легких фракций углеводородов нефти:

Химические свойства
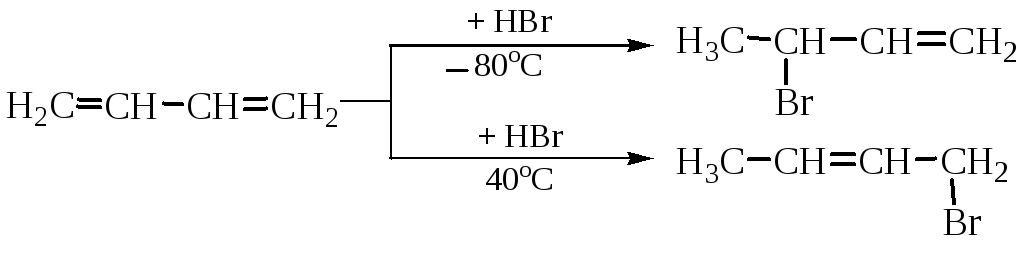
Характерны реакции электрофильного присоединения. Однако, в химическом поведении алкадиенов-1,3 есть особенности, связанные с наличием в их молекулах сопряжения. Так, в реакции присоединения могут быть получены два продукта – за счет присоединения по любой двойной связи (1,2-присоединение) или в результате 1,4-присоединения.
Преимущественное протекание реакции по тому или иному пути зависит от конкретных условий.
1. Гидрирование.

2. Гидрогалогенирование.
Алкины
Алкины – ненасыщенные углеводороды, содержащие в молекуле тройную связь СС.
Общая формула алкинов – СnН2n–2 (алкины изомерны алкадиенам). простейшим представителем алкинов является ацетилен НССН.
В образовании тройной связи участвуют три пары обобщенных электронов. Атомы углерода, образующие тройную связь, находятся в состоянии sр-гибридизации. Каждый из них образует две -связи, направленные под углом 180, с атомами углерода и (или) водорода. Две негибридные р-орбитали каждого атома углерода расположены под прямым углом друг к другу. Они попарно перекрываются, образуя две -связи, расположенные в двух взаимно перпендикулярных плоскостях.
Способы получения
Сырьевыми источниками ацителена являются уголь, природный газ, нефть.
Прокаливанием угля в смеси с оксидом кальция в электрических печах получают карбид кальция, при разложении которого водой образуется ацетилен:
3С
+ СаО
![]() СаС2
+ СО;
СаС2
+ СО;
СаС2 + 2Н2О НССН + Са(ОН)2.
Этот способ применяют как в лабораториях, так и в промышленности, где он освоен еще в XIX в. Но карбидный ацетилен дорог вследствие больших затрат электроэнергии.
В более новом способе ацетилен получают термическим крекингом или электрокрекингом метана:
2СН4
![]() НССН
+ 3Н2
НССН
+ 3Н2
и гомологов метана:
С2Н6
![]() НССН
+ 2Н2.
НССН
+ 2Н2.
Другой путь получения ацетилена – окислительный пиролиз – сожжение метана с недостаточным количеством воздуха. При этом идет частичное окисление метана:
6СН4
+ О2
![]() 2НССН
+ 2СО + 10Н2.
2НССН
+ 2СО + 10Н2.
Другие алкины получают из дигалогенопроизводных:

Химические свойства
Типичными реакциями для ацетилена и его гомологов являются реакции присоединения, протекающие аналогично соответствующим реакциям алкенов, но в две последовательные стадии.
Тройная связь окисляется труднее и в более жестких условиях, чем двойная. Термически она также более устойчива.
1. Реакции присоединения.
– Присоединение галогена (качественная реакция).
НССН
+ Br2
Br–CH=CH–Br
![]()
![]()
– Присоединение галогеноводородов.
НССН + HCl Н2С=СН–Cl
винилхлорид (хлорвинил)
Реакции присоединения молекул типа НХ к гомологам ацетилена протекают по правилу В. В. Марковникова:

– Гидрирование алкинов протекает легче, чем гидрирование алкенов:
НССН
+ Н2
![]() Н2С=СН2
Н2С=СН2
![]() Н3С–СН3.
Н3С–СН3.
– Гидратация (реакция М.Г. Кучерова, 1881 г.).
При присоединении воды образуются оксосоединения, т.к. ненасыщенные спирты с группой ОН у атома углерода, при котором имеется двойная связь, нестойки и превращаются в карбонильные соединения – альдегиды или кетоны (правило А.П. Эльтекова, 1877 г.):


2. Реакции окисления.
– Горение. Ацетилен горит коптящим пламенем:
2С2Н2 + 5О2 4СО2 + 2Н2О
– Окисление раствором перманганата калия (качественная реакция).
3Н3С–СС–СН2–СН3 + 8KMnO4 + 4H2O
3H3C–COOH + 3H3C–CH2–COOH + 8MnO2 + 8KOH
уксусная кислота пропионовая кислота
Наблюдается выделение бурого осадка оксида марганца (IV) и обесцвечивание раствора перманганата калия.
3. Реакции полимеризации и циклизации.
2НССН
![]() СН2=СН–ССН
винилацетилен
СН2=СН–ССН
винилацетилен
