
овр
.pdf
Диаграмма Латимера для Cl (pH=0)
+7 |
|
+5 |
|
+3 |
|
+1 |
|
|
0 |
|
-1 |
||||||
|
|
|
|
|
|
+1.458 |
|
|
|
|
|
|
|
|
|||
|
|
- +1.20 |
|
|
- +1.18 |
|
|
+1.65 |
|
|
+1.63 |
|
|
+1.36 |
- |
||
ClO |
ClO |
HClO |
HClO |
Cl |
|||||||||||||
4 |
3 |
2 |
|
|
Cl |
||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|||||
|
|
|
+1.19 |
|
|
|
|
|
+1.495 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E0(HClO/Cl-) = [E0(HClO/Cl2) + E0(Cl2/Cl-)]/2 = (1.63+1.36)/2 = 1.495 В E0(ClO4-/HClO2) = [2E0(ClO4-/ClO3-) + 2E0(ClO3-/HClO2)]/4 = 1.19 В E0(ClO3-/Cl2) = [2E0(ClO3-/HClO2) + 2E0(HClO2/HClO) + E0(HClO/Cl2)]/5 =
= [2x(1.18) + 2x(1.65) + 1.63]/5 = 1.458 В
Диаграммы Латимера для Mn
+7 |
|
+6 |
|
+5 |
|
+4 |
|
+3 |
|
+2 |
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1.51
MnO − 0.90 |
HMnO − |
4.18 |
4 |
4 |
|
|
|
2.09 |
1.69
0.34
MnO4− 0.56 MnO42− 0.27 MnO43− 0.93
0.60
0.59
|
|
1.23 |
|
|
|
|
MnO |
0.95 Mn3+ |
1.5 |
Mn2+ |
1.18 Mn |
||
|
|
2 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
[H+] = 1 моль/л |
||
|
|
Кислая |
|
|||
|
|
среда |
|
[OH ] = 10 14 моль/л |
||
|
|
|
|
|
|
|
0.088
MnO2 0.15 Mn2O3 0.23 Mn(OH)2 1.56 Mn
|
|
[H+] = 10 14 моль/л |
Щелочная |
|
|
среда |
|
[OH ] = 1 моль/л |
|
|
|
Диаграммы Фроста: построение
Диаграмма Фроста: «степень окисления – вольт-эквивалент»
График зависимости NE0 для пары X(N)/X(0) от степени окисления N элемента X
Чем больше наклон «возрастающей прямой», тем более сильные окислительные свойства проявляет RedOx пара.
X(N) + Ne-
Построение диаграммы
O2 +0.70 H2O2 +1.76 H2O
+1.23
NE0(O2/H2O2) = (-1)x(+0.70) = -0.7
NE0(O2/H2O) = (-2)x(+1.23) = -2.46
= X(0) |
E0, В |
|
|
|
|
0,0 |
NE0, V |
|
|
|
|
|
H2O2 |
|
|
||
-0,5 |
|
|
|
|
|
|
|
|
|
O2 |
|
|
|
|
|
|
|
-1,0 |
|
|
|
|
|
-1,5 |
|
|
|
|
|
-2,0 |
|
|
диспропорционирует |
||
|
|
|
|
|
|
-2,5 |
|
H2O |
|
|
|
|
|
|
|
|
|
|
-2,0 |
-1,5 |
-1,0 |
-0,5 |
0,0 |
H O |
2 |
= H O +1/2O |
2 |
E0 |
= -0.70 + 1.76 = +1.06 |
|
2 |
2 |
|
|
N |
||
|
|
|
|
|
G < 0 ! |
|
|
|
|
|
|
|
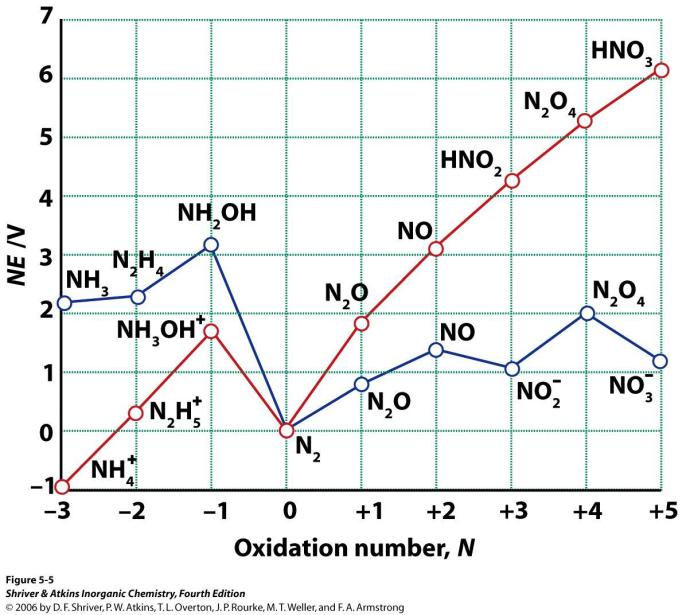
Диаграмма Фроста для азота
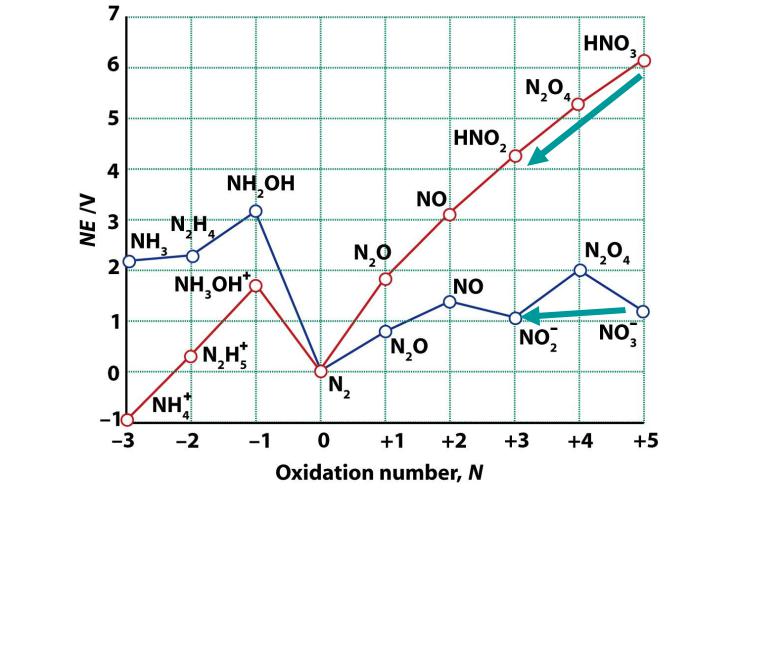
1. В кислой среде окислительные свойства в положительных с.о. выражены сильнее, чем в щелочной
E0(NO3-/HNO2) = +0.93B
E0(NO3-/NO2-) = +0.01B
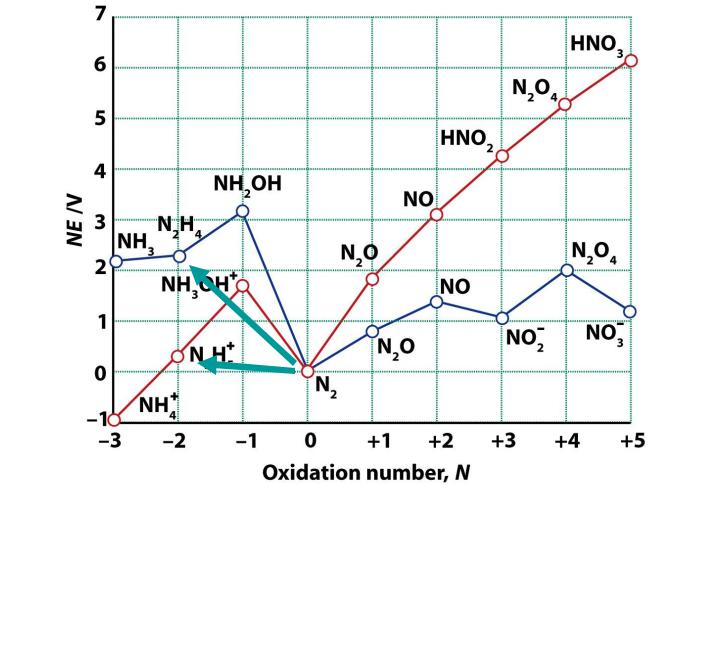
2. В кислой среде восстановительные свойства в отрицательных с.о. выражены слабее, чем в щелочной
E0(N2/N2H5+) = -0.23B
E0(N2/N2H4) = -1.12B
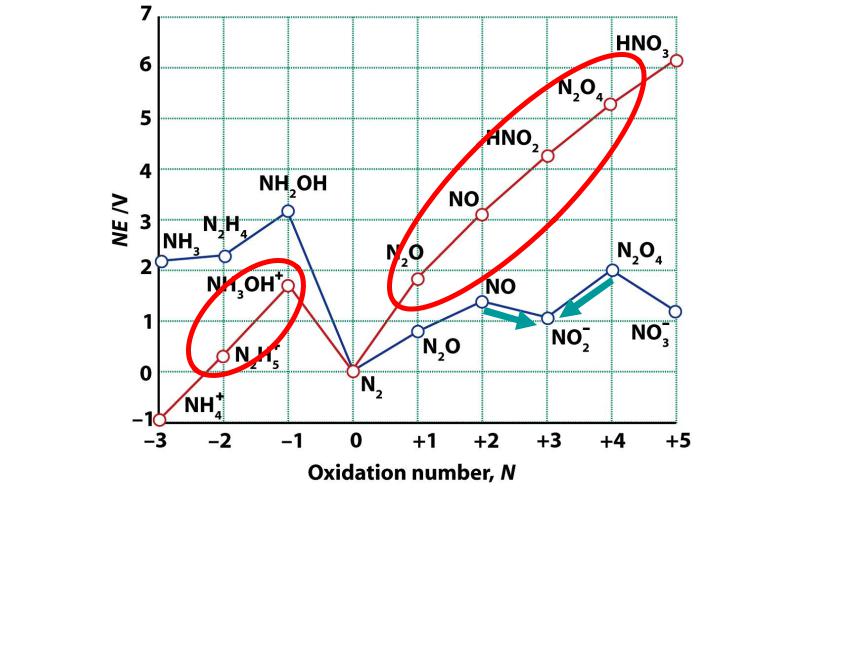
3.В кислой среде диспропорционируют все с.о. с образованием
N2, HNO3, NH4+
4.В щелочной среде NO и N2O4 сопропорционируют
2NO + N2O4 + 4OH- = 4NO2- + 2H2O
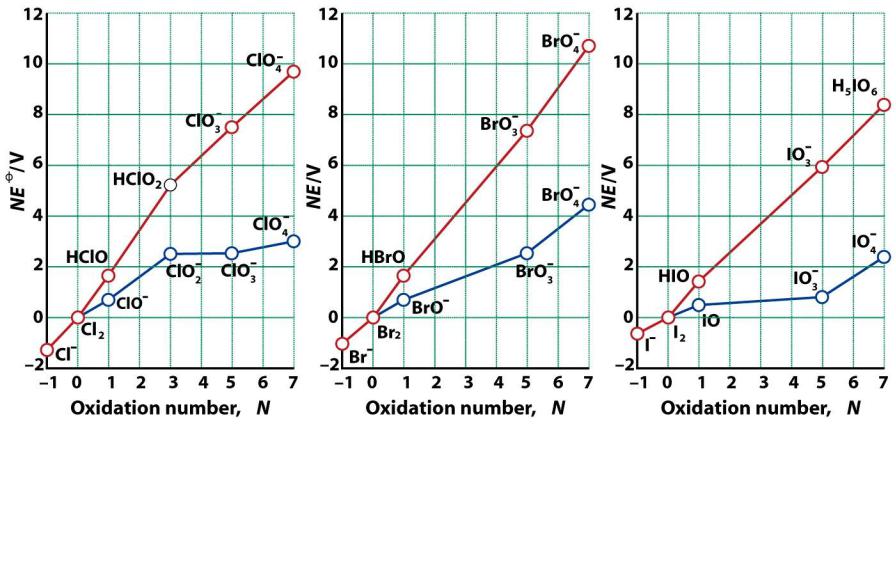
Диаграммы Фроста для галогенов
1.Наклон линии указывает на окислительную способность
2.Графики различны для разных значений рН
3.Минимумы и максимумы указывают на возможность сопропорционирования и диспропорционирования
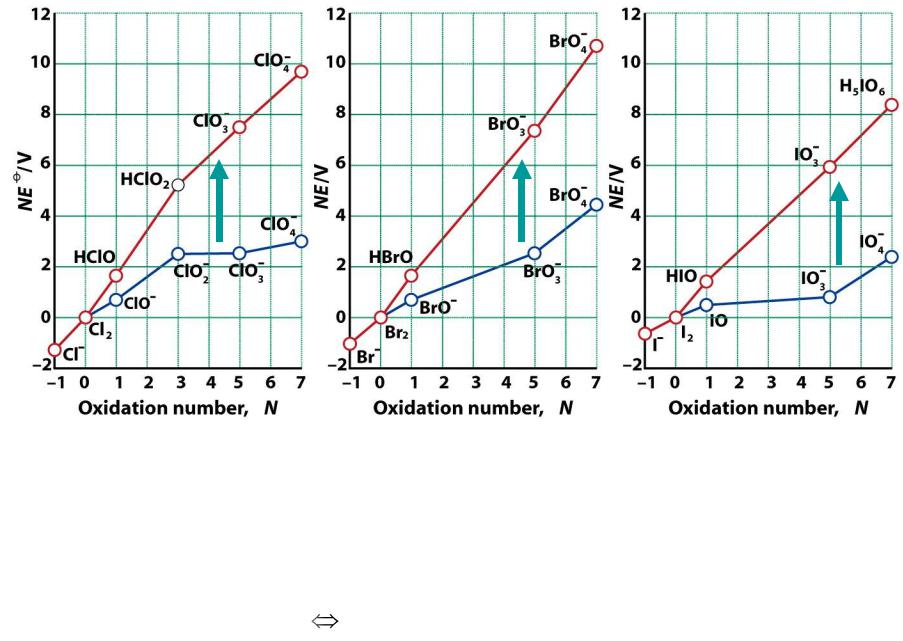
1. Все кислоты более сильные окислители, чем их соли
ClO |
- + 2H+ + 2e- = ClO |
- + H |
O |
pH=0, E0 = +1.20 B |
||
4 |
|
|
3 |
2 |
|
|
ClO |
- + H |
O + 2e- = ClO |
- + 2OH- |
pH=14, E0 = +0.37 B |
||
4 |
2 |
|
3 |
|
|
|
HClO4 + H2SO4 + 2FeSO4 = HClO3 + H2O + Fe2(SO4)3 |
||||||
2KClO4 + FeSO4 |
Fe(ClO4)2 + K2SO4 |
|
||||
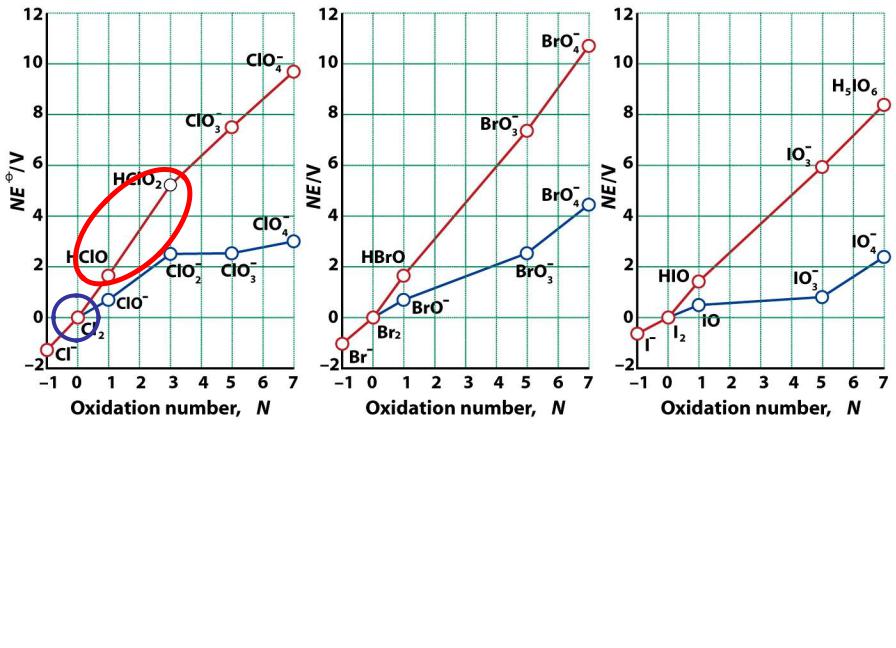
2.При pH=0 X+ и Cl3+ склонны к диспропорционированию при рН=14 диспропорционируют Х2
самая устойчивая с.о. +5
2HClO2 = HClO3 + HClO
3NaClO = NaClO |
3 |
+ 2NaCl |
(при 60 0С) |
|
|
|
