
Лекции / Лекции (Павлова) / L17
.doc
Л
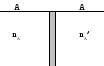
парадокс Гиббса
здесь N молей газа
– объем на 1 моль![]()
![]()
![]()
 екция
№17.
екция
№17.
N
для газа А![]()
![]()
 А
– число авагадро.
А
– число авагадро.
в процессе смешивания не будет изменения энтропии. nA=nA’=1
Неравновесный процесс переохлажденной жидкости.
М
∆Sнеобр
∆S2*(равн)
0oC(лед)
H2O(тв)
∆S1*
Sж(-10оС)
H2O(ж)
∆S2*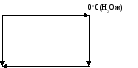
выделение тепла
Sтв(-10oC)
H2O(лед)
Теплота кристаллизации жидкой воды при tо=0оС составляет Qc=-79,9 кал/г. Для того чтобы подсчитать изменение температуры надо знать теплоемкость воды и льда: ср(ж)=1,0 кал/г*К; (считаем теплоемкость=const); ср(тв)=0,5 кал/г*К. очень большая разность теплоемкостей, т.к. вода имеет очень сложную природу (вода – ассоциированная жидкость).
![]() ∆S(искомая)=SH2O(тв,
263К)-SH2O(ж,263К)=∆S1+∆S2+∆S3
(рассчитываем не 1 моль; т.к. данные
удельные, умножаем на молекулярный вес
воды).
∆S(искомая)=SH2O(тв,
263К)-SH2O(ж,263К)=∆S1+∆S2+∆S3
(рассчитываем не 1 моль; т.к. данные
удельные, умножаем на молекулярный вес
воды).
(из большего беспорядка в больший порядок ↓ ∆S).
неравновесная кристаллизация от 0о
до (-10о)![]()
 Q=-74,6
кал/г.
Q=-74,6
кал/г.
п![]()
 оставляя
в ∆S,
мы оцениваем изменение энтропии
резервуара.
оставляя
в ∆S,
мы оцениваем изменение энтропии
резервуара.
берем с “+”, т.к. резервуар получает
тепло
∆Sобр=4,93.
Т.о. разница из-за обратимой и необратимой кристаллизации в изолированной системе:
∆Sсист=5,1-4,93=0,17 э.н.0,
т.е. энтропия возрастает при необратимом процессе.
Вывод:
Энтропия отличается от прочих параметров характеризующих систему (V,T,p), что в отличие от них энтропия или ее изменения не поддается непосредственному измерению, а может быть найдена только из вычислений. Вычисление может быть сделано только на основе равновесного, т.е. реального процесса.
Определение абсолютного значения энтропии.
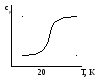
В отличие от внутренней энергии и энтальпии для энтропии можно определить абсолютное значение, но эта возможность появляется из постулатов планка (третье начало термодинамики). Опытные данные показывают, что теплоемкость вещества при Т=0оК падает до ничтожных величин, согласно закону де Бойля теплоемкость падает пропорционально Т3, () Результатом обобщения данных стала теорема Нернста (1906г):
Вблизи абсолютного нуля все процессы протекают без изменений энтропии или с ничтожно малыми изменениями.
Нернст T0 K ∆S0 или (∆S0).
В 1911 был сформулировал постулат: Энтропия совершенного кристалла при Т=0оК равна нулю. () ср/Т руко ↓, т.к. ср↓сТ быстрее, чем сама Т. это положение не относится стеклам, растворам, дефектным кристаллам, но и для этих веществ при Т=0оК, S – очень мало. Т.о. за начало отсчета S можно принять значение энтропии при температуре абсолютного нуля (Табс=0оК).
И это будет ST=OK=0 кал/моль*К.
 Для
вычисления абсолютного значения энтропии
надо знать теплоемкости, значения
которые должны быть определены до
возможно низких температур. Также
требуется знать фазовые переходы, если
вещество испытывает их при нагревании.
Для
вычисления абсолютного значения энтропии
надо знать теплоемкости, значения
которые должны быть определены до
возможно низких температур. Также
требуется знать фазовые переходы, если
вещество испытывает их при нагревании.
Экстраполяция (эмпирически или аналитически приближенно по аналогии).
Cp не
чувствит. к ∆Т –
О

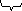
 бщее
управление для вычисления абсолютного
значения энтропии вещества.
бщее
управление для вычисления абсолютного
значения энтропии вещества.
Нагрев газообразной системы
Процесс кипения
Если в твердом состоянии вещество имеет более одной модификации, то надо сложить соответствующие члены в правую часть этого уравнения.
Пример: расчет теплоты элемента при Т=280оК и р=1 атм.
2) S104-S15=12,21(интегрир).
![]()
3) S160-S100=7,91э.е.(интегрир)
![]()
(Sиспарения)
4) S295-S189=6,12(интегрир).
Перевод идеального газа в идеальный газ: поправка к идеальному газу ()0,15 э.е.
В справочных таблицах приводятся величины стандартных энтропий веществ при р=1атм в составе идеального газа.
Энтропия вещества зависит от: из формул следует энтропия вещества сложным образом отражает всю совокупность свойств вещества в данном агрегатном состояние; она зависит от молекулярной массы вещества (для родственных веществ увеличивается с ростом молекулярной массы); зависит от агрегатного состояния (увеличивается от твердых к жидким, и от жидких к газообразным); от кристаллического состояния; изотопный состав; структуры молекулы.
Расчет изменения энтропии в результате химической реакции.
продукты
исходное
реакции вещество
Sj и
Si –
в справочниках.![]()
