
Лекции / Лекции (Павлова) / L14
.docЛекция №14.
W Matcad ThermoCalc
W Экслент
Matlab
Энтропия как критерий равновесия и направленности процесса (в изолированных системах).
∆S > 0 - необратимые процессы.
∆S = 0 – обратимый процесс, система близка к равновесному состоянию. На изолированную систему не действуют внешние силы и нет обмена массы, энергия постоянна U=const; V=const; n1=const … nk=const.

 1)
(S)U,V,Ni
= 0 Признаком того, что функция имеет
максимум; вторая производная отрицательная.
1)
(S)U,V,Ni
= 0 Признаком того, что функция имеет
максимум; вторая производная отрицательная.
2) (2S)U,V,Ni < 0
1 и 2 – условие равновесия.
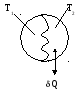
Q = 0 – адиабатический процесс.
![]()
Пусть T1 > T2
Посчитаем сумму приведенных теплот данной системы:
![]() ,
значит ∆S > 0.
,
значит ∆S > 0.
Сформулируем типы задач, в которых встречается изменение энтропии (2 типа):
-
Задачи, в которых требуется ответить на вопрос, возможен ли самопроизвольный процесс.
А) изолированная
Подсчитывают изменение энтропии как разность между энтропиями – начальных и конечных соединений. ∆S = Sкон – Sнач,
если ∆S > 0, то процесс возможен
∆S < 0, то процесс невозможен.
Б) неизолированная система представляется так: условие термической изоляции обеспечивает для …. системы, рассматривая ее с источником теплоты, т.е., таким образом, переходят к новой термически неизолированной системе.
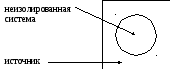
∆S = ∆Sсист + ∆Sист
Даже к результату применяют
общепринятые критерии.
-
Надо найти изменение энтропии в системе. Рассчитанная величина может оказаться положительной, отрицательной или равной нулю. Без условия изолированности системы энтропия как критерий направленности процесса не может быть использована.
Расчет изменения энтропии.
Вычисления изменения энтропии для любого процесса проводят так:
![]() ,
энтропия определяется на основе
информации о теплотах обратимых
процессов.
,
энтропия определяется на основе
информации о теплотах обратимых
процессов.
-
Адиабатические процессы.
Q = 0 ∆S = 0
Эти процессы (равновесные) можно назвать изоэнтропийные процессы.
-
Изотермические процессы.
Рассмотрим процессы фазового превращения веществ при равновесных условиях: плавление, испарение, разгонка веществ.
-
Для сохранения равновесности надо p=const.
![]() ,
где ф.п. – фазовый переход.
,
где ф.п. – фазовый переход.
Вычислить энтропию плавления бензола, если его температура плавления tпл = 5,5С, а удельная теплота плавления ∆mH = 29,92 кал/г.
∆S = S(ж) – S(тв) = 29,92 / 278,65 = 0,107 кал/г·K
Если надо узнать мольное значение, то надо умножить на молекулярный вес.
∆mS = 0,107 · 7,81 = 8,36 кал/моль·K
Вычислить энтропию кипения бензола, p = 1 атм, tкип = 80,1С, если теплота испарения ∆gH = 7,35 ккал/моль.
Размерность энтропии такая же, как и размерность теплоемкости Дж/моль·K или кал/моль·K (энтропийная единица – э.е.).
4,1868 Дж – теплотехническая калория
4,184 Дж – термохимическая калория
Оба процесса: и плавление, и испарение – переводят систему из состояния с числом больших частиц к системе с меньшими частицами. Предположить, что энтропию можно использовать как меру беспорядка творящегося в системе Sисп
Правило Трутона.
Для некоторых веществ в жидком и газообразном состоянии характерны сильные взаимодействия, которые приводят к образованию из атомов более сложных молекулярных форм называемых ассоциатами. Установлено, что для большого числа жидкостей, молекулы которых не образуют ассоциатов ни в жидкой, ни в паровой фазе, справедливо правило Трутона:
-
Энтропия испарения жидкости при нормальной температуре кипения составляет 21 – 22 э.е.
-
Для ассоциированной жидкости, например, H2O, энтропия испарения ∆VS больше энтропии испарения Трутона ∆VSТРУТОНА.
∆VS (H2O) 26 э.е.
-
Если вещество образует ассоциаты в паре, то для него энтропия испарения :
∆VS (CH3COOH) 15 э.е.
II. Изменение энтропии при обратимом термическом расширении идеального газа.
U не зависит от объема, а зависит от
температуры.
Q = ∆U + A
∆U = 0, т.к. T=const Q = A
Результат:
![]()
