
Лекции / Лекции (Павлова) / L10
.docЛекция 10.
Реакции в растворах и энтальпии образования растворенных веществ.
Запишем реакцию растворения хлористого водорода в 200 молях воды. Термохимическое уравнение хлористого водорода в воде запишется так:
HCl +200H2O(ж) =HCl (200 H2O)
∆rHo298= - 17,74 ккал
Рассчитаем эту теплоту используя закон Гесса, т.е. используя теплоты образования всех участников реакции:
∆rHo298 = ∆fHo298 (HCl в 200H2O) - ∆fHo(HCl, 298K) – (не пишем H2O)
∆fHo(HCl, 298K) = 22,06ккал
∆fHo298 (HCl в 200H2O) = -17,74 – 22,06 = -39,80 ккал
Оказалось, что в разбавленных растворах теплота нейтрализации сильных кислот сильными основаниями не зависит от природы кислоты и природы основания, что связано с природой ионизации сильных кислот, оснований, и при смешивании здесь происходит только одна химическая реакция – нейтрализация, т.е. ион гидроксила взаимодействует и с ионом водорода с образованием H2O(….)
OH- + H+ = H2O(….) – стандартный тепловой эффект для данной реакции.
∆fHo298 = -13,70 ккал
Исходя из этих данных можно определить суммарную теплоту образования ионов водорода и гидроксила.
H2O (Ж) = OH- (aq) + H+ (aq) – разложение жидкой воды.
∆Ho298 = 13,70 ккал
Запишем реакцию образования OH- и H+ из простых веществ:
H2 (Г) + ½O2 (Г) = H2O (Ж) проведем баланс

H2 (Г) + ½O2 = OH- (aq) + H+ (aq)
∆rHo298 = -68,31 ккал
В итоге: ∆rHo298 = -54,61 ккал
Энтальпию образования индивидуальных ионов H+ и OH- рассчитать невозможно, поэтому пользуются относительными энтальпиями образования ионов. Принимается, что стандартная теплота образования иона водорода = 0.
∆fHo(H+ (aq), 298) = 0
Тогда, используя тепловой эффект данной реакции, мы установим стандартную теплоту образования иона гидроксила:
∆fHo(OH+ (aq), 298К) = -54,61 ккал.
Используя эти величины и стандартные теплоты образования солей, щелочей в бесконечно разбавленных растворах, можно провести оценки энтальпии образования других ионов.
Следствия из законов Гесса:
1. Закон Луавазье – Лапласа:
Тепловой эффект разложения какого-либо химического соединения точно равен и противоположен по знаку тепловому эффекту его образования:
H2 + ½O2 = H2O(Г) ∆fHo298 = -241,82 кДж/моль
H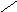 2O(Г)
= H2 + ½O2 ∆fHo298
= 241,82 кДж/моль
2O(Г)
= H2 + ½O2 ∆fHo298
= 241,82 кДж/моль
эндотермическая реакция
2. Если совершаются две реакции приводящие из различных начальных состояний к одинаковым конечным, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое.
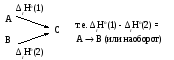
3. Если совершается две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница между их эффектами равна тепловому эффекту перехода из одного конечного состояния в другое.
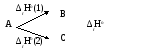
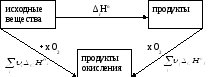
4. Тепловой эффект химической реакции равен разнице между суммой теплот образования конечных продуктов и суммой образования исходных веществ с учетом коэффициентов при формулах этих веществ в уравнениях реакции.
![]() 5.
Тепловой эффект реакции равен разности
между суммой теплот сгорания начальных
веществ и конечных продуктов с учетом
коэффициентов при формулах веществ в
уравнениях реакции.
5.
Тепловой эффект реакции равен разности
между суммой теплот сгорания начальных
веществ и конечных продуктов с учетом
коэффициентов при формулах веществ в
уравнениях реакции.
исходные продукты
Теплоемкость газов, твердых и жидких тел.
Теплоемкость – не экстенсивная величина. Рассматриваем теплоемкость, как сумму (V = const).
Cr = Cn + CB + Ck + CЭ
Сn – вклад в теплоемкость, связанный с поступательным движением молекул.
CB – вращательное
Сk – колебательное
CЭ – теплоемкость, связанная с электронными колебаниями молекул.
Переход электронов в молекуле на более высокие уровни энергии происходит при высоких температурах (более 2000К), поэтому СЭ обычно пренебрегают. Согласно молекулярно-кинетической теории газов теплоемкость, приходящаяся на одну степень свободы молекулы – число независимых видов энергии, на которое можно разложить сложное движение молекулы. Молекулы газа имеют три поступательных степени свободы, они соответствуют трем взаимно перпендикулярным направлениям по трем осям координат, поэтому вклад Cn = 3½R. Нелинейные трехатомные молекулы имеют еще три вращающихся степени свободы, вращательное движение молекулы вокруг оси произвольно направленной в пространстве так же может быть разложено по трем взаимно перпендикулярным направлениям, по трем осям. СВ = 3½R. Двухатомные и трехатомные линейные молекулы имеют только две степени свободы, т.к. момент инерции молекулы вокруг оси проходящей через центр атома ничтожно мал, и им можно пренебречь, поэтому для линейных, двухатомных и трехатомных СВ = R.
Сv = 3R + Cr двухатомные

…., обусловленный колебаниями, рассчитывается квантовой механикой, т.к. движение, связанное с колебаниями, не подчиняется закону равного распределения степени свободы, рассчитывается с помощью формулы Эйнштейна.
 Теплоемкость
твердых тел с атомной кристаллической
решеткой можно вычислить по уравнению
Дебая:
Теплоемкость
твердых тел с атомной кристаллической
решеткой можно вычислить по уравнению
Дебая:
- характерная температура Дебая, определяется по формуле:

Согласно теории Дебая атомы в кристаллической решетке могут колебаться с различными частотами, но для каждого вещества с атомной кристаллической решеткой имеется определенная характерная максимальная частота и соответствующая ей характерная температура Дебая.
Cd(x) – табулирована в специальных символах
R: Ag T = 173K = 214K
Cv - ? Cd(x) = Cd(214/173) = Cd(1,237) = 23,14 Дж/моль·К
Cv = 23,14 Дж/моль·К
Оценим температуру Дебая на основе экспериментальных данных с помощью эмпирической формулы Линдеманна:
(для вещества с одноатомной кристаллической решеткой)
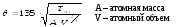
При возрастании температуры отношение к Т к BR, и функция Дебая как Сv принимает нулевое значение, соответствует классической теплоемкости твердых тел.
При низких температурах Т < /12, теплоемкость твердых тел подчиняется закону кубов Дебая:

C![]() p
(p=const)
можно производить перерасчет с Cv
на Cp
и наоборот в зависимости от того, что
измерено на опыте.
p
(p=const)
можно производить перерасчет с Cv
на Cp
и наоборот в зависимости от того, что
измерено на опыте.
Е сли
вещество имеет сложный химический
состав (сплав), теплоемкость оценивается,
используя правило аддетивности:
сли
вещество имеет сложный химический
состав (сплав), теплоемкость оценивается,
используя правило аддетивности:
В основе этого правила закономерность, установленная Дюлонгом Пти, согласно которой величина мольной теплоемкости Me = const 26кДж/моль·К, т.е. 3R.
При комнатной температуре теплоемкости многих твердых тел с атомной решеткой равны предельному значению 3R, у неметаллов теплоемкость значительно ниже, а предельное значение достигается при t >> tкомн.
Теплоемкость жидкостей.
Применяется для газов, для твердых тел и жидкостей. Эта формула для описания теплоемкости (апроксимационное уравнение):
Cp = a + bT + CT2 + dT3 + fT-2 + … - для газов (для газов три или четыре коэффициента)
Cp = a + bT + fT-2 - для твердых тел (уравнение Мастера-Келли)

использование
уравнения обеспечивает согласованность
данных
Для жидкостей Cp = const или Сp = a + bT.
Зависимость теплового эффекта реакции от температуры.
Формула Кирхгофа.
Из выражений (5) и (6) Л-9, что зависимость теплового эффекта реакции от температуры определяется тем, как изменяется с температурой внутренние энергии или энтальпии участников реакции, приращение энтальпии или внутренней энергии вещества при нагревании в условиях p=const или V=const можно определить, если известно температурная зависимость теплоемкости вещества.
![]()
