
- •Материалы для подготовки к вкр-2
- •Демонстрационный вариант (вариант №13)
- •Комментарии к решению задач №1 вкр-2
- •1) Переход от одного способа выражения концентрации раствора к другому.
- •2) Приготовления раствора данной концентрации путём разбавления более концентрированного раствора.
- •3) Химические реакции с участием растворов.
- •Комментарии к решению задач №2 вкр-2
- •Комментарии к решению задач №3 вкр-2
- •3) Внешнее воздействие состоит в изменении температуры.
- •Комментарии к решению задач №4 и №5 вкр-2
- •1) Количественные характеристики электролитической диссоциации: степень диссоциации, изотонический коэффициент Вант-Гоффа, константа диссоциации.
- •2) Связь концентрации ионов и общей концентрации растворённого вещества.
- •3) Водородный показатель (рН) растворов, ионное произведение воды, шкала рН.
- •4) Влияние растворённого вещества на температуры кристаллизации и кипения растворителя.
2) Приготовления раствора данной концентрации путём разбавления более концентрированного раствора.
Приготовление раствора из исходного, более концентрированного раствора, заключается в смешивании некоторого количества исходного раствора с водой. При этом растворённое вещество переходит из исходного раствора в конечный, и, соответственно, масса, число моль, число грамм‑эквивалентов растворённого вещества в конечном и исходном растворе одинаковы.
Уточним, что разбавление раствора в несколько раз означает, что объём раствора увеличивается в эти несколько раз за счет добавления воды.
Молярная концентрация и нормальность раствора, соответственно равные отношению числа моль и числа грамм-эквивалентов растворённого вещества к объёму раствора:
![]() ;
;
![]()
− при увеличении V в несколько раз уменьшаются в то же число раз. Это часто используют на практике: готовят, например, один концентрированный раствор известной молярной концентрации, разбавлением которого получают серию растворов различных концентраций.
Отметим, что такое изменение при разбавлении раствора в несколько раз не относится к массовой доле раствора w, что обусловлено изменением плотности раствора.
Рассмотрим примеры решения задач.
а) Децимолярный раствор серной кислоты разбавили в 5 раз. Определите молярную концентрацию и нормальность полученного раствора.
Молярная концентрация исходного раствора 0,1 моль/л, после разбавления она уменьшилась в 5 раз и для конечного раствора стала равной 0,02 моль/л. Нормальность раствора серной кислоты в 2 раза выше молярной концентрации и равна 0,04 г-экв/л.
б) Определим, какой объём 0,6 М раствора азотной кислоты можно приготовить из 100 мл 6 М раствора.
Эту задачу можно решить очень просто, если заметить, что молярная концентрация уменьшается в 10 раз. Значит, раствор надо в 10 раз разбавить, т.е. увеличить его объём в 10 раз. Значит, к 100 мл раствора нужно добавить воды так, чтобы довести объём до 1000 мл (добавить 900 мл воды). Получаем, что можно приготовить 1000 мл 0,6 М раствора.
Более строгое решение состоит в том, что число моль HNO3 в конечном и исходном растворе одинаково. Как следует из определения молярной концентрации, число моль равно произведению cV. Можно записать, что
c1V1 = c2V2,
где индексы 1 и 2 относятся, соответственно, к исходному и конечному раствору. Выражаем из этой формулы объём конечного раствора и вычисляем его:
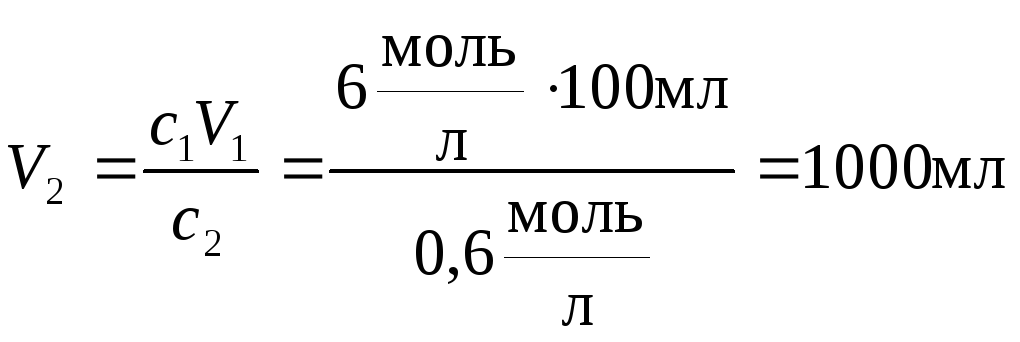 .
.
в) Рассчитайте, сколько миллилитров воды нужно добавить к 100 мл 60%-ного раствора азотной кислоты, имеющего плотность 1,37 г/см3, чтобы получить 6%-ный раствор.
Масса азотной кислоты в исходном и конечном растворе одинакова.
Вычислим массу исходного раствора m1:
![]()
![]() .
.
Учитывая, что в 137 г исходного раствора содержится 60 % HNO3, найдем массу азотной кислоты:
![]() .
.
Отношение массы азотной кислоты к массе конечного раствора m2 равно массовой доле HNO3 в конечном растворе, или:
![]() .
.
Отсюда найдём массу конечного раствора:
![]() .
.
Масса конечного раствора складывается из массы исходного раствора и массы добавленной воды
![]() ,
,
Откуда находим
![]() .
.
Поскольку плотность воды 1 г/мл, объём воды в миллилитрах численно равен массе в граммах. Получаем, что к 100 мл исходного раствора азотной кислоты требуется добавить 1233мл воды.
Примечание к задаче «в»
Как видно из условия задачи, с помощью разбавления требуется уменьшить массовую долю HNO3 в 10 раз.
Объём полученного раствора V2 = 1233 мл + 100 мл =1333 мл, что больше объёма исходного раствора (V1 =100мл) примерно в 13,3 раза.
Как уже упоминалось, это связано с уменьшением плотности раствора при его разбавлении. Плотность 60%-ного раствора 1,37 г/см3, а плотность 6%-ного раствора равна 1,03 г/см3(последнее значение в условии задачи не приводится).
Можно показать, что, в отличие от массовой доли, при разбавлении в 13,3 раза молярная концентрация уменьшается в то же число раз. Зная массовую долю HNO3 и плотность раствора, можно вычислить молярную концентрацию (см. пункт 1). Проверьте самостоятельно, что молярная концентрация исходного раствора равна 13,05 моль/л, а конечного − 0,981 моль/л, что как раз в 13,3 раза меньше.
