
- •Материалы для подготовки к вкр-2
- •Демонстрационный вариант (вариант №13)
- •Комментарии к решению задач №1 вкр-2
- •1) Переход от одного способа выражения концентрации раствора к другому.
- •2) Приготовления раствора данной концентрации путём разбавления более концентрированного раствора.
- •3) Химические реакции с участием растворов.
- •Комментарии к решению задач №2 вкр-2
- •Комментарии к решению задач №3 вкр-2
- •3) Внешнее воздействие состоит в изменении температуры.
- •Комментарии к решению задач №4 и №5 вкр-2
- •1) Количественные характеристики электролитической диссоциации: степень диссоциации, изотонический коэффициент Вант-Гоффа, константа диссоциации.
- •2) Связь концентрации ионов и общей концентрации растворённого вещества.
- •3) Водородный показатель (рН) растворов, ионное произведение воды, шкала рН.
- •4) Влияние растворённого вещества на температуры кристаллизации и кипения растворителя.
Материалы для подготовки к вкр-2
Демонстрационный вариант (вариант №13)…………..1
Комментарии к решению задач №1………………………2
Комментарии к решению задач №2………………………8
Комментарии к решению задач №3……………………....13
Комментарии к решению задач №4 и №5……………….17
ВКР-2
Демонстрационный вариант (вариант №13)
1. Рассчитайте, сколько миллилитров воды нужно добавить к 50 мл 30%-ного раствора азотной кислоты, имеющего плотность 1,18 г/см3, чтобы получить 5%-ный раствор.
Ответ: 295 мл.
2. Определите численное значение константы равновесия реакции
N2(г) + 3H2(г) D 2NH3(г),
если начальные концентрации азота и водорода равны 0,3 и 0,8 моль/л, а к моменту равновесия прореагировало 20 % азота.
Ответ: 0,252.
3. Определите, как повлияет на равновесие в системе:
С(т) + СО2(г) Û 2СО(г) , DH = 174 кДж,
понижение: а) температуры; б) давления. Ответ обоснуйте.
Ответ: а) равновесие сместится влево;
б) равновесие сместится вправо.
4. Раствор, содержащий 0,1 моль вещества в 5 кг воды, кипит при 100,015°C. Является ли данное вещество электролитом?
Ответ: а) да; i = 1,44.
5. Вычислите степень диссоциации одноосновной кислоты, если значение рН децимолярного раствора этой кислоты равно 4.
Ответ: а) 10−3 (0,1 %).
Комментарии к решению задач №1 вкр-2
Для решения задач требуется:
− знать способы выражения концентрации растворов;
− уметь проводить расчет по уравнению реакции и применять закон эквивалентов.
Предлагаемые задачи можно разбить на три основных типа:
Переход от одного способа выражения концентрации раствора к другому.
Приготовления раствора данной концентрации путём разбавления более концентрированного раствора.
Химические реакции с участием растворов.
Заметим предварительно, что для молярной концентрации и нормальности часто используются приставки деци-, санти- и милли- , знакомые нам по названиям дециметра, сантиметра и миллиметра. Так сантимолярный раствор − это 0,01 М раствор.
1) Переход от одного способа выражения концентрации раствора к другому.
Часто требуется перейти к нормальности раствора N, если известна молярная концентрация c, или, напротив, найти c из N. Приняв во внимание, что c − число моль, а N − число грамм-эквивалентов растворённого вещества в одном литре раствора, легко получить соотношение между численными значениями N = zc. Здесь z − то небольшое целое число, на которое мы при вычислении эквивалента кислоты, основания или соли делим молекулярную массу. Следовательно, N ≥ c. Так, для 0,3 н. растворов H3PO4, NaOH и ZnSO4 молярная концентрация соответственно равна 0,1; 0,3 и 0,15 моль/л.
Для перехода от молярной концентрации или нормальности к массовой доле w (или для обратного перехода) нужно проводить вычисления и знать плотность раствора. При решении таких задач (так же, как и многих других задач по реме «Растворы») лучше не искать готовые формулы, а решать «пошагово», опираясь на определения концентраций. Учитывая приведенные выше определения c и N, удобно сделать расчет для одного литра раствора.
Разберём конкретный пример.
Вычислим молярную концентрацию 35%-ного раствора бромида кальция, если плотность раствора 1,38 г/см3.
Требуется вычислить c, т.е. найти число моль CaBr2, содержащееся в 1 л раствора. Поэтому возьмём 1 л раствора и вычислим его массу:
![]() .
.
Масса CaBr2 в 1 л раствора составляет 35 % от массы раствора. Найдем её:
![]() .
.
Теперь найдём число моль CaBr2 в 1 л раствора:
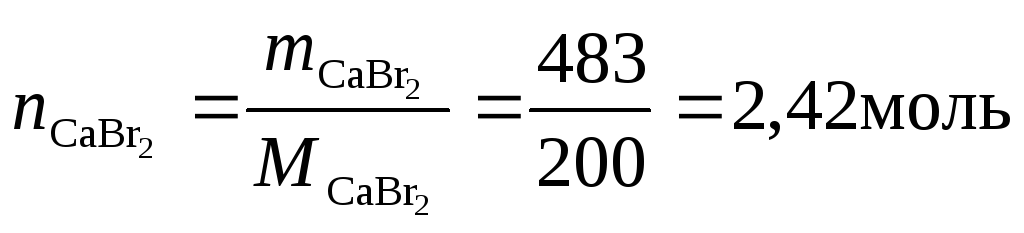 .
.
А это и есть молярная концентрация c = 2,42 моль/л.
В некоторых задачах требуется определить молярную концентрацию по приведённым в условии данным, которые не относятся к общепринятым способам выражения концентрации.
Найдем молярную концентрацию фторида калия, если в 200 мл раствора содержится 5,8 г этой соли.
Вспомним, опять же, что нам нужно узнать число моль KF в одном литре, или в 1000 мл раствора. Поэтому, прежде всего, составим пропорцию:
в 200 мл раствора − 5,8 г KF
в 1000 мл » − x г KF
Находим: x = 29 г.
Затем, как и предыдущей задаче, найдём число моль растворённого вещества в 1 л и молярную концентрацию:
![]() ;
c
= 0,5 моль/л.
;
c
= 0,5 моль/л.
