
З-н объёмных отношений Гей-Люссака: при неизменных р и Т объемы взаимодействующих газов относятся между собой и к объёмам получающихся газообразных продуктов реакции как небольшие целые числа.
З-н кратных отношений Дальтона: если 2 эл-та образуют между собой несколько различных соединений, то кол-во одного из них относится к кол-ву другого как небольшие целые числа.
Закон эквивалентов Рихтера: массы реагирующих веществ строго пропорциональны их эквивалентам.
Модели строения атомов:
-
Модель Нагаоки. Вокруг положительно заряженного ядра как по трубочкам движутся отрицательно заряженные е.
-
Модель Морозова. Атом – кристалл, в ц-ре к-рого ядро, а по узлам решетки закрепленные е.
-
Модель Томпсона (пудинг, кекс)
-
Планетарная модель строения атома Резерфорда. В ц-ре большое тяжелое ядро. Не учтена теория электромагнитного поля.
-
Теория Н. Бора.
Условия для 1 постулата Бора:
А) Масса ядра
настолько больше массы е, что ядро можно
считать неподвижным![]()
Б) радиус вращения е можно считать постоянным
В) центробежная
сила, развиваемая е, равна силе притяжения
его ядром.
![]()
Г)энергия равна сумме потенциальной и кинетической.
Спектры:
1. серия Лаймана, 2. Серия Бальмера, 3. Пашена, 4. Бреккета, 5. Пфунда, 6. Хампфри.
Соль бария цвет пламени желто-зеленый, стронция – малиново-алый, меди – пурпурно-зеленый, натрия – оранжевый.
Ур-е де Бройля
![]()
Квантовые числа.
-
n главное. Определяет № энергетического уровня; интервал энергий на этом уровне; размеры орбиталей; в период. Системе соответствует № периода. KLMNOPR
-
l орбитальное. Опр. Момент кол-ва движения е, точное значение его энергии и форму орбиталей. 0…(n-1) spdfg
-
ml магнитное. Хар-зует ориентацию орбитали в пространстве (проекция орбитального момента на направление поля) –l…0…l
-
ms спиновое. Характеризует собственный вращательный момент е.
Принцип Паули. В атоме не м.б. 2 е в одинаковых квантовых состояниях. Правило Гунда. В пределах одного подуровня е располагаются по орбиталям т.о., чтобы их суммарный спин был максимальным (макс. Число неспаренных е).
Периодические свойства. 1) атомные радиусы растут по группе сверху вниз, а по периоду неск. Уменьшаются за счёт сжатия
2) энергия ионизации – необходимая для отрыва е от невозбужденного атома – по периоду возрастает, по группе неск. Уменьшается.
3)сродство к е – энергия для присоединения е к атому – по периоду увелич., по группе тоже.
4)ОЭО – способность атомов притягивать или отрывать е – по периоду возрастает, по группе убывает сверху вниз.
Теория химического строения Бутлерова 1861
-
атомы в молекуле соединяются друг с другом в определенном порядке
-
соединение атомов происходит в соответствии с их валентностью
-
Свойства вещества зависят не только от природы атомов и их числа, но и от их расположения, т.е. от химического строения молекул.
Параметры хим. Связи:
-
длина связи
-
валентный угол
-
энергия связи
-
кратность связи – число электронных пар
-
ОЭО
Льюисовская конфигурация –отображение валентных электронов с помощью точек.
МВС – метод, показывающий связь в молекуле, осуществляющуюся за счет электронных пар (Лаймус Полинг).
Параметры ковалентной связи:
а) кратность связи
б) насыщенность обусловлена ограниченными валентными возможностями атомов, т.е. из способностью к образованию строго определённого числа связей
в) направленность согласно магнитному квантовому числу. Виды: линейная HCl, угловая H2S, пирамидальная PH3(треугольная) sp2 120гр., тетраэдрическая 109гр. 28 мин. для sp3 гибридизации – смешения облаков, NH3 одно пузатое облако 107 гр., H2O два пузатых облака без гибридизации103-105 гр., sp3d тригональная бипирамидальная 90 и 120 гр., sp2d плоская квадратная, sp3d2 октаэдрическая.
Г) полярность.
ММО. Каждую МО представляют в виде ЛКАО. При сложении АО образуется МО, Е к-рой понижается относительно АО. Такая орбиталь – связывающая. При этом электронная плотность концентрируется между ядрами, и волн. Ф-ция принимает положительные значения. При вычитании АО Е МО увеличивается и орбиталь называется разрыхляющей. Эл. Плотность распределяется за ядрами. Правила:
-
е в молекуле, как и в атоме, занимают соответствующие орбиталь, к-рые характеризуются своим набором квант. Чисел.
-
Число образующихся МО равно число АО, участвующих в их образовании.
-
Распределение е по МО подчиняется всем правилам квант. Чисел.
-
Образ-е молекулы изображаем с помощью энергетич. Диаграмм АО и МО.
-
В гетероядерных молекулах связ. Орбитали по Е ближе к орбиталям более электроотриц. атома, а разр. – менее электроотрицательного.
-
Кратность хим. связи равна полуразности числа е на связ. И на разр.
Теории кислот и оснований
1)Аррениуса. Рассматривает кислоты как водородосодержащие соединения, образующие при диссоциации в водных растворах водородные ионы, а основания как соединения, диссоциирующие с образованием гидроксид-ионов.
2)Протонная (протолитическая) Бренстеда и Лоури. Кислотой называют любую водородосодержащую частицу, способную при взаимодействии с растворителем отщеплять протон, быть донором протона; а основанием – любую частицу, способную присоединять протон, быть его акцептором.
HCl =H+ + Cl-
Кислота протон основание
Протолиз
3) 1924 Дж. Льюиса. Кислота – акцептор электронной пары, имеющий подходящую вакантную орбиталь, а основание – донор, имеющий неподеленную пару электронов.
H+ + :NH3 = NH4+
Кислота основание
Как сдвинуть равновесие при гидролизе:
1) повышение температуры способствует гидролизу и смещает равновесие вправо
2)разбавление тоже способствует гидролизу
3)добавление одноименных ионов водорода подавляет гидролиз по катиону, а гидроксоинов – по аниону.
Коллоидные системы – такие дисперсные системы, в к-рых частицы дисперсной фазы состоят из сотен, а иногда тысяч элементарных частиц, в следствие чего возникает поверхность раздела между растворителем (дисперсная среда) и частицей (Дисперсная фаза). Для дисперсных систем а от 1 до 1000 мкм., D от 10-7 до 10-5см.
Классификация коллоидных систем:
1) по агрегатному состоянию дисперсной фазы и дисперсной среды
|
Дисперсная система |
Агрегатное состояние |
Примеры |
|
|
Дисп. фаза |
Дисп. среда |
||
|
аэрозоль |
Жидк. |
Газ. |
туман, облака |
|
аэрозоль |
Тверд. |
Газ. |
Пыль, дым |
|
пена |
Газ. |
Жидкая |
Взбитые сливки, белки |
|
Эмульсия |
Жидкая |
Жидкая |
Майонез, молоко |
|
Золь |
Тверд. |
Жидкая |
краски |
|
Твердая эмульсия |
Жидкая |
Твердая |
Масло сливочное |
|
Гель |
Жидкая |
Твердая |
Желе, агар-агар, желатин |
2) По степени дисперсности D
а) D=10-7см почти истинный раствор высокомолекулярное соединение гемоглобин
б)промежуточные дисперсные системы. D=10-7 – 10-5 см взвеси, дым, пыль
в)Микрогетерогенные системы D=10-5 см и до 10-1 см крупные частицы.
3) по степени взаимодействия на поверхности дисперсной системы
а) необратимые коллоидные растворы (лиофобные) в к-рых дисперсная фаза сама не растворяется в дисперсной среде
б) обратимые коллоидные растворы (лиофильные) в к-рых дисп.фаза молекулярно взаимодействует в молекулами, ионами дисп.среды.
в)лиофобно-лиофильные (двоякие) амфотерные растворы, в зависимости от смещения равновесия.
Золи – растворы с высокой степенью дисперсности, обычно водные.
Гели – коллоидные системы, образовавшиеся из золей в результате потери ими устойчивости (коагуляции). Гель – однородная система, в к-рой частицы связаны друг с другом за счет за счёт молекулярных сил и образуют пространственные сетки с пустотами, равномерно распределенными по всему объему, в к-рых находится жидкая дисперсная фаза.
Получение коллоидных растворов.
1) метод диспергирования – раздробление грубых частиц вещества на более мелкие, вплоть до коллоидных размеров. Растворение более крупных частиц – пептизация.
2) Метод конденсации – агрегация молекул или ионов в более крупные частицы (основан на коагуляции – образовании более крупных частиц)
Устойчивость дисперсных систем характеризуется постоянством их свойств, в первую очередь это степень дисперсности D, распределением по объёму частиц дисперсной фазы. Понятие устойчивости связано в основном с коагуляцией.
Седиментация – осаждение частиц при помощи коагулянтов или коагуляции.
Виды устойчивости:
1) седиментационная – способность дисперсной среды сохранять равномерное распределение частиц дисперсной фазы по объёму – устойчивость к разделению фаз при агрегации
2)агрегативная – способность системы сохранять частицы дисперсной фазы в дисперсной среде без их укрупнения.
ОВР
|
Важнейшие |
|
|
окислители |
восстановители |
|
1)неметаллы 2)катионы металлов и водорода, переходящие в нейтральное состояние 3)сложные вещества, где в составе находится атом с наивысшей степенью окисления +7 для марганца, +6 для хлора 4)все кислоты, особенно конц. |
1)все свободные металлы 2)некоторые неметаллы В, С, переходящие в состояние с положительной ст. окисления 3)сложные вещества, где в составе находится атом с наименьшей ст. окисления азот -3, сера -2 4)все органические соединения |
Основные типы ОВР
1)Внутримолекулярные, в к-рых изменение степени окисления атомов происходит в одной и той же молекуле
(NH4)2Cr2O7 =t N2 + Cr2O3 + 4H2O
2)реакции диспропорционирования (дисмутации) – функции окислителя и восстановителя выполняют атомы одного и того же элемента в его промежуточной степени окисления, находящиеся как в составе одной молекулы, так и одного и того же иона
Cl2 + 2KOH =t KCl + KClO + H20
3) реакции контрпропорционирования – внутримолекулярные ОВР, в ходе к-рых происходит выравнивание степени окисления одного и того же элемента
(NH4)NO3 =t N2O + 2H2O
4)межмолекулярные ОВР. Происходят с изменением степени окисления атомов в разных соединениях
2HNO2 + H2S = 2NO + S + 2H2O
|
pH<7 |
MnO4- фиолетовый |
Mn2+ бесцветный |
|
pH=7 |
MnO2 коричневый |
|
|
pH>7 |
MnO42- зеленый |
Анодные процессы
выделение кислорода
pH>=7 A+ 4OH- O2 + 2H2O + 4e
pH<7 2H2O O2 + 4H+ +4e
1) восстановители, у которых 0<1,229, все металлы, которые могут растворяться. +A: Me0Me Z+ +ze. 0,401<0<1,229 в зависимости от pH (14)
2) 0>1,229. S2+, галогены -, H2O, OH-. Процессы с водой и окисление других восстановителей.
При замыкании цепи смещение равновесия на аноде – в область более положительных значений, на катоде – в область более отрицательных значений
Поляризация – явление, характеризующее изменение потенциала от равновесия (сдвиг)
Величина, к-рая характеризует изменение потенциала – перенапряжение ню,
фи = фи0 ню, +анодная область, -катодная область.
Причины перенапряжения:
Ню = ню дифф. +ню разряда + ню хим. стадии
1) связана с трудностями подвода частиц к поверхности электрода, напр. Вязкий раствор, + мешают примеси
2) связана с трудностью прохождения е через межфазную границу в связи с наличием неровностей в поверхности и встраиванием в кристаллическую решетку
3) образование оксидов или солей у анода (чаще всего связано с Al)
Осмотическое
давление раствора
![]()
Зная его,
![]() Давление пара над раствором нелетучего
вещества в растворителе (р) ниже давления
пара над чистым растворителем (р0) при
той же Т.
Давление пара над раствором нелетучего
вещества в растворителе (р) ниже давления
пара над чистым растворителем (р0) при
той же Т.
По закону Рауля,
![]() ,
где Хв –мольная доля рв.
,
где Хв –мольная доля рв.
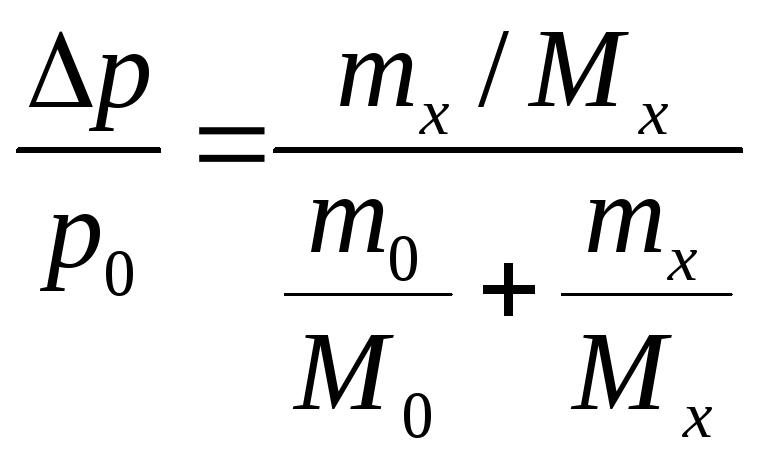 Где
M0
молярная масса растворителя, Мх молярная
масса рв.
Где
M0
молярная масса растворителя, Мх молярная
масса рв.
Формула Томсона E=окислителя-восстановителя. В электролизе а-к.
Кинетика Электролиза.
Стадии:
1) подвод частиц к поверхности, диффузия
2) разрядка частиц, связанная с принятием/отдачей е
3) отвод продуктов реакции
Все эти стадии могут определяться как лимитирующие.
Плотность анодного
тока i
![]() А/с функция силы тока
А/с функция силы тока
Применение электролиза:
1) в хим. Пром-ти ( производство хлора из НаХл и соды – НаОАш – едкий натр. Хлор для ядов, каучука и т.д.)
2) в металлургии – получение химически чистых свободных металлов – электрометаллургия, Эл-з водных растворов – гидроэлектрометаллургия
Эл-з расплавов и их солей - пироэлектрометаллургия
3)в технике, гальваноплоастика нанесение покрытия металлов, гальваностегия меньшее покрытие, Эл. Хим. Обработка металлов, Эл. Хим. Заточка, шлифование, спец. Обработка поверхностей.
4) сварка, для получения чистых О2 и Аш2
С нерастворимым
анодом![]()

С растворимым
анодом
![]()
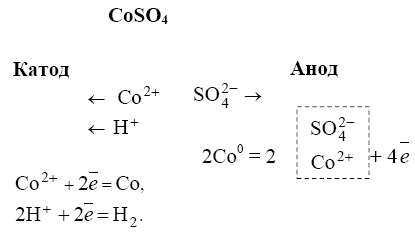
|
h=6,626*10-34 Дж/с e=1,6*10-19 Кл m=9,1*10-31 1 Кал=4,184 Дж 1 атм. = 101,3 КПа=101325 Па NA=6,022*1023 |
R=8,31 Дж/град*моль K=1,38*10-23 Больцмана |
Электродными или потенциал определяющими процессами называются хим. превращения, происходящие на электродах с участием заряженных частиц, в ходе которых осуществляется перенос частиц через границу раздела двух фаз.
1 з-н Фарадея. Масса итого вещества, претерпевшего электрохим. превращение на каждом из электродов, прямо пропорциональна количеству прошедшего через систему электричества. mi~qi
2 з-н Фарадея. Массы веществ, претерпевших при прохождении через различные системы электрохим. превращения, пропорциональны их массам хим. эквивалентов.
![]() по закону Фарадея
по закону Фарадея
![]()
Механизм возникновения ДЭС на межфазной границе металл-электролит.
1)подвод частиц электролита и адсорбция
2)диполь-ионное взаимодействие , к-рое сопровождается выделением энергии гидратации. Ионы Zn, окруженные молекулами воды, попадают в раствор, металл окисляется.
3)на поверхности электролита образуется избыток электронов и отрицательная обкладка, положительные ионы Zn2+ из раствора притягиваются к отрицательной обкладке, сверху на поверхности металла образуется положительная обкладка, возникает ДЭС.
4)некоторые ионы цинка принимают электроны, превращаются в атомы и встраиваются в кристаллическую решётку, т.е. процесс идет до установления равновесия.
Между металлом и раствором возникает разность потенциалов – электродный потенциал фи Нернста.
Пси – потенциал Гельмгольца – когда протекает скачок потенциала в ДЭС
А если скачок потенциала в диффузионной фазе, то это электрокинетический потенциал . =+
Чем меньше значение потенциала, тем более сильными восстановительными свойствами обладает металл. Если энергия гидратации больше энергии кристаллической решетки, то решетка разрушаться не будет, а будет достраиваться за счет адсорбции ионов металла из раствора. Будет создаваться положительная обкладка, а сверху отрицательная. Так происходит, когда фи больше 0, напр. у меди.
Электроды первого рода:
1)металлический электрод. Металл в растворе собственных ионов.
2) редокси электрод – электродная ОВР. Состоит из электродного проводника (Ме), к-рый находится в контакте с раствором, к-рый содержит и окислители, и восстановители.
3)водородный электрод – эталонный.
Электроды второго рода состоят из металла, покрытого слоем его труднорастворимой соли (или оксида, у Al), погруженного в раствор, содержащий анионы, одноименные с анионами его труднорастворимой соли (хлорсеребряный электрод, напр.).
Электроды третьего рода (относится хингидронный электрод) такой же, как водородный, только Pt опущена в раствор хингидрона
Электроды 4 рода – ионно-обменные электроды (ионно-селективные электроды, мембранные; обязательно есть мембрана)
Классификация ГЭ
1)по обратимости. ГЭ обратимый, если состоит из двух обратимых электродов
2)по наличию или отсутствию жидкостного соединения между растворами двух электродов (с переносом/без переноса). Соляной мостик, насыщенный раствор соли – тогда с переносом
3)по характеру процесса, лежащего в основе ГЭ:
- концентрационные состоят из двух одинаковых электродов (отличаются заряды ионов в растворе). Водородный – платина, переносчик – ион H+
- Химические: элемент Даниэля-Якоби.
4) по типу соединения электродов внешней цепи (ГЭ правильно разомкнутые – отличаются материалы электродов, напр. Zn и Cu соединены серебряной проволокой)
5 )по
принципу действия – ХИТы
)по
принципу действия – ХИТы
Сухие ГЭ (батарейки)
Аноды обычно Zn, Mg, Li, Na
Катоды (токопроводящие среды) MnO2, CuO, Ag2O, PbCl2.
1-анод –цинковый стаканчик, 2- Mn, 3 – Электролит, 4-стержень, графитовый электрод. 2, 3, 4 –Катод
1 2 3 4
Аккумулятор
При разряде: ГЭ.
-А. (Pb) PbPb+ +e
+К. (PbO2) PbO2+4H++2ePb2++2H2O
При разряде – Электролизёр
-К (Pb) PbSO4 + 2e Pbтв + SO4р2-
+А (PbO2) PbSO4г + 2H2Oг PbO2т +SO4р2- + 4H+р +2e
Щелочные аккумуляторы Ni-Cd, Ni-Fe;
Электролиз – ОВ процессы, протекающие при прохождении электрического тока, подаваемого от внешнего источника тока, проходящего через раствор или расплав электролита.
Процессы:
1)электролиз, сопровождающийся хим. разложением электролита;
2) Электролиз, сопровождающийся хим. разложением растворителя;
3) Электролиз раствора солей ряда металлов с растворимыми анодами.
На катоде восстанавливаются в первую очередь окисленные формы ОВ систем с наибольшим положительным электродным потенциалом
На аноде окисляются в первую очередь восстановленные формы с наименьшим отрицательным электродным потенциалом.
Катодные процессы
Восстановление молекулы воды:
pH>=7. -K 2H2O + 2e H2 _ 2OH-
pH<7 -K 2H+ +2e H2
1) >0 Cu2+, Ag+, Hg2+, Au3+, o2, I2, Br2, Cl2 все галогены, PbO2, MnO4-, Cr2O72-
K: Me z+ +ze Me0, Оф +zeВф
2) <-1,7. Активные металлы Li+, Na+, K+, Ba2+
С водой. Между 2) и 3) Al3+
3) остальные все, все реакции
Сравнение ММО и МВС
-
С помощью них объясняется распределение электр. плотности в соединениях.
-
В ММО показано как образуется МО при перекрывании АО, причем прочность связи растет с увеличением эл. плотности между ядрами.
-
В обоих методах вводятся понятия о споривании спинов электронов.
-
Оба метода приближенны
-
В обоих методах могут образовываться сигма, пи и дельта связи
-
В МВС валентность атома определяется числом эл. пар. В ММО Число связей определяется как полуразность между числами связ. и разр. эл-нов.
Комплексные соединения. Анионные: K+4[Fe(CN)6]-4 гексоцианоферрат (II) калия
Катионные [Zn(NH3)2Cl]+Cl- хлоридхлордиамин цинка.
Нейтральные [Ni(CO)4]0 тетракарбонил никеля.
