
- •Домашние задания
- •Домашнее задание № 1. «Химическая кинетика» Элементы теории
- •Содержание домашнего задания №1
- •Вопросы для самоконтроля
- •Домашнее задание № 2. «Химическая термодинамика» Элементы теории
- •Содержание домашнего задания №2
- •Вопросы для самоконтроля
- •Домашнее задание № 3 - «Физико-химические расчеты по термодинамике фазовых равновесий
- •Часть I. Однокомпонентные системы. Расчет теплоты испарения вещества и определение его температуры кипения по данным о давлении насыщенного пара при различных температурах. Элементы теории
- •Содержание части 1 домашнего задания №3
- •Часть 2. Двухкомпонентные системы. Определение состава жидкопаровой смеси, температур начала и конца кипения жидкой смеси данного состава. Содержание части 2домашнего задания №3
- •Элементы теории
- •Вопросы для самоконтроля
- •Библиографический список
- •Содержание
Домашнее задание № 1. «Химическая кинетика» Элементы теории
Химические реакции, протекающие в одну стадию, называются простыми. Такие реакции различают по молекулярности
Молекулярность реакции определяется числом частиц, принимающих участие в элементарном акте химического взаимодействия.
Молекулярность может быть равна 1, 2 или 3, соответственно, различают моно- би- и тримолекулярные реакции. Для простых реакций молекулярность совпадает с порядком реакции, а порядки по компонентам совпадают с наименьшими целочисленными стехиометрическими коэффициентами в левой части химического уравнения. Фактически, если известна молекулярность реакции, то понятен и ее истинный механизм, для установления которого проводят серьезные исследования.
Рассмотрим кинетику простых реакций 1, 2 и 3-го порядков.
Реакции первого порядка: A L+ M
Порядок реакции (n) равен 1. Пусть концентрация вещества А (СА) равна С, тогда скорость реакции (w=-dС/dt) в соответствии с законом действующих масс равна
-dС/dt = kС.
Латинская буква d здесь и далее обозначает знак дифференциала, то есть бесконечно малого изменения величины. Разделим переменные: -dС/С=kdt, проинтегрируем:-lnС = kt + const, определим константу интегрирования, учитывая, что в начальный момент времени: t = 0, С = С0, отсюда const = -lnС0. В итоге получаем: lnС – lnС0 =- kt,
ln(С/С0) = - kt, С = С0 e-kt . (1.1, 1.2)
Уравнения (1.1) и (1.2) называются кинетическими уравнениями реакции первого порядка в логарифмической (1.1) и экспоненциальной (1.2) форме.
Важной кинетической характеристикой процесса является время полупревращения (1/2), то есть время, в течение которого прореагировала половина взятого вещества.
Определим эту величину для реакции первого порядка: С = 1/2С0, ln(С0/С) = ln2/k1/2,
1/2 = ln2/k = 0,69/k. (1.3)
Время полупревращения в этом случае не зависит от начальной концентрации исходного вещества.
Размерность константы скорости для реакций первого порядка: [k] = [с]-1.
Реакции второго порядка: А + В L.
Порядок реакции равен 2. Пусть СA = СB = С. Тогда -dС/dt = kС2, -dС/С2 = kdt. После интегрирования и с учетом начальных условий (t = 0, С = С0) получаем:
1/С – 1/С0= kt. (1.4)
Время полупревращения для реакций второго порядка обратно пропорционально начальной концентрации:
1/2 = 1/(kС0). (1.5)
Размерность константы скорости: [k] = [л/(моль с)].
Реакции третьего порядка: А + В + D L.
Величина n равна 3. Пусть СA = СB = СD = С, тогда -dС/dt = kС3, -dС/С3 = kdt. После интегрирования, учитывая начальные условия (t = 0, С = С0), получаем:
1/С2 – 1/С02= 2kt. (1.6)
Время полупревращения для реакций третьего порядка обратно пропорционально квадрату начальной концентрации:
1/2 = 3/(2kС02). (1.7)
Размерность константы скорости: [k] = [л2/(моль2 с)].
В представленных кинетических уравнениях под символом «С» понимают текущую, то есть наблюдаемую в данный момент времени молярную концентрацию соответствующих исходных веществ (С = Cт.). Существует также понятие прореагировавшей концентрации (Cпр), характеризующее ту часть концентрации данного исходного вещества, которая превратилась в конечный продукт. Прореагировавшая концентрация связана с текущей и исходной (C0) соотношением:
С0 = Cт + Cпр (1.8).
В расчетах по уравнениям (1.1-1.7) нужно знать величину константы скорости реакции (k). Эту характеристику можно найти с помощью уравнения Аррениуса, если известны предэкспоненциальный множитель (k0), энергия активации (Е) и температура (Т):
k = k0e-E/RT (1.9)
Значение константы скорости можно также определить графическим способом. Так, уравнения (1.1), (1.4) и (1.6) представляют собой прямолинейную зависимость соответствующих функций концентраций от времени: при n = 1 линейно от времени зависит lnC, при n = 2 – 1/С, при n = 3 – 1/С2 (рис. 1, 2, 3). На этой закономерности основан графический метод определения порядка реакции, позволяющий также определить и значение k.
Пусть n = 1 или 2. Тангенс угла наклона (α) соответствующей прямой к оси Х (ось времени) равен константе скорости (рис 1.1, 1.2) - tgα = k. При n = 3 удвоенная константа скорости равна тангенсу угла (α) наклона прямой (рис. 1.3) - 2 tgα = k. Не представляет затруднений нахождение времени полупревращения из этих графиков.
ln(C0/2)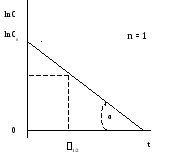
Рис. 1.1
1/2
½
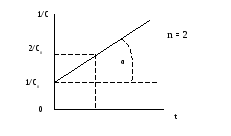
Рис. 1.2
t
Рис. 1.3
В присутствии катализатора скорость химической реакции возрастает, что связано с изменением механизма реакции, приводящего к снижению энергии активации процесса. При катализе катализатор и реагирующее вещество образуют промежуточное соединение, которое в результате дальнейших преобразований превращается в конечный продукт, высвобождая катализатор. Энергетические затраты таких процессов ниже, чем в отсутствии катализатора. Каталитические реакции являются сложными, так как протекают в несколько стадий. Скорость процесса определяется скоростью самой медленной стадии катализа.
Величиной, определяющей ускорение реакции в при катализе, является соотношение констант скоростей реакций в присутствии (kк) и отсутствии (k) катализатора: kк/ k. Это значение можно рассчитать, если известна величина снижения энергии активации ∆Е. В расчетах будем полагать, что рассматриваемая реакция является односторонней, то есть необратимо протекает слева направо в соответствии с уравнением реакции.
Пусть ЕК = (Е - Е) – энергия активации прямой реакции в присутствии катализатора, Е – то же, но без катализатора. Тогда константа скорости прямой реакции в присутствии катализатора - kK = k0 exp[-(E - E)/RT], без катализатора - k1 = k0 exp(-E/RT).
Ускорение при катализе равно:
kK/ k = exp (E)/RT). (1.10)
