
происхождение биомембран
.docОБЩАЯ БИОЛОГИЯ
Л.В. ЯКОВЕНКО
Происхождение биологических мембран
Бислойные липидные мембраны – непременный атрибут любой клетки. Вопрос о том, как и когда появились мембраны у клеток, непосредственно связан с вопросом о происхождении клеток, а следовательно, и жизни.
Проблемы возникновения (сотворения) мира и его эволюции всегда интересовали людей. По этому поводу написано множество статей и книг, но бесспорно принятого ответа на вопрос о том, как возник окружающий нас мир – Вселенная, Солнечная система, Земля и жизнь на ней – и что ждет его в будущем, в них нет и, учитывая современный уровень знаний, вряд ли он скоро появится. Тем не менее на некоторые вопросы, в частности касающиеся отдельных стадий происхождения жизни на Земле, уже сейчас можно дать более или менее правдоподобные ответы.
Решение проблемы происхождения жизни тесно связано с ответом на вопросы о том, какова природа жизни и насколько распространена жизнь во Вселенной. При этом, прежде всего, надо решить, что можно называть жизнью.
По-видимому, жизнь должна быть основана на соединениях углерода и основные ее процессы должны протекать в водной среде. Другие формы жизни нам неизвестны. По выражению Ф.Крика, мы изучаем жизнь такой, как мы ее знаем, а не такой, какой она могла бы быть.
Одним из важнейших атрибутов живой системы является ее способность к самовоспроизведению, которая у современных организмов связана с размножением. Основой самовоспроизведения является матричный синтез белков и нуклеиновых кислот.
Первые живые клетки
В современном мире биомолекулы синтезируются в клетках в ходе разнообразных биохимических реакций, как правило, катализируемых ферментами, которые сами образуются в ходе таких же реакций. Как же появились первые биомолекулы во времена, когда клеток и матричного синтеза еще не было? На этот вопрос отвечает теория абиогенеза – образования биологически важных органических соединений в ходе природных физико-химических процессов.
В конце XVIII – начале XIX в. Ж.Сенебье (1742–1809) и Н.Т. де Соссюр (1767–1845) с помощью тонких экспериментов установили, что, говоря современным языком, растения синтезируют углеводы из углекислоты и воды за счет энергии света. Это было, по-видимому, первым доказательством возможности образования органических соединений из неорганических, правда, с участием растений, а не абиогенно.
Возник вопрос, нельзя ли синтезировать органические соединения без участия растений? В 1828 г. Ф.Вёлер (1800–1882) дал ответ на этот вопрос, синтезировав мочевину из циановокислого калия. Эти эксперименты побудили ученых к поиску путей синтеза органических соединений из неорганических без участия живых организмов. В 1861 г. А.М. Бутлеров (1828–1886), обработав формальдегид известковой водой, получил соединение, имевшее сладкий вкус, названное им метиленитаном и идентифицированное позже Э.Г. Фишером (1852–1919) как формоза (-акроза) – углевод, не поддерживающий брожения. А настоящий виноградный сахар впервые синтезировал из углекислого газа и воды в 1890 г. тот же Э.Г. Фишер, и он же позже установил, что белки состоят из аминокислот.
Опубликованная в 1924 г. книга А.И. Опарина (1894–1980) «Возникновение жизни на Земле» отражала интерес ученых к проблеме происхождения жизни и привлекла к ней внимание широкой общественности. Кроме того, она стимулировала экспериментальные исследования в области абиогенного синтеза. Так, в 1920–1930-х гг. сотрудникам академика А.Н. Баха (1857–1946) удалось показать, что в реакциях формальдегида с цианидом могут образовываться аминокислоты, которые затем конденсируются с образованием олиго- и полипептидов. Но особенно успешными были серии экспериментов, проведенные в начале 1950-х гг. С.Л. Миллером (р. 1930), бывшим тогда аспирантом известного ученого Г.К. Юри (1893–1981, Нобелевская премия 1934 г. за открытие дейтерия).
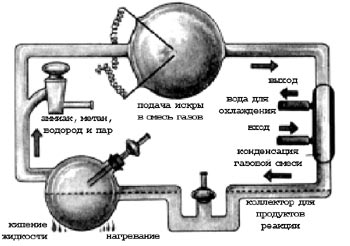
Стэнли Миллер использовал подобный аппарат для
воссоздания условий, характерных для первозданной Земли
В первых экспериментах Миллера при продолжавшемся несколько дней коронном электрическом разряде в смеси газов NH3, Н2, CH4 и насыщенного водяного пара образовывались аминокислоты и некоторые другие органические соединения, характерные для современных организмов. Подобные эксперименты были затем проведены в разных лабораториях. При вариациях химического состава смеси (добавлении HCN, формальдегида, H2S и т.д.) и замене электрического разряда на ультрафиолет или тепловое воздействие удалось получить не только аминокислоты, но и некоторые нуклеиновые основания, порфирины, сахара, компоненты липидов.
К настоящему времени практически все основные биологически важные органические соединения были получены в лабораторных экспериментах, моделирующих условия, существовавшие около 4 млрд лет назад в различных местах на Земле. Далее мы кратко перечислим наиболее вероятные условия на поверхности Земли в то время.
По современным данным, вода начала конденсироваться на поверхности Земли около 4 млрд лет назад. В это время образовывались и исчезали так называемые дарвиновские лужи – водоемы с горячей водой, насыщенной минеральными соединениями. Поверхность Земли подвергалась интенсивной бомбардировке метеоритами, которая завершилась около 3,8 млрд лет назад. Атмосфера имела восстановительный характер, свободного кислорода в ней практически не было.
Возникает вопрос: в каких количествах образовывались органические соединения в природных условиях? В лабораторных экспериментах по абиогенному синтезу биологически важных молекул концентрации исходных веществ должны были быть довольно высокими. В настоящее время по данным NASA (США) за год происходит около 1,2 млрд грозовых разрядов. В период формирования гидросферы на Земле интенсивность гроз была выше, что создавало необходимые условия для абиогенного синтеза органических соединений.
Помимо синтеза за счет электрических разрядов на Земле были и другие источники органических соединений. Довольно много разнообразных органических соединений, в том числе аминокислот и нуклеиновых оснований, обнаруживается в составе некоторых метеоритов. Поэтому, если и не жизненные формы, то по крайней мере органику метеориты могли принести на Землю. Однако есть и гораздо более мощный источник органики.
Аминокислоты, пуриновые и пиримидиновые основания, порфирины, различные углеводороды и производные этих соединений, содержащие кислород, азот, серу, фосфор, в огромных количествах – до 108 кг за одно извержение – выбрасываются вулканами. По оценкам В.И. Вернадского, суммарная масса живых организмов на Земле составляет примерно 1017 кг. Следовательно, в результате 109 извержений на поверхность Земли выбрасывается количество органических соединений, достаточное для формирования всей биомассы планеты. Сейчас на Земле около 1 тыс. действующих вулканов. Если бы каждый вулкан извергался один раз в год, на накопление необходимой массы органики ушло бы около 1 млн лет. В далеком прошлом вулканов было на порядки больше, да и извержения происходили гораздо чаще, чем сейчас, поэтому можно считать, что уже в самом начале геологической эволюции Земли разнообразных органических соединений на ней было достаточно для протекания химической эволюции, приведшей к появлению живых систем.
Все современные организмы построены из клеток – дискретных единиц живого. Клетки отделены от окружающей среды границей, имеющей более или менее сложное строение. Уже у одного из самых простых микроорганизмов – микоплазмы, имеющей всего около 500 генов, – эта граница представляет собой бислойную липидную мембрану со встроенными и прикрепленными к ней белками. Обычные бактерии устроены сложнее, у них помимо мембраны есть еще и клеточная стенка, выполняющая дополнительные функции. Поскольку клеточная мембрана есть у всех клеток, ее образование в ходе эволюции представляет собой необходимую стадию формирования предшественников клетки.
По палеонтологическим данным, первые прокариоты, образовывавшие строматолиты – биогенные слоистые породы, представляющие собой окаменевшие сообщества цианобактерий, – появились примерно 3,5 млрд лет назад. Однако, по данным изотопного анализа углерода, первые автотрофы появились раньше – около 3,8 млрд лет назад. Возможно, это были бесклеточные формы жизни, поскольку никаких следов клеток, относящихся к тому периоду, пока не обнаружено.
Обычно считается, что для случайного образования клетки не хватило бы времени существования Вселенной. Однако, по некоторым оценкам, прокариоты могли появиться из «первичного бульона» – растворов абиогенно синтезированных органических соединений – за время, не превышающее 10 млн лет. В любом случае, первые клеточные формы жизни сформировались из неклеточных форм не более, чем за 300 млн лет – очень короткий срок по геологическим меркам.
Когда же, где и в результате каких естественных процессов могла появиться жизнь на Земле?
Хорошо известны классические исследования и публикации А.И. Опарина, Дж.Б.С. Холдейна, Дж.Д. Бернала, С.Фокса и их последователей, посвященные моделям происхождения предшественников клеток, или протоклеток. В оригинальных работах этих и других авторов специально подчеркивается, что коацерваты Опарина, протеиноиды Фокса, маригранулы Эгами и т.д. в определенных условиях покрываются оболочкой, напоминающей клеточную мембрану.
Хотя образование упомянутых структур происходит в неравновесных условиях, сами они представляют собой равновесные системы. Этим они коренным образом отличаются от живых клеток, которые находятся в состоянии устойчивого неравновесия, постоянного обмена веществом с окружающей средой. Скорее всего, предшественники клеток образовались в условиях, исходно обеспечивших их неравновесность, которая затем закрепилась в ходе эволюции.
Помимо обмена веществ, неравновесность клеток характеризуется двумя важнейшими асимметриями в распределении веществ между клетками и внеклеточной средой. Речь идет о распределении ионов щелочных и щелочно-земельных металлов в так называемой хиральной чистоте биологических систем.
В цитоплазме живых клеток концентрация ионов калия выше концентрации ионов натрия в 10–30 раз, а в окружающей среде (морской воде или межклеточной жидкости) соотношение концентраций этих ионов обратное. Такое распределение ионов приводит к возникновению разности электрических потенциалов на мембране, иначе называемой трансмембранным потенциалом.
На поддержание ионной асимметрии клетка тратит до одной трети своих энергетических ресурсов. Это означает, что ионная асимметрия и соответствующий ей трансмембранный потенциал имеют большое значение в жизни клетки. Постоянство химического состава внутренней среды клетки, в частности концентраций ионов, обеспечивает оптимальные условия для процессов метаболизма в ней, т.е. адекватную скорость его осуществления в конкретных условиях. Взаимная зависимость между концентрациями ионов и трансмембранным потенциалом с одной стороны и метаболизмом – с другой приводит к тому, что трансмембранный потенциал играет важную роль в регуляции всех процессов жизнедеятельности клетки.
По-видимому, ионная асимметрия между клеткой и средой уже на самых ранних стадиях добиологической эволюции обеспечивала существенное эволюционное преимущество протоклеткам, обладавшим ею. За счет ионной асимметрии создавался запас свободной энергии, необходимый для осуществления энергоемких внутриклеточных процессов. Кроме того, она могла играть и информационную, сигнальную, роль, поскольку нарушение целостности мембраны протоклетки сразу обнаруживалось по возникавшим при этом ионным токам.
Ионы натрия и калия были использованы для создания такой асимметричной ионной системы по той простой причине, что это самые распространенные ионы морской воды и поэтому их концентрации могут быть достаточно высокими, чтобы обеспечить необходимую мощность источника свободной энергии. Кроме того, перераспределение ионов натрия и калия между клеткой и средой не приводит к дополнительным осмотическим нагрузкам на клетку при сохранении постоянной их суммарной концентрации.
Для клетки диаметром 6 мкм, плавающей в морской воде, имеющей трансмембранную разность потенциалов 60 мВ и внутриклеточные концентрации одновалентных ионов такие же, как в аксоне кальмара, энергетическая стоимость ионной асимметрии составляет примерно 6·10–13 Дж. По-видимому, это значение энергии должно быть характерным для процессов, приведших когда-то к образованию протоклетки.
Помимо ионной асимметрии для живых систем характерна еще одна фундаментальная асимметрия, так называемая хиральная. Молекулы многих органических соединений симметричны. Среди различных видов симметрии зеркальная симметрия занимает особое место в биологии. Зеркально симметричные молекулы являются стереоизомерами хирального (от греч. heir – рука) соединения, или его энантиомерами. В зависимости от расположения четырех разных заместителей у какого-либо атома углерода, называемого также хиральным, энантиомеры относятся к L- или D-типу (от лат. laevo – левый, dextro – правый) (рис.1). В одной молекуле может быть несколько хиральных атомов углерода, однако тип аминокислоты определяется хиральностью ее a-углеродного атома.
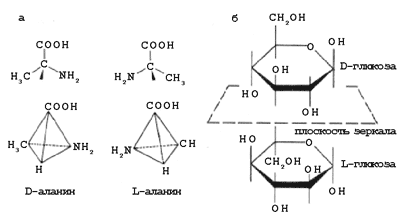
Рисунок 1. Стереоизомеры хиральных органических соединений (номенклатура Э.Фишера): а – L- и D-аминокислоты, б – L- и D-глюкоза
Энантиомеры обладают оптической активностью, т.е. вращают плоскость поляризации света влево или вправо, хотя направление вращения не всегда соответствует названию изомера. По другим физико-химическим параметрам энантиомеры не различаются и в обычных химических реакциях образуются в равных количествах, составляя так называемую рацемическую смесь.
Суть хиральной асимметрии состоит в том, что в клетках для рибосомального* синтеза белков используются только L-аминокислоты, а в состав нуклеиновых кислот входят только D-сахара. Таким образом, белки и нуклеиновые кислоты являются гомохиральными полимерами, т.е. состоят из звеньев одной и той же хиральности. Это явление получило название хиральная чистота биосферы. Хотя в клетках и встречаются энантиомеры аминокислот и сахаров другой хиральности, но не в составе белков, ДНК и РНК.
Биологический смысл хиральной чистоты биосферы понятен: гомохиральность белков и нуклеиновых кислот обусловливает стабильность их структур, обеспечивающих выполнение специфических функций: для гетерохиральных молекул невозможен матричный синтез – один из основных признаков живых систем. Кроме того, для биохимических преобразований гомохиральных белков и нуклеиновых кислот требуется гораздо меньше ферментов и, соответственно, гораздо более простой аппарат биосинтеза, чем для преобразований гетерохиральных соединений, выполняющих такие же функции. Поэтому, даже если гиперциклы или другие предбиологические автокаталитические системы были гетерохиральными, они должны были быть вытеснены гомохиральными системами со сходными функциями.
Однако механизмы возникновения гомохиральности и выбора ее типа (L или D) до последнего времени оставались совершенно неясными. Лишь в последние годы появились теоретические и экспериментальные данные, позволяющие сделать предположения о том, как могла бы сформироваться хиральная чистота биосферы.
Поддержание хиральной чистоты невозможно без затрат энергии. Расчеты для средней клетки, описанной выше при оценке энергетической стоимости ионной асимметрии, показывают, что энергетическая стоимость ее хиральной чистоты составляет около 7х10–13 Дж. Удивительно, что две основные асимметрии, характерные для живых систем, стоят с энергетической точки зрения практически одинаково. Это наводит на мысль о том, что в ходе добиологической эволюции они возникли в результате процессов одной природы и в одном и том же месте. Где же могло быть это место и какие именно процессы привели к возникновению этих асимметрий?
Вероятным кандидатом на роль реактора, в котором появились протоклетки, в какой-то мере обладающие указанными асимметриями, является неравновесная поверхность океана. Это обусловлено следующими ее уникальными свойствами.
Поверхность Земли получает от Солнца световой энергии в среднем немного более 10 мВт/см2. Эта энергия поглощается в верхних слоях океана толщиной в десятки метров, а излучается обратно из слоя толщиной в доли миллиметра. Это связано с тем, что поглощается свет во всем диапазоне солнечного спектра, а излучается в инфракрасной (тепловой) области. Поскольку вода хорошо поглощает инфракрасный свет, он может излучаться только из самого тонкого верхнего слоя океана. Такое излучение приводит к тому, что верхний слой океана остывает – это так называемое радиационное охлаждение.
Существенный вклад в баланс энергии океана и атмосферы вносит испарение воды, которое также происходит только с поверхности и приводит к ее охлаждению. В результате на поверхности океана образуется тонкая холодная пленка.
Эта пленка очень устойчива и при разрушении может восстанавливаться за доли секунды. Перепад температуры в ней на первый взгляд невелик – 0,5–3,0 К. Но если учесть, что этот перепад приходится на слой толщиной около 0,5 мм, то средний градиент температуры будет не менее 1000 К/м, а в самом верхнем слое он может быть значительно выше.
В тонком поверхностном слое концентрация солей выше, чем в воде на глубине, поскольку соли не испаряются вместе с водой. Разные ионы имеют разные коэффициенты диффузии, поэтому в неравновесном поверхностном слое океана соотношение их концентраций может отличаться от соотношения концентраций на глубине – оно должно зависеть от скорости испарения воды и от скорости диффузии иона.
Неравномерность распределения ионов между поверхностным и глубинным (более 0,5 м) слоями характеризуют коэффициентом фракционирования:
![]()
, где
[Ks], [Nas] – молярные концентрации ионов калия и натрия в поверхностном слое морской воды; [Kb], [Nab] – молярные концентрации ионов калия и натрия в объемной фазе морской воды.
Такой же коэффициент фракционирования можно использовать для описания асимметрии распределения ионов между клеткой и окружающей средой, но тогда индексы s и b относятся к внутри- и внеклеточной средам соответственно. Для большинства клеток коэффициент разделения ионов калия и натрия находится в интервале 50–100.
В таблице приведены максимальные коэффициенты фракционирования в поверхностных слоях различных морей, измеренные в естественных условиях. Величина коэффициента фракционирования в каждом случае зависит от конкретных условий (температур воды и воздуха, влажности воздуха, скорости ветра) и характеризуется значительными колебаниями в течение суток. При высокой влажности холодная пленка практически отсутствует (Белое море) и фракционирование незначительно, при сухом воздухе (Каспийское море) испарение интенсивно и фракционирование максимально.
Таблица.
Коэффициент фракционирования
![]() () ионов в поверхностном слое толщиной
0,05 мм в разных морях
() ионов в поверхностном слое толщиной
0,05 мм в разных морях
Море
Белое
![]() 2,5
2,5
Черное
![]() 7,0
7,0
Каспийское
![]() 9,8
9,8
Японское ![]() 2,4
2,4
Воспроизведение наблюдений в лабораторных условиях показало, что неравновесное распределение ионов в тонком поверхностном слое раствора сопровождается возникновением в нем разности электрических потенциалов около 5 мВ. Существенно, что в отсутствие испарения ни фракционирования ионов, ни разности потенциалов не возникало.
Особенностью этих экспериментов является то, что полученные значения коэффициентов фракционирования значительно превосходят теоретические предсказания: все модели дают его значения на порядок меньше наблюдаемых. По-видимому, существуют какие-то еще не учтенные факторы, приводящие к наблюдаемым результатам.
Около 50 лет назад Р.Дж. Голдэйкр обратил внимание на то, что частицы морских аэрозолей, образующихся при разрушении волн, лопании воздушных пузырьков у поверхности воды и т.п. имеют размеры, характерные для клеток. Он предположил, что морские аэрозоли могли играть какую-то роль в процессах предбиологической эволюции. Однако имевшихся тогда данных было недостаточно, чтобы это предположение обосновать.
Механизм формирования аэрозоля при разрушении воздушного пузырька у поверхности раствора довольно сложен. Он включает в себя образование капель двух типов: реактивных – больших и тяжелых, выбрасываемых со дна пузырька ударной волной, и пленочных – меньших размеров, формируемых из тонкой поверхностной пленки, разрываемой пузырьком. Реактивные капли обычно довольно быстро падают обратно на поверхность океана, а пленочные легко уносятся воздушными потоками и участвуют затем в формировании облаков. Стадии образования аэрозоля схематически изображены на рис. 2.
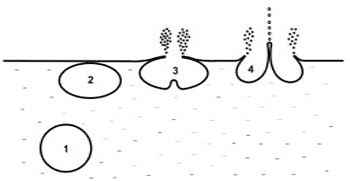
Рис 2. Стадии формирования аэрозоля при разрушении воздушного пузырька на поверхности водоема: 1 – всплывающий пузырек; 2 – пузырек у поверхности воды; 3 – разрыв поверхностной пленки с образованием мелких пленочных капель; 4 – образование крупных реактивных капель за счет ударной волны, распространяющейся по поверхности пузырька при его разрушении
Эксперименты показали, что солевой состав пленочных капель соответствует солевому составу тонкого поверхностного слоя океана в том месте, где они образовались, а коэффициент фракционирования ионов обычно выше, чем в поверхностном слое. Это означает, что аэрозоль содержит относительно больше ионов калия, чем морская вода, и меньше натрия (облака с наибольшим содержанием калия формируются над Красным морем).
Размеры этих капель – от 1 до 10 мкм – вполне соответствуют ожидаемым размерам предшественников клетки. Подхваченные воздушными потоками пленочные капли могут находиться в атмосфере до трех лет и за это время побывать в разных климатических зонах – от полярных до экваториальных.
Амфифильные соединения (имеющие одновременно полярные и неполярные радикалы), к которым относятся и фосфолипиды клеточных мембран, обладают поверхностной активностью, т.е. концентрируются на границе раздела океан–атмосфера. Это приводит к тому, что и поверхность аэрозольных капель оказывается покрытой монослоем амфифила. По мере испарения воды монослой конденсируется, становится плотным и затрудняет дальнейшее усыхание капли.
Длительное путешествие аэрозольной капли в верхних слоях атмосферы создает благоприятные условия для синтеза некоторых органических соединений, в частности жирных кислот.
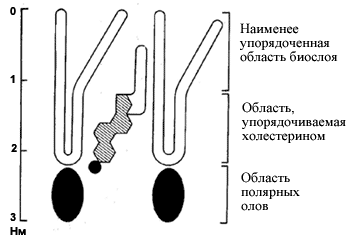
Схема формирования фосфолипидного слоя
При падении аэрозольной частицы обратно на поверхность воды она быстро набирает второй слой молекул амфифила, например фосфолипида, и оказывается покрытой уже бислойной мембраной, что было показано экспериментально. Поскольку молекулы второго слоя обращены наружу своими полярными участками, такая везикула легко погружается в воду. Отдельные стадии описанного процесса показаны на рис. 3.
Рис. 3. Схематическое изображение стадий формирования бислойной липидной везикулы из аэрозольной капли, покрытой слоем амфифила (фосфолипида)
Недавно теоретически и экспериментально было показано, что поверхностно-активные соединения могут приводить к потере устойчивости аэрозольной капли. При этом от нее отпочковывается капля меньшего размера, которая захватывает часть содержимого материнской капли. Дочерняя капля имеет размеры, характерные для вирусных частиц.
Таким образом, существует естественный процесс, который приводит к формированию относительно стабильных везикул, покрытых бислойной (липидной) мембраной, имеющих клеточные размеры и солевой состав, инвертированный по одновалентным катионам по отношению к морской воде. Одно это выдвигает такие везикулы в число кандидатов на роль предшественников клеток.
Но оказалось, что неравновесный поверхностный слой водного раствора обладает еще одним удивительным свойством, экспериментально обнаруженным в лабораторных условиях: аэрозольные капли, полученные из растворов рацемических смесей аминокислот, были обогащены L-энантиомером соответствующей аминокислоты по сравнению с ее D-энантиомером. Преобладание одного из энантиомеров в смеси характеризуют коэффициентом хиральной асимметрии:
![]()
(в квадратных скобках – концентрации соответствующих энантиомеров).
В экспериментах с растворами валина,
лейцина и глутамина были получены
значения
![]() в диапазоне от 0 до 0,05, причем фракционирование
энантиомеров зависело от степени
неравновесности поверхностного слоя
и исчезало в равновесных условиях.
в диапазоне от 0 до 0,05, причем фракционирование
энантиомеров зависело от степени
неравновесности поверхностного слоя
и исчезало в равновесных условиях.
Позже эти данные были подтверждены в сходных экспериментах методом ЯМР, правда, фракционирование энантиомеров было менее выражено. В последнее время был разработан новый метод определения фракционирования энантиомеров хиральных соединений, основанный на особенностях отражения мощного лазерного излучения (т.н. генерация второй оптической гармоники) от поверхности раствора. Предварительные эксперименты с использованием этого метода также подтверждают наличие фракционирования энантиомеров аминокислот и сахаров на неравновесной границе раздела раствор–воздух.
