
- •Физика атома, атомного ядра и элементарных частиц
- •Энергия связи атомов в молекуле
- •При соединении двух атомов в молекулу возможны два предельных типа связи:
- •Второй тип связи: Один или несколько внешних электронов одного атома перехо- дят к
- •Между этими предельными типами сущес- твует множество промежуточных вариан- тов распределения зарядов, когда
- •Метод линейной комбинации атомных орбиталей (ЛКАО)
- •Иллюстрация метода ЛКАО на примере иона молекулы водорода
- •Энергия иона молекулы водорода
- •Ионная связь
- •Пример ионной связи
- •Энергия молекулы хлористого калия

Физика атома, атомного ядра и элементарных
ядра и элементарных  частиц
частиц
23 (0). Физика молекулы. Ковалентная и ионная связь.

Энергия связи атомов в молекуле
Энергия диссоциации молекул имеет поря-  док нескольких электронвольт (экспери- ментальный факт). Это означает, что в образовании молекулы участвуют лишь внешние, слабо связанные электроны, а
док нескольких электронвольт (экспери- ментальный факт). Это означает, что в образовании молекулы участвуют лишь внешние, слабо связанные электроны, а  состояние внутренних электронов (их
состояние внутренних электронов (их  энергия связи имеет порядок сотен и тысяч эВ) практически не изменяется.
энергия связи имеет порядок сотен и тысяч эВ) практически не изменяется.

При соединении двух атомов в молекулу возможны два предельных типа связи:
 Первый тип связи: Одна или несколько пар
Первый тип связи: Одна или несколько пар  электронов (по одному от атома) из незапол- ненных внешних оболочек становятся общими для обоих атомов, причем спины этих электро- нов становятся антипараллельными друг другу. Такие электроны наз. спаренными. При этом оказывается, что вероятность нахождения
электронов (по одному от атома) из незапол- ненных внешних оболочек становятся общими для обоих атомов, причем спины этих электро- нов становятся антипараллельными друг другу. Такие электроны наз. спаренными. При этом оказывается, что вероятность нахождения  спаренных электронов между атомами больше,
спаренных электронов между атомами больше, чем снаружи. Между атомами возникает облако отрицательного заряда; это и создает силу при- тяжения. Такая связь наз. ковалентной. Примеры: молекулы H2, O2, N2 и др.
чем снаружи. Между атомами возникает облако отрицательного заряда; это и создает силу при- тяжения. Такая связь наз. ковалентной. Примеры: молекулы H2, O2, N2 и др.

 Второй тип связи: Один или несколько внешних электронов одного атома перехо- дят к другому атому и достраивают его не- заполненную электронную оболочку. Об- разовавшиеся ионы разноименных знаков притягиваются друг к другу электростати- ческими силами и связываются в молеку- лу. Такая связь наз. ионной. Примеры -
Второй тип связи: Один или несколько внешних электронов одного атома перехо- дят к другому атому и достраивают его не- заполненную электронную оболочку. Об- разовавшиеся ионы разноименных знаков притягиваются друг к другу электростати- ческими силами и связываются в молеку- лу. Такая связь наз. ионной. Примеры -  соли щелочных металлов, образованные
соли щелочных металлов, образованные  при соединении с галогенами: KCl, NaCl, KBr и др.
при соединении с галогенами: KCl, NaCl, KBr и др.

 Между этими предельными типами сущес- твует множество промежуточных вариан- тов распределения зарядов, когда элект- роны одного атома с большей вероятнос- тью находятся вблизи одного атома, чем другого. С этой точки зрения можно ион- ную связь рассматривать как предельный случай, когда вероятность нахождения
Между этими предельными типами сущес- твует множество промежуточных вариан- тов распределения зарядов, когда элект- роны одного атома с большей вероятнос- тью находятся вблизи одного атома, чем другого. С этой точки зрения можно ион- ную связь рассматривать как предельный случай, когда вероятность нахождения  электрона около атома галогена 100%, а
электрона около атома галогена 100%, а  около атома щелочного металла - 0%. Ковалентная связь - другой предельный случай, когда вероятности равны 50%.
около атома щелочного металла - 0%. Ковалентная связь - другой предельный случай, когда вероятности равны 50%.

Метод линейной комбинации атомных орбиталей (ЛКАО)
 Состояние электрона в молекуле описыва- ется волновой функцией, которую можно приближенно определить путем сложения атомных волновых функций. В квантовой химии волновую функцию электрона при- нято называть орбиталью, отсюда - на-
Состояние электрона в молекуле описыва- ется волновой функцией, которую можно приближенно определить путем сложения атомных волновых функций. В квантовой химии волновую функцию электрона при- нято называть орбиталью, отсюда - на-  звание метода ЛКАО. Рассмотрим этот ме- тод на простейшем примере - ионе моле- кулы водорода.
звание метода ЛКАО. Рассмотрим этот ме- тод на простейшем примере - ионе моле- кулы водорода. 
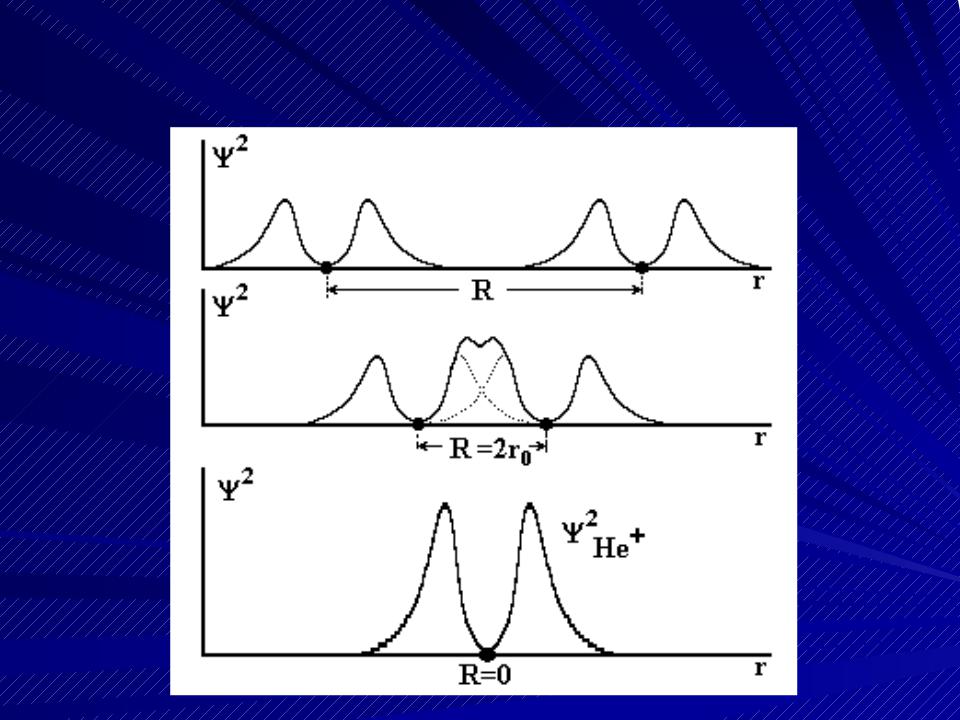
Иллюстрация метода ЛКАО на примере иона молекулы водорода
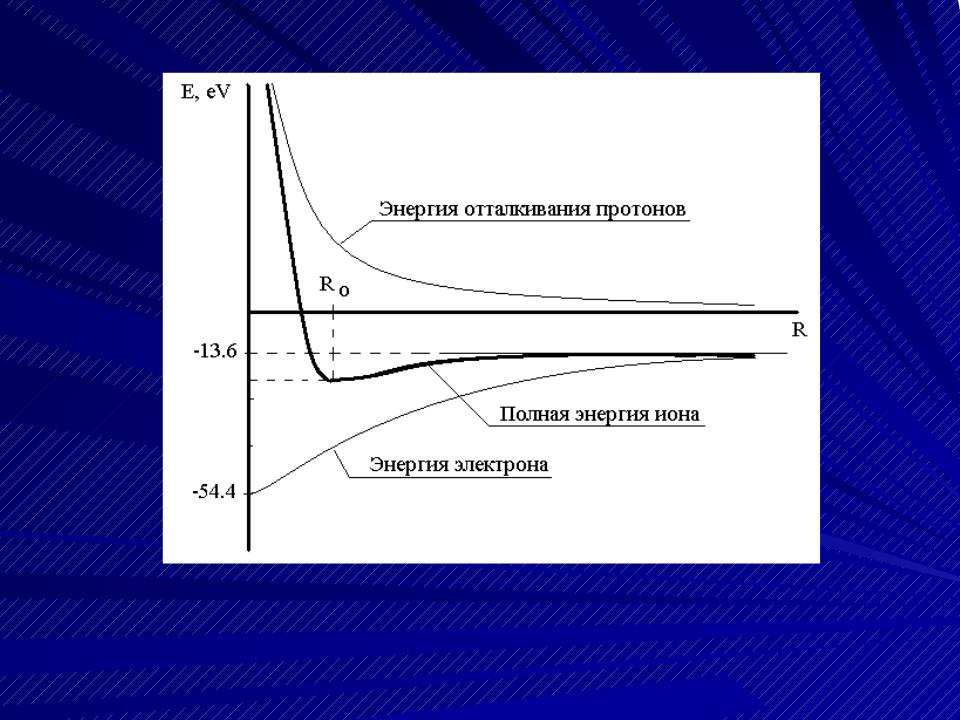
Энергия иона молекулы водорода
R0 = 1.06 Å, Emin = -16.25 эВ, Ed = 16.25-13.6 = 2.65 эВ

Ионная связь
Энергия ионизации атомов щелочных металлов:
H |
13.6 Эв |
Li |
5.39 Эв |
Na |
5.14 Эв |
K |
4.34 Эв |
Rb |
4.18 Эв |
Cs |
3.89 Эв |
Энергии сродства  атомов галогенов к электрону:
атомов галогенов к электрону:
H |
0.75 Эв |
F |
3.40 Эв |
Cl |
3.62 Эв |
Br |
3.82 Эв |
I |
3.06 Эв |

Пример ионной связи
В качестве примера рассмотрим молекулу  KCl. Для образования иона K+ необходимо затратить 4.34 эВ. При присоединении электрона к атому хлора (при образовании иона Cl-) выделяется 3.82 эВ (энергия сродства). Таким образом, на образование
KCl. Для образования иона K+ необходимо затратить 4.34 эВ. При присоединении электрона к атому хлора (при образовании иона Cl-) выделяется 3.82 эВ (энергия сродства). Таким образом, на образование  ионов K+ и Cl- необходимо затратить энер- гию E0 = 4.34 - 3.82 = 0.52 эВ.
ионов K+ и Cl- необходимо затратить энер- гию E0 = 4.34 - 3.82 = 0.52 эВ. 

Ионы K+ и Cl- притягиваются друг к другу; энергия их электростатического взаимо-  действия равна -e2/4 εoR, где R - расстоя- ние между ионами. Но когда ионы прибли- жаются друг к другу так, что начинают пе- рекрываться их электронные оболочки, возникают силы отталкивания. Энергия
действия равна -e2/4 εoR, где R - расстоя- ние между ионами. Но когда ионы прибли- жаются друг к другу так, что начинают пе- рекрываться их электронные оболочки, возникают силы отталкивания. Энергия  отталкивания Eотт = C/Rn, где C - некоторая
отталкивания Eотт = C/Rn, где C - некоторая константа; показатель n ≈ 20.
константа; показатель n ≈ 20. 
