
khimia / otvety_na_voprosy_40-48
.doc41.
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
Для реакции mA + nB pC + dD константа равновесия равна
K = K1 / K2 = ([C]p • [D]d) / ([A]m • [B]n)
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции.
Способы смещения равновесия
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
|
|
V1 |
|
|
A + Б |
|
В |
|
|
V2 |
|
1. Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
|
|
V1 |
|
|
|
A + Б |
|
В |
; увеличение P приводит к V1 > V2 |
|
|
V2 |
|
|
|
2 |
|
1 |
|
2. Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты)
|
|
V1 |
|
|
A + Б |
|
В + Q, то увеличение tC приводит к V2 > V1 |
|
|
V2 |
|
|
|
V1 |
|
|
A + Б |
|
В - Q, то увеличение tC приводит к V1 > V2 |
|
|
V2 |
|
3. Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции. Увеличение концентраций исходных веществ [A] или [Б] или [А] и [Б]: V1 > V2.
4. Катализаторы не влияют на положение равновесия.
42.
Вода представляет собой слабый амфотерный электролит:
Н2О
![]() Н+
+ ОН-
Н+
+ ОН-
или, более точно:
2Н2О
![]() Н3О+
+ ОН-
Н3О+
+ ОН-
Константа диссоциации воды при 25оС равна:
![]()
Такое значение константы соответствует диссоциации одной из ста миллионов молекул воды, поэтому концентрацию воды можно считать постоянной и равной 55,55 моль/л (плотность воды 1000 г/л, масса 1 л 1000 г, количество вещества воды 1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л =55,55 моль/л). Тогда
![]()
Эта величина постоянная при данной температуре (25оС), она называется ионным произведением воды KW:
![]()
Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100оС значения 10-13.
В чистой воде при 25оС концентрации ионов водорода и гидроксила равны между собой:
[H+] = [OH-] = 10-7 моль/л
Водоро́дный показа́тель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
![]()
43.
Полными электронными аналогами называются элементы, которые будут иметь одинаковое строение внешнего электронного слоя во всех степенях окисления.
Неполные электронные аналоги имеют одинаковое строение внешнего слоя, только при определенной степени окисления.
Например:
N
![]()
P
![]()
Следовательно, азот и фосфор – неполные электронные аналоги.
Периодические свойства химических элементов
В принципе, свойства химического элемента объединяют все без исключения его характеристики в состоянии свободных атомов или ионов, гидратированных или сольватированных, в состоянии простого вещества, а также формы и свойства образуемых им многочисленных соединений. Но обычно под свойствами химического элемента подразумевают, во-первых, свойства его свободных атомов и, во-вторых, свойства простого вещества. Большинство этих свойств проявляет явную периодическую зависимость от атомных номеров химических элементов[8]. Среди этих свойств наиболее важными, имеющими особое значение при объяснении или предсказании химического поведения элементов и образуемых ими соединений являются:
-
энергия ионизации атомов;
-
энергия сродства атомов к электрону;
-
электроотрицательность;
-
атомные (и ионные) радиусы;
-
энергия атомизации простых веществ
-
степени окисления;
-
окислительные потенциалы простых веществ.
44.
Выделяя из этого ряда окислительно-восстановительные системы типа Меn+/Me и располагая их в порядке возрастания стандартных электродных потенциалов, получают электрохимический ряд напряжений металлов: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Электрохимический ряд напряжений характеризует свойства металлов в водных растворах:
чем меньше электродный потенциал металла, тем легче он окисляется и труднее восстанавливается из своих ионов;
металлы, имеющие отрицательные электродные потенциалы, т.е. стоящие в ряду напряжений левее водорода, способны вытеснять его из разбавленных растворов кислот;
каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Уравнение Нернста — уравнение связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
![]() ,
,
где
![]() —
универсальная
газовая постоянная, равная 8.31
Дж/(моль*K);
—
универсальная
газовая постоянная, равная 8.31
Дж/(моль*K);
![]() —
абсолютная температура;
—
абсолютная температура;
![]() —
число
Фарадея, равное 96485,35 Кл/моль;
—
число
Фарадея, равное 96485,35 Кл/моль;
![]() —
число молей
электронов,
участвующих в процессе;
—
число молей
электронов,
участвующих в процессе;
![]() и
и
![]() —
активности
соответственно окисленной
и восстановленной
форм вещества, участвующего в полуреакции.
—
активности
соответственно окисленной
и восстановленной
форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим
![]()
45.
Первую попытку создать общую теорию кислот и оснований предпринял шведский физикохимик Сванте Аррениус. Согласно его теории, сформулированной в 1887, кислота — это соединение, диссоциирующее в водном растворе с образованием протонов (ионов водорода H+). Теория Аррениуса быстро показала свою ограниченность, она не могла объяснить многих экспериментальных фактов. В наше время она имеет главным образом историческое и педагогическое значение.
. Теория кислотно-основной электролитической диссоциации (С.Аррениус, 1887). Согласно этой теории, кислотой называют вещество, диссоциирующее в растворе с образованием ионов Н+, а основанием –вещество, высвобождающее при диссоциации ионы ОН-. Схема записи кислотно-основных равновесий по Аррениусу хорошо известна и широко применяется в школьной практике:
(кислота) НAn <=> H+ + An-; (основание) МеОН <=> Ме+ + ОН-.
Эта теория вполне соответствует современным требованиям, но не описывает поведение неводных растворов.
По мере увеличения разведения коэффициент Вант-Гоффа приближается к простому целому числу (2,3,4 – в зависимости от числа ионов, образующихся при растворении молекул вещества):
NaCl = Na+ + Cl- i→2
K2SO4
= 2K+
+ SO![]() i→3
i→3
AlCl3 = Al3+ + 3Cl- i→4
K4[Fe(CN)6] = 4K+ + [Fe(CN)6]2- i→5
Основы теории электролитической диссоциации – С.Аррениус, 1887г.:
1. Электролиты при растворении в воде диссоциируют.
2. Под действием электрического тока ионы движутся в растворе:
положительно заряженные - к катоду, отрицательно заряженные — к аноду.
3. Диссоциация – обратимый процесс
46.
Атом – электронейтральная частица, неделимая химическим путем. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, образующих электронную оболочку. Ядро атома состоит из положительно заряженных частиц – протонов p+ и электрически нейтральных частиц – нейтронов n0. Электрон в атоме не имеет траектории движения. Квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра. Быстро движущийся электрон может находиться в любой части пространства, окружающего ядро, и различные положения его рассматриваются как электронное облако с определенной плотностью отрицательного заряда. Поскольку движение электрона имеет волновой характер, квантовая механика описывает его движение в атоме при помощи волновой функции ψ. В разных точках атомного пространства эта функция принимает разные значения. Для выражения законов движения частиц используется уравнение Шредингера. Шредингер вывел уравнение, которое связывает энергию электронной системы с волновой функцией. Волновое уравнение Шредингера для движения одной частицы, например электрона в атоме водорода, в общем виде выглядит следующим образом:
|
|
U – потенциальная энергия электрона E – полная энергия электрона Решения уравнения показывают вероятности нахождения электрона в той или иной точке пространства вокруг ядра атома и никак не связывают эту вероятность с траекторией движения электрона. Решение уравнения для многоэлектронных систем сложно; в настоящее время его можно точно решить только для атома водорода (и водородоподобных, т.е. одноэлектронных частиц, например He+, Li+, и т.д.). Часто удобно рассматривать электрон как бы “размазанным” по атому в виде электронного облака. Фигуру, образованную “размазанным” электроном называют орбиталью. Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона. Применительно к электрону можно сказать, что он ведет себя и как частица, и как волна, т. е. обладает, как и другие микрочастицы, корпускулярно-волновым дуализмом (двойственностью). С одной стороны, электроны как частицы производят давление, с другой стороны, движущийся поток электронов обнаруживает волновые явления, например дифракцию электронов. Дифракция – способность волн огибать препятствия, размеры которых соизмеримы с длиной волны. Атомные орбитали отличаются энергией, размером, формой и положением в пространстве относительно ядра. Согласно квантово-механическим расчетам s-орбитали имеют форму шара (рис. 1), p-орбитали – форму гантели (рис. 2). d-Орбиталь в зависимости от характеризующих ее квантовых чисел может принимать две различные формы (рис. 3), а f-орбиталь – четыре различные формы (рис. 4).
|
|
|
|
Рис. 1. Форма s-орбитали
|
|
|
|
|
|
Рис. 2. Форма p-орбитали
|
|
|
|
|
|
Рис. 3. Возможные формы d-орбиталей
|
|
|
|
|
|
|
|
|
Рис. 4. Возможные формы f-орбиталей |
|
Орбиталь можно описать с помощью набора квантовых чисел: n – главное квантовое число, l – орбитальное квантовое число, ml – магнитное квантовое число, ms – спиновое квантовое число. Главное квантовое число обозначает номер энергетического уровня, на котором находится атомная орбиталь. Орбитальное квантовое число l введено для характеристики формы орбитали, а следовательно, и формы электронного облака атома. Для каждого значения главного квантового числа орбитальное число принимает значения, заключенные между 0 и (n – 1):
|
Главное квантовое число n |
Орбитальное квантовое число l |
Обозначение орбитали (электронного облака) |
|
1 2 3 4 |
0 0, 1 0, 1, 2 0, 1, 2, 3 |
1s 2s, 2p 3s, 3p, 3d 4s, 4p, 4d, 4f |
Таким образом, для электрона первого энергетического уровня (n = 1) возможна только одна форма орбитали, для второго энергетического уровня (n = 2) возможны две формы орбиталей, для третьего уровня (n = 3) – три и т.д. Для характеристики пространственного расположения орбиталей применяется магнитное квантовое число ml. Число значений магнитного квантового числа зависит от орбитального квантового числа и равно (2l + 1). Спин можно представить как веретенообразное вращение электрона вокруг своей оси. Для характеристики спина электрона вводится четвертое квантовое число ms, называемое спиновым. Оно имеет значения +1/2 и -1/2 в зависимости от одной из двух возможных ориентаций спина в магнитном поле. Электроны, которые движутся в орбиталях близкого размера, образуют электронный слой или энергетический уровень. Существует несколько видов энергетических уровней: s, p, d, f, g и т.д. Для каждого из них характерна своя форма орбиталей. На одной атомной орбитали могут находиться не более 2 электронов. Электроны на одной орбитали имеют разные спины. Это обосновывается правилом Паули.
s-Орбитали, как было показано выше, имеют сферическую форму и, следовательно, одинаковую электронную плотность в направлении каждой оси трехмерных координат:
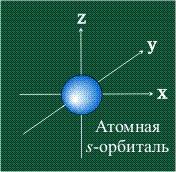 СФЕРИЧЕСКАЯ
ФОРМА s-орбитали
СФЕРИЧЕСКАЯ
ФОРМА s-орбитали
На первом электронном уровне каждого атома находится только одна s-орбиталь. Начиная со второго электронного уровня помимо s-орбитали появляются также три р-орбитали. Они имеют форму объемных восьмерок, именно так выглядит область наиболее вероятного местонахождения р-электрона в районе атомного ядра. Каждая р-орбиталь расположена вдоль одной из трех взаимоперпендикулярных осей, в соответствии с этим в названии р-орбитали указывают с помощью соответствующего индекса ту ось, вдоль которой располагается ее максимальная электронная плотность:
 РАСПОЛОЖЕНИЕ
В ПРОСТРАНСТВЕ р-орбиталей
РАСПОЛОЖЕНИЕ
В ПРОСТРАНСТВЕ р-орбиталей
В современной химии орбиталь – определяющее понятие, позволяющее рассматривать процессы образования химических связей и анализировать их свойства, при этом внимание сосредотачивают на орбиталях тех электронов, которые участвуют в образовании химических связей, то есть, валентных электронов, обычно это электроны последнего уровня.
У атома углерода в исходном состоянии на втором (последнем) электронном уровне находится два электрона на s-орбитали (отмечены синим цветом) и по одному электрону на двух р-орбиталях (отмечены красным и желтым цветом), третья орбиталь – рz-вакантная:
47.
?????? буферные растворы и вычисление их pH прочесть в тетрадке
48.
Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:
|
|
|
|
|
|
|
|
|
|
|
Реакции самоокисления-самовосстановления серы возможны и при ее взаимодействии с сульфитами. Так, при кипячении раствора с мелкоизмельченной серой образуется тиосульфат (иногда называют гипосульфит) натрия:
Na2SO3 + S → Na2S2O3.
2. Внутримолекулярные окислительно-восстановительные реакции - атомы, изменяющие свои степени окисления, находятся в одной и той же молекулярной частице:
2KNO3 = 2KNO2 + О2
В этом случае атомы хрома, изменяющие степень окисления от +6 до +3, принимают электроны, а атомы азота, степень окисления которых меняется от -3 до 0, их отдают.
Среди внутримолекулярных окислительно-восстановительных реакций выделяют реакции диспропорционирования (самоокисления-самовосстановления). Они сопровождаются одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, первоначально находящихся в одном определенном состоянии. Например, атомы хлора из степени окисления 0 переходят как в степень окисления –1 (KCl), так и в состояние +5 (KClO3):
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
В реакциях усреднения происходит изменение степени окисления одного и того же элемента с образованием одной и той же молекулы:
2H2S + H2SO3 = 3S + 3H2O









