
khimia / otvety_na_voprosy_64-70
.doc65.
Было..смотреть в ранних билетах
66.
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
![]()
Константа этого равновесия рассчитывается по уравнению:
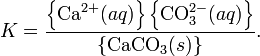
В приближении идеального раствора с учетом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
![]()
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
![]()
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
[править] Произведение активностей
Данное уравнение не учитывает коэффициенты активности, то есть степень влияния ионных сил. Для растворов с концентрациями большими, чем 1•10-4 моль/л необходимо использовать произведение активностей:
![]()
где аA и аB — активности ионов A и B.
Произведение активностей ионов для насыщенных растворов малорастворимых электролитов при данной температуре постоянная величина. Она зависит от температуры и природы растворителя.
Произведение растворимости связано с растворимостью следующим соотношением:
![]()
где:
m+n — суммарное количество молей катионов и анионов
m — количество молей катиона
n — количество молей аниона
Ksp — произведение растворимости
S — растворимость вещества (моль/л)
AxBy=xA+yB ур-е диссоциации тогда ПР s xs ys ПР=((xs)^x)*((ys)^y)
s - расстворимость ... раскрываешь скобки, выражаешь s - вот тебе и зависимость
67. ПО УЧЕБНИК АХМЕТОВА 51-65
68.
Закон действующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии. Закон действующих масс сформулирован в 1864—1867 гг. К. Гульдбергом и П. Вааге. Согласно этому закону скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Закон действующих масс используют при различных расчетах химических процессов. Он позволяет решить вопрос, в каком направлении возможно самопроизвольное течение рассматриваемой реакции при заданном соотношении концентраций реагирующих веществ, какой выход нужного продукта может быть получен.
Общая формула
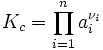
где
ai — активности веществ, выраженные через концентрации, парциальные давления либо мольные доли;
νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным);
Kc — константа химического равновесия
На практике в расчётах, не требующих особой точности, значения активности обычно заменяются на соответствующие значения концентраций (для реакций в растворах) либо парциальных давлений (для реакций между газами).
Пример: для стандартной реакции
![]()
константа химического равновесия определяется по формуле
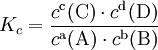
При постоянной температуре отношение равновесных концентраций (парциальных давлений) конечных продуктов к равновесным концентрациям (парциальным давлениям) исходных реагентов, возведенных соответственно в степени, равные их стехиометрическим коэффициентам, величина постоянная
Различают порядок и молекулярность реакции. Молекулярность реакции - это число частиц (молекул, атомов, ионов), принимающих участие в элементарном акте химического превращения.
|
Химические реакции |
||
|
мономолекулярные |
Бимолекулярные |
тримолекулярные |
|
A P |
2A P |
A + B + C P |
|
A P + Q |
A + B P |
A + B + C P + Q + ... |
|
|
A + B P + Q |
А + 2В P + Q + ... |
Реакции, более высокой, чем три молекулярности маловероятны. Отношение вероятности столкновения двух молекул при 1 атм. к столкновению четырех молекул равно 108, т.е. на 100 млн. столкновений двух молекул приходится 1 столкновение четырех молекул.
Порядок реакции определяется величиной показателя степени в кинетическом уравнении. Различают частный и полный порядок реакции. Так, для реакции, скорость которой выражается уравнением (5.8):
(а+b) - полный порядок реакции;
а - частный порядок реакции (по реагенту А);
b - частный порядок реакции (по реагенту В);
Следует помнить, что только для элементарных реакций уравнение скорости реакции соответствует стехиометрическому уравнению, поэтому порядок реакции и ее молекулярность совпадают.
Для сложных реакций порядок зависит от молекулярности отдельных стадий, т.е. порядок реакции и ее молекулярность не совпадают. В этом случае порядок реакции равен молекулярности лимитирующей стадии этой реакции. Кроме того, один из реагентов может находиться в избытке. В этом случае его концентрация практически постоянна и порядок реакции будет меньше, чем это следует из стехиометрического уравнения.
Если в гомогенных системах реакции происходят во всем объеме, то в гетерогенных системах химическое взаимодействие протекает на поверхности. Поэтому течение гетерогенных процессов во многом зависит от величины и состояния поверхности. Например, от степени измельчения твердого реагента.
Как применяют З.Д.М. к гетерогенным системам. Так, в гетерогенной реакции:
A(г) + B(т) = P(г)
соударения между молекулами газообразного реагента А и твердого реагента В могут происходить только на поверхности раздела фаз, а значит, концентрация твердой фазы не влияет на скорость реакции. Выражение скорости реакции можно записать:
= k·S·c(A) = k·c(A),
где S - площадь поверхности раздела фаз.
Таким образом, скорость реакции пропорциональна только концентрации реагента, находящегося в газовой фазе. Для реакций данного типа используют понятие производительность реакции (Q), которую рассчитывают по формуле:
Q = ·S
Течение гетерогенных процессов в ряде случаев зависит от характера (прежде всего от растворимости) образующихся продуктов. Если они малорастворимы, то оставаясь на твердой поверхности реагента, эти продукты замедляют или прекращают химическую реакцию. Например, свинец не растворяется в разбавленных серной и соляной кислотах, т.к. на его поверхности образуются, соответственно, труднорастворимые соли сульфата свинца (PbSO4) и хлорида свинца (PbCl2). Также известно, что алюминий очень медленно окисляется на воздухе, т.к. покрывается малопроницаемой для кислорода пленкой оксида - Al2O3. Поэтому ожидать совпадения между скоростью по З.Д.М. и скоростью, полученной в опыте, можно только тогда, когда скорость всего процесса определяется скоростью химического взаимодействия, а не диффузионными или другими сопутствующими явлениями.
Механизм реакции - детальное ее описание с учетом всех промежуточных стадий и промежуточных веществ, природы взаимодействия реагирующих частиц, характера разрыва связей, изменения энергии химической системы на всем пути ее перехода из исходного в конечное состояние. Цель изучения механизма реакции - возможность управлять ходом реакции, ее направлением и эффективностью.
Реакции, протекающие в одну стадию, называют простыми (элементарными) реакциями, а реакции, включающие несколько стадий - сложными. Энергетическая диаграмма простой реакции приведена на рис. 6.3 (а), сложной (двухстадийной) - на рис. 6.3 (б).
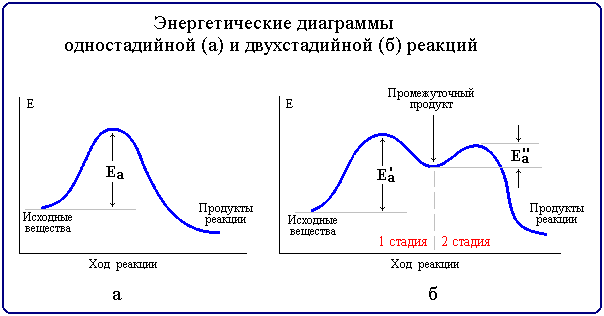 Рис.
6.3. Энергетические диаграммы
Рис.
6.3. Энергетические диаграммы
Многие органические реакции являются сложными и идут в несколько элементарных стадий (последовательных или параллельных). Общая скорость сложной химической реакции определяется скоростью ее наиболее медленной (лимитирующей) стадии. Например, в приведенной на рис. 6.3,б диаграмме лимитирующей является стадия 1 с более высокой энергией активации Еа'.
В случае сложных реакций на некоторых стадиях образуются нестабильные промежуточные частицы - органические ионы или свободные радикалы. Их относительная устойчивость и, следовательно, вероятность образования растут с увеличением возможности делокализации (рассредоточения) заряда в ионе или неспаренного электрона в радикале
69.
Окислительно-восстановительная двойственность ? элементы в промежуточной степени окисления могут проявлять как свойства восстановителя, так и свойства окислителя, так как могут и повышать степень окисления (отдают электроны, окисляются), так и понижать (принимают электроны, восстанавливаются).
Окислительно-восстановительный потенциал φ° - количественная характеристика способности вещества участвовать в окислительно-восстановительном процессе
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ).
Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если реакцию окисления-восстановления представить уравнением:
Aox + n·e- → Ared
то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста.
Окислительно-восстановительный потенциал определяют электрохимическими методами и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях.
70.
Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Различные орбитали, не сильно отличающиеся энергиями, образуют соответствующее число гибридных орбиталей. Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации. Гибридные орбитали одинаковы по форме электронного облака и по энергии. По сравнению с атомными орбиталями они более вытянуты в направлении образования химических связей и поэтому обуславливают лучшее перекрывание электронных облаков. На рис. 5 показана гибридная орбиталь за счет комбинации s- и p-орбиталей. Гибридная орбиталь больше вытянута по одну сторону ядра, чем по другую.
|
|
|
Рис. 5. Форма гибридной орбитали за счет комбинации s- и p-атомных орбиталей |
При образовании молекулы метана 1 s-электрон и 3 p-электрона атома углерода образуют четыре одинаковых гибридных орбитали. Этот тип гибридизации называется sp3-гибридизацией. Помимо энергетических уровней s и p, в процессе гибридизации могут также участвовать d- и f-уровни. На рис. 6 показаны возможные формы гибридной орбитали, образованной за счет гибридизации s-, p-, и d-атомных орбиталей. Форма этой орбитали зависит от магнитного квантового числа, характеризующего орбиталь.
|
|
|
|
Рис. 6. Возможные Формы гибридной орбитали за счет комбинации s-, p-,и d-атомных орбиталей |
|
В гибридизации могут участвовать не только s- и p-орбитали, а также s-, p- и d орбитали, но и, например, s- и d-орбитали без p-орбиталей или только p- и d-орбитали. Теория гибридизации с участием f-орбиталей пока еще практически не разработана. Надо отметить, что понятие гибридизации является теоретическим. Понятие было введено ученым Лайнусом Полингом в 20-е годы XX века.
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ,
квантовохимический способ описания
перестройки орбиталей атома в молекуле
по сравнению со свободный атомом. Являясь
формальным мат. приемом, ГИБРИДИЗАЦИЯ
АТОМНЫХ ОРБИТАЛЕЙ а. о. позволяет отразить
нарушение сферич. симметрии распределения
электронной плотности атома при
образовании химический связи. Сущность
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ а. о.
состоит в том, что электрон молекулы
вблизи выделенного атомного ядра
характеризуется не отдельной атомной
орбиталью (АО), а линейной комбинацией
атомных орбита-лей с различные значениями
азимутального и магнитного квантовых
чисел. Такая линейная комбинация называют
гибридной (гибридизированной) орбиталью
(ГО). Как правило, гибридизация затрагивает
лишь высшие и близкие по энергии занятые
АО свободный атома. Например, для атомов
элементов второго периода периодической
системы типичная форма ГО![]() -линейная
комбинация 2s-орбитали
-линейная
комбинация 2s-орбитали![]() и
2р-орбиталей
и
2р-орбиталей![]()
![]() ,
,![]()
![]() ,
,![]() с численными коэффициентами
с численными коэффициентами![]() и
и
ГО обладают более низкой симметрией,
чем составляющие их АО. Так, распределение
электронной плотности, отвечающее
указанной ГО![]() ,
смещено от атомного ядра в направлении
вектора п с координатами
,
смещено от атомного ядра в направлении
вектора п с координатами![]() ; вектор п является осью симметрии ГО
(рис. 1). При изменении ориентации в
пространстве осей координат коэффициенты
линейной комбинации могут изменяться,
однако остается постоянным отношение
сумм квадратов коэффициентов для данного
значения азимутального квантового
числа. Это отношение определяет тип ГО.
Например, орбиталь
; вектор п является осью симметрии ГО
(рис. 1). При изменении ориентации в
пространстве осей координат коэффициенты
линейной комбинации могут изменяться,
однако остается постоянным отношение
сумм квадратов коэффициентов для данного
значения азимутального квантового
числа. Это отношение определяет тип ГО.
Например, орбиталь![]() относится
к типу sapb, где а и b- числа,
подобранные так, чтобы
относится
к типу sapb, где а и b- числа,
подобранные так, чтобы![]() .
Обычно принимают а — 1, b = 1, 2 или 3.
.
Обычно принимают а — 1, b = 1, 2 или 3.
Как правило, гибридные орбитали данного атома в молекуле относятся к одному типу, который называют типом гибридизации атома. Так, атом N в молекуле аммиака имеет ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ а. о. типа sp3, атом С в молекуле этилена - sp2-гибридизацию, атом С в молекуле ацетилена - sp-гибридизацию. Это дает основание отождествлять тип гибридизации атома в молекуле с символом его некоей гипотетич. электронной конфигурации.
Обычно система ГО строится таким образом,
чтобы для разных орбиталей одного атома
интегралы перекрывания были равны нулю
(см. Молекулярные интегралы). Кроме того,
каждая орбиталь в молекуле либо остается
негибридизированной АО, либо выбирается
гибридизированной по определенному
типу. Этим требованиям удовлетворяют
несколько наборов орбиталей. Например,
атом О в молекуле Н2О можно считать
как sp2-, так и 5р3-гибридизированным.
Оси симметрии всех орбиталей обычно
образуют симметричную фигуру (см. рис.
2). Операции симметрии этой фигуры
переводят ГО одного атома друг в друга.
Такие ГО называют эквивалентными.
Например, линейная комбинация четырех
валентных АО атома С приводит к четырем
5р3-гибридным орбиталям, оси
симметрии которых по отношению друг к
другу расположены под углом 109,5°, т.е.
направлены по углам тетраэдра (рис. 2,
в).
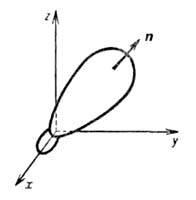
Рис. 1. Гибридная орбиталь, образованная
из 2s- и 2р-атомных орбиталей; х, у, z-
координатные оси, п-ось симметрии.
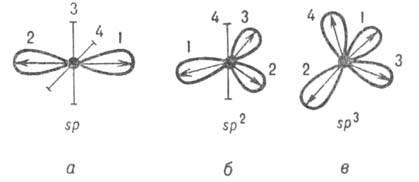
Рис. 2. Система гибридных орбиталей 5р"-типа (1, 2, 3, 4); о, б, в соответствуют п = 1, 2, 3. Оси симметрии негибридизированных атомных орбиталей изображены отрезками. Стрелками указано направление смещения электронной плотности.
Представление о ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ а. о. используется для изучения закономерностей изменения электронной плотности молекулы вблизи к.-л. атомного ядра в зависимости от его окружения, т.е. позволяет установить связь между электронным строением молекулы и ее структурой. При этом возможны различные подходы к анализу этой связи. Если известно геометрическая расположение атомных ядер, расчет волновой функции молекулы можно свести к изучению парных взаимодействие соседних атомов (см. Валентных связей метод, Молекулярных орбиталей методы). Для такого расчета выбирают одну из возможных систем ГО и располагают ее в пространстве так, чтобы обеспечить макс. перекрывание отдельных пар ГО разных атомов. Другой подход применяется в неэмпирических методах квантовой химии, в которых все взаимодействие атомов в молекуле учитываются одновременно и волновая функция молекулы не зависит от того, атомные или гибридизированные орбитали используются для расчета. В этом случае ГО строят после определения волновой функции молекулы таким образом, чтобы в отдельных областях пространства распределение электронной плотности можно было описать одной ГО. В обоих подходах тип ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ а. о. обусловлен геометрическая конфигурацией молекулы и для большинства равновесных конфигураций оба подхода приводят к близким формам ГО.
В теоретич. химии для систематизации эксперимент. данных о равновесных конфигурациях молекул часто применяют феноменологич. подход, в рамках которого атомы данного элемента склонны к гибридизации определенного типа, а тип гибридизации определяет взаимное расположение ядер ближайшего окружения. Отклонение конфигурации молекулы от симметричной связывают с взаимодействие химический связей (например, с отталкиванием пар электронов, образующих связь). В такой форме представления о ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ а. о. используются в стереохимии.



