
колды / Адсорбция
.doc
Отчет по практической работе по коллоидной химии
«Адсорбция»
Студентки III курса 4-ой группы
Шевченко Ольги
Работа 16. Измерение поверхностного натяжения методом наибольшего давления пузырьков.
Работа 19. Исследование связи между поверхностным натяжением и адсорбцией.
Перед началом лабораторной работы измерительный капилляр, сосудик, рабочие колбы 6 на 100 мл и 6 на 50 мл и пипетки на 50 и 25 мл тщательно промыли хромовой смесью, водопроводной водой и дистиллированной водой. В сосуд до половины налили хромовой смеси, опустили туда капилляр так, чтобы шарик капилляра был полностью погружен в жидкость, и оставили стоять, а в это время помыли колбы. В одну из колб налили небольшое количество хромовой смеси. Этим объемом ополоснули внутри все колбы, переливая хромовую смесь из одной колбы в другую, и в конце слили её в керамический стакан для слива. Из этого стакана в пипетку грушей засасали хромовую смесь и через носик пипетки вылили хромовую смесь назад в керамический стакан. После этого вылили из сосуда хромовую смесь в стакан для слива, а из капилляра выдули её туда же при помощи груши.
Затем всю посуду промыли 20 раз водопроводной водой. Пипетки, сосудик и колбы ополоснули дистиллированной водой и одну колбу на 100 мл для задачи поставили в сушильный шкаф. Капилляр промыли от хромовой смеси дистиллированной водой с помощью водоструйного насоса.

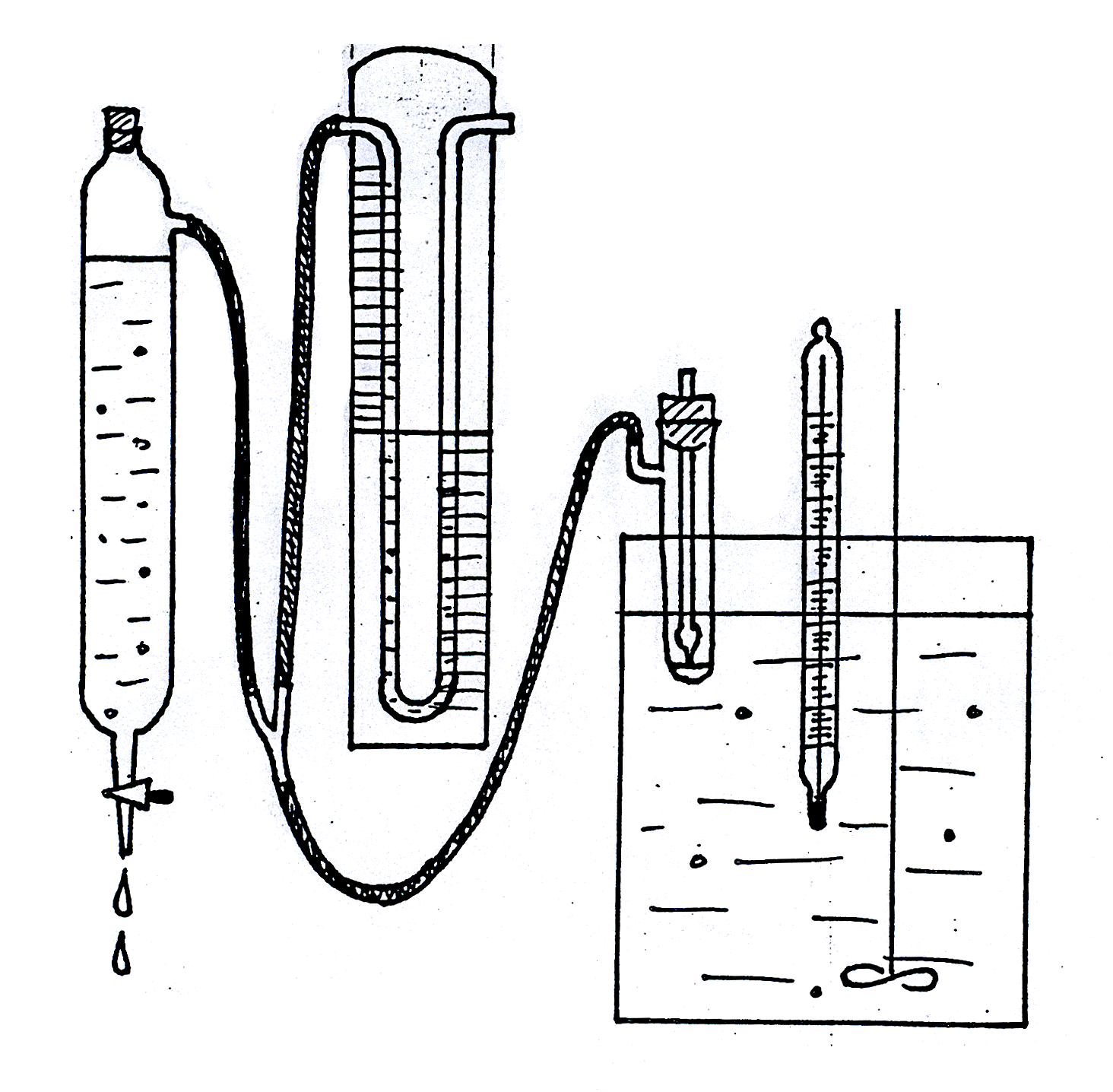
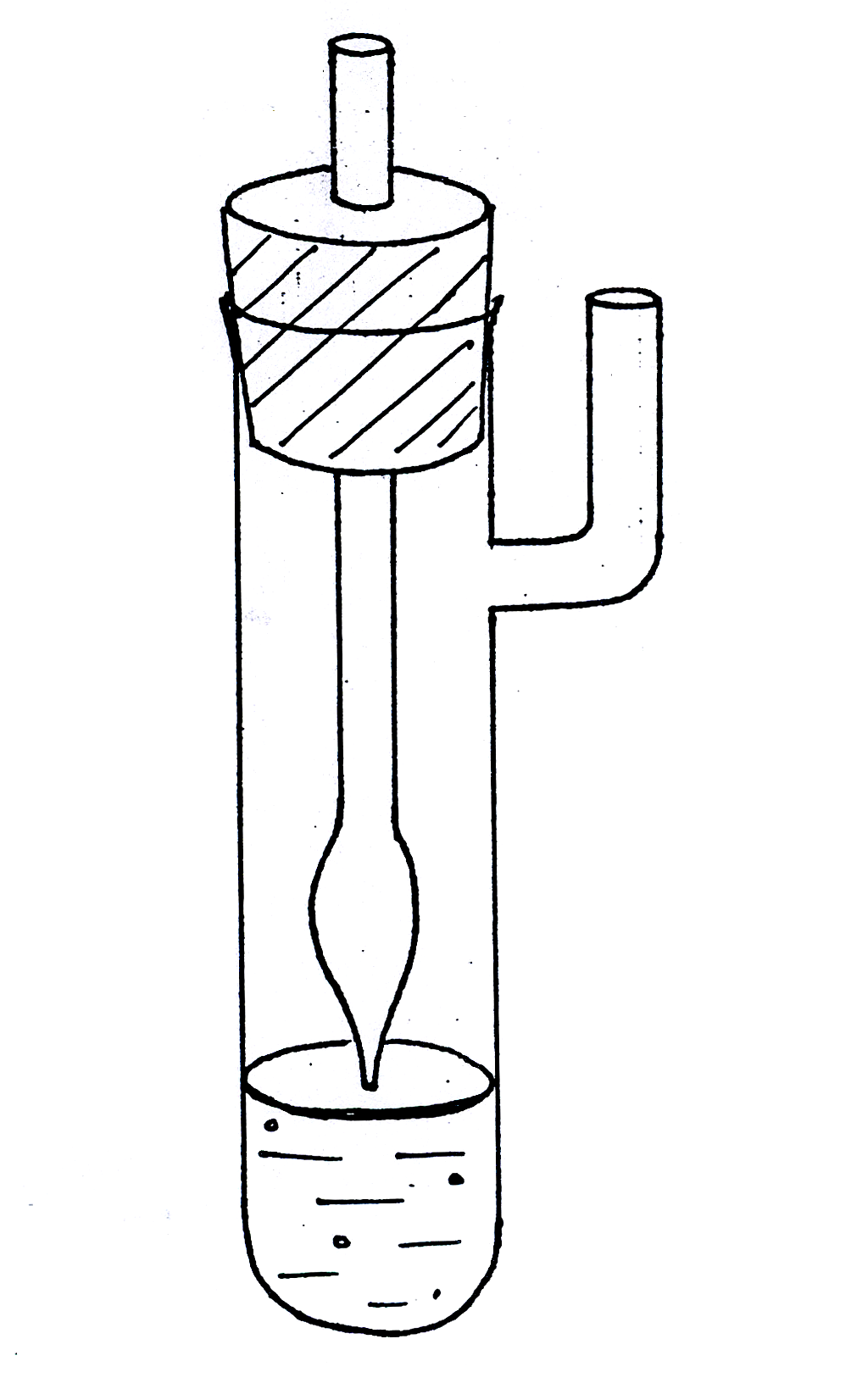
Рис. 1619.1, 1619.1а. Установка для измерения поверхностного натяжения методом
наибольшего давления пузырьков.
Для измерения поверхностного натяжения методом наибольшего давления пузырьков пользуются прибором, разработанным академиком П.А. Ребиндером (рис. 1619.1). Исследуемую жидкость налили в термостатированный сосудик (1) с боковым отростком, в который опустили капилляр (2) таким образом, чтобы он только касался поверхности жидкости, но не был погружен в нее. Боковой отросток соединяется с аспиратором – устройством для создания разрежения в сосудике – герметичным стеклянным цилиндром, разрежение воздуха в котором создается за счет вытекающей из него воды; при этом происходит просасывание воздуха через кончик капилляра в жидкость с образованием пузырьков. С системой соединен водяной манометр (4), позволяющий определять максимальное давление в пузырьке по разности уровней воды в обоих коленах манометра (h = h1 + h2).
Далее определяли константу капилляра K по дистиллированной воде. Для этого налили в сосуд немного воды и погрузили туда капилляр так, чтобы он только касался поверхности жидкости, но не был погружен в нее (см. рис. 1619.1а). При этом пробка с капилляра была плотно вставлена в сосудик.
Далее сосуд поместили в термостат и соединили с аспиратором. Во время измерений аспиратор должен быть плотно закрыт пробкой; воду в аспиратор доливали только при помощи воронки. Скорость вытекания воды из аспиратора отрегулировали так, чтобы число пузырьков воздуха, проходящих через капилляр, не превышало 58 в минуту.
Отсчет
наибольшей величины h,
отвечающей максимальному давлению в
пузырьке воздуха, делали при помощи
лупы по зеркальной шкале манометра.
Записали показания обоих колен манометра
и взяли их сумму: h
= h1
+ h2.
Затем вычислили константу капилляра
![]() ,
,![]() ,
,![]() причем выполнили эти измерения три
раза, каждый раз заново заполняя сосудик
водой, откуда и получили 3 разных значения
К.
причем выполнили эти измерения три
раза, каждый раз заново заполняя сосудик
водой, откуда и получили 3 разных значения
К.
Далее в 4 пронумерованные колбы на 100 мл (№26) пипеткой налили по 50 мл дистиллированной воды. После этого в сухую остывшую колбу на 100 мл (№ 1) получили задачу, водный раствор ПАВ. Затем отобрали пипеткой 50 мл исходного раствора из колбы с задачей и добавили его в колбу с водой (№ 2), выдувая грушей содержимое из носика пипетки. Далее отобрали 50 мл полученного раствора этой же пипеткой и добавили в следующую колбу с водой (№ 3). Хорошо перемешали полученный раствор, отобрали 50 мл полученного раствора и так далее до тех пор, пока не получили 6 растворов, включая исходный.
Таким
образом, в результате последовательного
разбавления получили колбы с растворами,
разбавленными в 2, 4, 8, 16, 32 раза. Измерения
поверхностного натяжения начали с
самого разбавленного раствора, которому
соответствует колба с наибольшим номером
-№ 6. Перед измерением сосуд с капилляром
тщательно промыли исследуемым
раствором. После чего налили в сосуд
немного исследуемого раствора и погрузили
туда капилляр так, чтобы он только
касался поверхности жидкости, но не был
погружен в нее . Измеряли наибольшую
величину h
для исследуемого раствора аналогично
измерениям при определении константы
капилляра
снимали показания обоих колен манометра
и брали их сумму: h
= h1
+ h2,
только измерения для раствора проводили
один раз. Затем вычисляли значения
поверхностного натяжения исследуемого
раствора 6
со всеми получившимися константами
![]() .
.
Далее продолжили работу, изучая адсорбцию на границе раздела раствор ПАВ – твердый адсорбент (активированный уголь). Для этого в каждую из шести колб на 50 мл насыпали по 1 г адсорбента – активированного угля; при этом необходимое количество угля отмерили пробиркой, насыпая уголь до метки. Затем пипеткой на 25 мл отобрали самый разбавленный раствор и перенесли его в одну из колб с углем. Таким образом заливли все колбы с углем, плотно закрыли пробками, встряхнули и оставили в шкафу до следующего занятия. Вместе с колбами оставили сосудик с капилляром, предварительно промытый дистиллированной водой и полностью, до верха, заполненный ею.
Через неделю измерили поверхностное натяжение растворов ПАВ после адсорбции, начиная с самого разбавленного раствора (колба № 6 на 50 мл).
Далее в лаборантской получили данные об исследуемом ПАВ – исходную концентрацию С=0,5 моль/л, молекулярную массу М=74,08, плотность d=0,804 г/мл.
Полученные
экспериментальные данные и результаты
вычислений занесли в таблицу 1. Величины
адсорбции рассчитали по формуле
![]() ,
где
,
где
![]() ,
= i+1
– i,
C
= Ci+1
– Ci.
Эти данные использовали для построения
зависимости поверхностного натяжения
от концентрации ПАВ в растворе и изотермы
адсорбции, откладывая по оси абсцисс
значения концентрации С (М) и Сср
(М), а по оси ординат – величины
поверхностного натяжения
(эрг/см2)
и Г (моль/см2),
соответственно.
,
= i+1
– i,
C
= Ci+1
– Ci.
Эти данные использовали для построения
зависимости поверхностного натяжения
от концентрации ПАВ в растворе и изотермы
адсорбции, откладывая по оси абсцисс
значения концентрации С (М) и Сср
(М), а по оси ординат – величины
поверхностного натяжения
(эрг/см2)
и Г (моль/см2),
соответственно.
Таблица 1.
|
С, М |
h, мм |
, эрг/см2 (мН/м) |
С, М |
, эрг/см2 (мН/м) |
|
Cср, М |
|
|
|
0 0 0 |
51 51.5 52 |
72.75 72.75 72.75 |
|
|
|
|
|
|
|
0.01563 |
49 |
69.90 |
0.01563 |
2.6 |
166.3 |
0.008 |
0.546 |
14.65 |
|
0.03125 |
47 |
65.75 |
0.01562 |
4.15 |
265.7 |
0.023 |
2.51 |
9.16 |
|
0.0625 |
42 |
59.30 |
0.03125 |
6.45 |
206.4 |
0.047 |
3.981 |
11.81 |
|
0.125 |
37 |
52.80 |
0.0625 |
6.5 |
104 |
0.094 |
4.01 |
20 |
|
0.25 |
31 |
43.80 |
0.125 |
9 |
72 |
0.188 |
5.55 |
33.87 |
|
0.5 |
25 |
35.00 |
0.25 |
8.8 |
35.2 |
0.375 |
5.42 |
63.559 |

Рисунок 1-зависимость поверхностного натяжения от концентрации.
Для нахождения
величины предельной адсорбции
![]() и константы k
уравнения адсорбции Лэнгмюра, преобразовали
уравнение
и константы k
уравнения адсорбции Лэнгмюра, преобразовали
уравнение
![]() так, чтобы получилось уравнение прямой,
деля С на обе части уравнения. После
сокращения получили уравнение прямой,
не проходящей через начало координат
так, чтобы получилось уравнение прямой,
деля С на обе части уравнения. После
сокращения получили уравнение прямой,
не проходящей через начало координат
![]() .
.

Рисунок 2-зависимость адсорбции от концентрации.
Величину
![]() определили по углу наклона прямой:
определили по углу наклона прямой:
![]() .
Построив график
.
Построив график
![]() ,
находим соответствующие катеты и
вычисляем
,
находим соответствующие катеты и
вычисляем
![]() .
По отрезку, отсекаемому прямой на оси
ординат, можно найти константу k.
.
По отрезку, отсекаемому прямой на оси
ординат, можно найти константу k.
![]() моль/см2
и
моль/см2
и
![]() ,
откуда
,
откуда
![]() .
При этом уравнение адсорбции Лэнгмюра
имеет вид
.
При этом уравнение адсорбции Лэнгмюра
имеет вид
![]() .
.
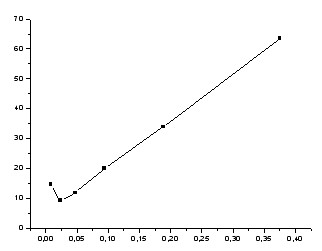
Рисунок 3-Определение константы адсорбции Лэнгмюра
Далее, зная величину
предельной адсорбции
![]() ,
можно вычислить площадь А, занимаемую
одной молекулой в поверхностном слое,
и толщину поверхностного слоя .
,
можно вычислить площадь А, занимаемую
одной молекулой в поверхностном слое,
и толщину поверхностного слоя .
![]() =2.4.1015см2;
=2.4.1015см2;
![]() см.
см.
Во второй части работы при изучении адсорбции ПАВ на поверхности твердого адсорбента для всех приготовленных растворов были измерены величины поверхностного натяжения x после адсорбции. Значения Cx, концентрацию ПАВ после адсорбции, нашли графически из зависимости поверхностного натяжения от концентрации (см.график изотерма поверхностного натяжения), опуская перпендикуляр из точки, соответствующей x, на ось абсцисс.
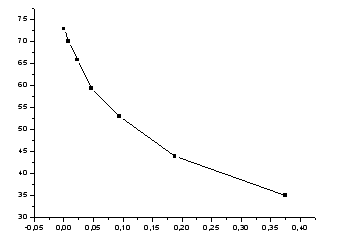
Рисунок 4-зависимость поверхностного натяжения от концентрации
По формуле
![]() ,
где V
– объем раствора (0.025 л) и m
– масса адсорбента (1 г), нашли величину
адсорбции, отнесенную к единице массы
адсорбента. Полученные экспериментальные
данные и результаты вычислений занесли
в таблицу.
,
где V
– объем раствора (0.025 л) и m
– масса адсорбента (1 г), нашли величину
адсорбции, отнесенную к единице массы
адсорбента. Полученные экспериментальные
данные и результаты вычислений занесли
в таблицу.
-
С, М
, эрг/см2 (мН/м)
x, эрг/см2 (мН/м)
Cx, М
С – Сx, М
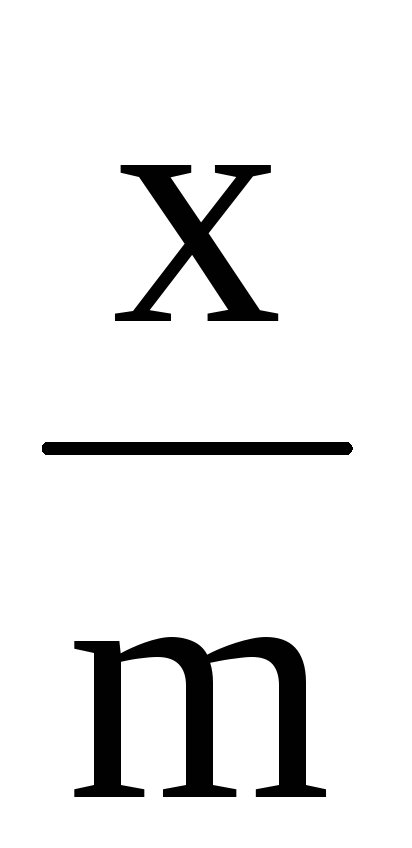 ,
ммоль/г
,
ммоль/г0.5
69.90
38.5
0.38
0.12
3
0.25
65.75
48.5
0.19
0.06
1.5
0.125
59.30
58.5
0.09
0.035
0.65
0.0625
52.80
64.3
0.05
0.0125
0.3125
0.03125
43.80
68.5
0.02
0.01125
0.2813
0.01563
35.00
71.3
0.008
0.00763
0.191
Эти
данные используем для построения
изотермы адсорбции на границе раздела
твердое тело – жидкость, откладывая по
оси абсцисс значения концентрации Сx
(М), а по оси ординат – количество
вещества, адсорбированное одним граммом
угля
![]() (ммоль/г).
(ммоль/г).
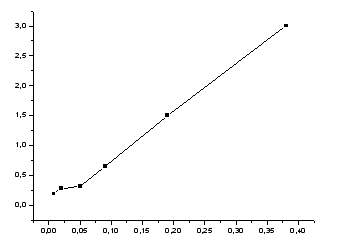
Рисунок 5-зависимость количества вещества, адсорбированного одним граммом угля от концентрации.
Далее
вычисляем величину удельной поверхности
адсорбента S
(см2/г)
– суммарную площадь поверхности,
отнесенную к единице массы адсорбента.
![]() .
.
