
- •Российский университет дружбы народов
- •Конспект лекций по молекулярной физике для специальностей «физика» и «радиофизика и электроника» Москва 2006
- •Относительная молекулярная масса вещества
- •Молярная масса вещества - масса одного моля, выраженная в килограммах.
- •Молекула из трех и большего числа атомов: (три координаты центра масс и три угла относительно трех взаимно перпендикулярных осей, проходящих через центр масс).
- •Первое начало термодинамики
- •Теплоемкость тела
- •Теплоемкость при постоянном объеме
Молярная масса вещества - масса одного моля, выраженная в килограммах.
![]() .
Размерность
молярной массы:
.
Размерность
молярной массы:
![]() .
.
Число
Авогадро
![]() - число молекул в одном моле вещества.
- число молекул в одном моле вещества.
![]() -
универсальная постоянная.
-
универсальная постоянная.
Уравнение состояния идеального газа Клапейрона-Менделеева
![]() ,
,
![]() - число молей.
- число молей.
где
![]() - масса газа,
- масса газа,![]() -универсальная
газовая постоянная.
-универсальная
газовая постоянная.
Постоянная
Больцмана:
![]() .
.
Уравнение
Клапейрона-Менделеева можно переписать
в виде:
![]() ,
где
,
где
![]() - полное число молекул в данной массе
газа. Отсюда получаем
- полное число молекул в данной массе
газа. Отсюда получаем
![]() ,
,
где
![]() - концентрация
молекул
(число молекул в единице объема).
- концентрация
молекул
(число молекул в единице объема).
Лекция 2. Молекулярно-кинетическое описание свойств идеального газа.
Модель идеального газа: учитываются лишь столкновения молекул газа со стенками. При этом давление определяется как сила ударов молекул, усредненная во времени и отнесенная к единице площади.
Р
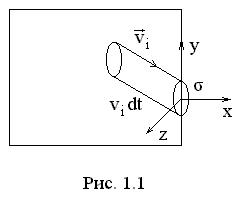
![]() – ой группе скорость всех молекул в
данный момент времени равна
– ой группе скорость всех молекул в
данный момент времени равна![]() .
Молекулы, которые ударятся о площадку
.
Молекулы, которые ударятся о площадку![]() на стенке сосуда за время
на стенке сосуда за время![]() находятся внутри наклонного цилиндра
с основанием
находятся внутри наклонного цилиндра
с основанием![]() и образующей
и образующей![]() (рис. 1.1). Число ударов таких молекул за
время
(рис. 1.1). Число ударов таких молекул за
время![]()
![]() ,
,
где
![]() - концентрация молекул в
- концентрация молекул в![]() -
ой группе,
-
ой группе,![]() - проекция скорости
- проекция скорости![]() на ось
на ось![]() ,
перпендикулярную площадке
,
перпендикулярную площадке![]() .
.
При ударе каждая молекула газа сталкивается с молекулой стенки. При этом средняя энергия молекул газа не изменяется. Для удобства вычислений разделим процесс взаимо-действия со стенкой на два этапа: 1) “прилипание” к стенке (остановка); 2) отталкивание от стенки.
Первый
этап. Полный
импульс молекул
![]() - ой группы
- ой группы
![]() .
.
Сила,
действующая на площадку
![]() со стороны молекул
со стороны молекул![]() -
ой группы на этом этапе
-
ой группы на этом этапе
![]() .
.
Сила со стороны всех молекул газа
![]() .
.
Второй этап. Сила со стороны всех молекул на втором этапе (сила отдачи)
![]() .
.
Тогда
полная сила, действующая на площадку
![]()
![]() .
.
Из хаотичности движения следует, что
![]() ,
,
![]() .
.
При
этом проекция силы на ось
![]() всегда больше нуля
всегда больше нуля
![]() .
.
Следовательно, давление газа
![]() .
.
Определим
среднее от произведения
![]() по всем молекулам
по всем молекулам
![]() ,
где
,
где
![]() -
полная концентрация молекул.
-
полная концентрация молекул.
Тогда давление идеального газа можно представить в виде
![]() ,
(1)
,
(1)
так
как в силу хаотичности движения молекул
![]() .
.
Уравнение
(1) называется основным
уравнением молекулярно-кинетической
теории идеального газа.
В такой форме оно применимо и к
релятивистским частицам. В частности,
с помощью него можно вычислить давление
фотонного газа. Для молекул, движущихся
по законам классической механики
![]() и уравнение (1) принимает вид
и уравнение (1) принимает вид
![]() .
(2)
.
(2)
Введем
понятие среднеквадратичной
скорости молекул
![]() .
Умножая (2) на молярный объем газа
.
Умножая (2) на молярный объем газа![]() ,
получим
,
получим
![]() ,
,
![]() .
.
Тогда
для средней кинетической энергии молекул
![]() получим
получим
![]() .
(3)
.
(3)
Выражение (3) справедливо только для одноатомных молекул, так как мы считали молекулы материальными точками. Оно позволяет определить абсолютную температуру как меру средней кинетической энергии теплового движения молекул.
В
курсе механики мы определили число
степеней свободы тела
![]() как наименьшее число координат,
необходимых для определения положения
тела в пространстве.
как наименьшее число координат,
необходимых для определения положения
тела в пространстве.
Одноатомная
молекула:
![]() .
.
Двухатомная
молекула:
![]() (три координаты центра масс и два угла
относительно двух взаимно перпендикулярных
осей, проходящих через центр масс).
(три координаты центра масс и два угла
относительно двух взаимно перпендикулярных
осей, проходящих через центр масс).
