
- •Российский университет дружбы народов
- •Конспект лекций по молекулярной физике для специальностей «физика» и «радиофизика и электроника» Москва 2006
- •Относительная молекулярная масса вещества
- •Молярная масса вещества - масса одного моля, выраженная в килограммах.
- •Молекула из трех и большего числа атомов: (три координаты центра масс и три угла относительно трех взаимно перпендикулярных осей, проходящих через центр масс).
- •Первое начало термодинамики
- •Теплоемкость тела
- •Теплоемкость при постоянном объеме
Российский университет дружбы народов
В.А. Туриков
Конспект лекций по молекулярной физике для специальностей «физика» и «радиофизика и электроника» Москва 2006
Лекция 1. Эмпирические законы идеальных газов.
Термодинамические
параметры
(параметры состояния):
![]() - давление,
- давление,
![]() -
объем,
-
объем,
![]() -
температура.
-
температура.
Температура – мера нагретости тела. Для измерения температуры используют различные свойства тел при нагревании. Например, в ртутном термометре используется свойство ртути расширяться при нагревании. Другой метод измерения температуры, термопара, основан на явлении возникновения термоэлектродвижущей силы в цепи из двух различных спаянных проводников, концы которых находятся при различной температуре. Существует множество других методов измерения температуры.
Шкала
температур
определяется заданием двух основных
температурных точек (реперные точки).
В шкале
Цельсия
такими точками являются температура
плавления льда (00
С) и температура кипения воды (1000
С) при нормальном атмосферном давлении.
Абсолютная
шкала температур (шкала Кельвина)
связана со шкалой Цельсия соотношением
![]() .
Физический смысл абсолютной шкалы
температур будет рассмотрен далее.
.
Физический смысл абсолютной шкалы
температур будет рассмотрен далее.
За единицу давления в системе СИ принимается 1 паскаль (Па), равный давлению, при котором на 1 м2 поверхности нормально к ней действует сила в 1 ньютон. Используется также внесистемная единица измерения – 1 атмосфера (атм), равная давлению столба ртути высотой 760 мм (1 атм = 101325 Па). Часто давление измеряется просто в мм ртутного столба. При низких давлениях используют единицу 1 тор, равную 1 мм ртутного столба.
Идеальным газом будем называть газ, строго подчиняющийся эмпирическим законам Бойля-Мариотта, Шарля и Гей-Люссака. С молекулярно-кинетической точки зрения в таком газе можно пренебречь энергией взаимодействия молекул по сравнению с кинетической энергией их теплового движения. Эмпирические законы идеальных газов описывают изопроцессы, в которых один из трех термодинамических параметров остается постоянным. Во всех этих законах масса газа считается неизменной.
1.
Изотермический
процесс (![]() ).
).
![]() (закон
Бойля-Мариотта).
(закон
Бойля-Мариотта).
2.
Изохорический
процесс (![]() ).
).
![]() (закон
Шарля).
(закон
Шарля).
Здесь
![]() - давление газа при
- давление газа при
![]() ,
,
![]() град–1.
град–1.
3.
Изобарический
процесс (![]() ).
).
![]() (закон
Гей-Люссака),
(закон
Гей-Люссака),
![]() -
объем газа при
-
объем газа при
![]() .
.
Два последних закона можно записать в другом виде. Например, из закона Шарля следует
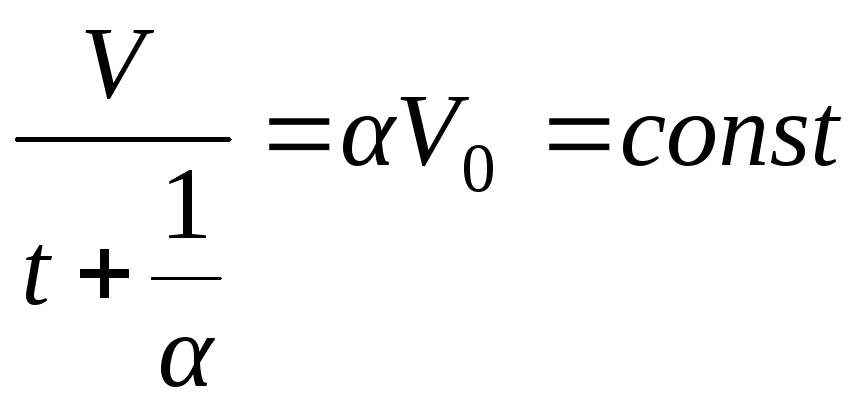 .
.
Отсюда становится понятным возникновение слагаемого 273,15 в определении абсолютной температуры. Таким образом законы Шарля и Гей-Люссака принимают вид
![]() ,
,
![]() .
.
Можно объединить эти три закона и записать их в виде уравнения Клапейрона
![]() при
постоянной массе газа.
при
постоянной массе газа.
Относительная молекулярная масса вещества
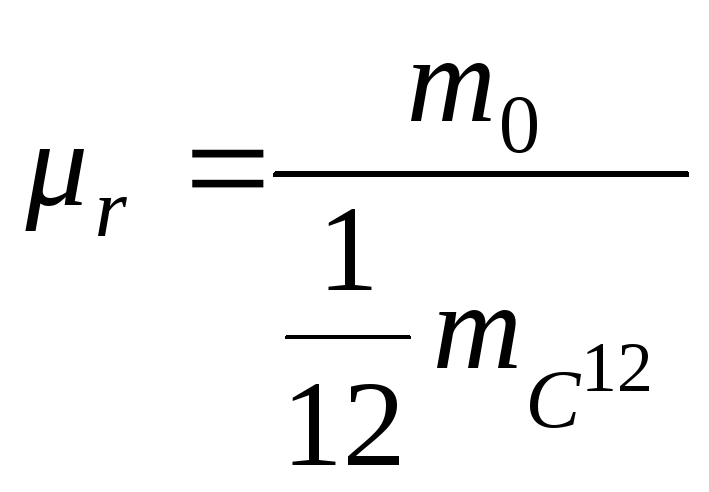 ,
,
где
![]() - масса молекулы данного вещества,
- масса молекулы данного вещества,
![]() -
масса атома изотопа углерода
-
масса атома изотопа углерода
![]() .
.
1 моль – количество вещества, масса которого выраженная в граммах численно равна его относительной молекулярной массе.
