shpora_fizika
.doc|
3 Давлением
света называется
давление, которое производят
электромагнитные световые волны,
падающие на поверхность какого-либо
тела. Существование такого давления
было предсказано Дж. Максвеллом в его
электромагнитной теории света. Если,
например, электромагнитная волна
падает на металл, то под действием
электрического поля волны с
напряженностью На
основании электромагнитной теории
Максвелл получил формулу для светового
давления.
|
31). Эффект Комптона Комптон исследовал упругое рассеяние коротковолнового рентгеновского излучения на свободных (или слабо связанных с атомами) электронах вещества. Открытый им эффект увеличения длины волны рассеянного излучения, названный впоследствии эффектом Комптона, не укладывается в рамки волновой теории, согласно которой длина волны излучения не должна изменяться при рассеянии. Опыт показал, что в рассеянном излучении наблюдается увеличение длины волны Δλ, зависящее от угла рассеяния θ: , Р После
многочисленных преобразований получаем
формулу Камптоновско смещения:
|
32). Модели атома Томсона и Резерфорда. Опыт Резерфорда. Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж. Томсону. Согласно этой модели (ещё называлась «булочка с изюмом»), атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10–10 м, внутри которого около своих положений равновесия колеблются электроны; суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно. В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда по рассеянию альфа-частиц в веществе. На основании своих исследований Резерфорд предложил ядерную (планетарную) модель атома. Исследование заключалось в прохождении альфа частиц сквозь металлическую фольгу. Согласно этой модели, вокруг положительного ядра, имеющего заряд Zе (Z — порядковый номер элемента в системе Менделеева, е — элементарный заряд), размер и массу, практически равную массе атома, в области с линейными размерами по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов. В результате оказалось, что большинство альфа частиц проходили или отклонялись на маленькое расстояние. В связи с этим, Резерфорд сделал вывод, что альфа частицы отклонялись лишь под действием положительно заряженных частиц атома и сосредоточены они в малом объёме.
|
|
33). Спектр атома водорода. Формула Бальмера. Постулаты Бора. Простейший из атомов, атом водорода явился своеобразным тест-объектом для теории Бора. Ко времени создания теории он был хорошо изучен экспериментально. Было известно, что он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен по модулю заряду электрона. Спектральная серия – совокупность спектральных линий, которые в своей последовательности и разделении интенсивности определяют определённую закономерность. Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра, были хорошо изучены количественно. Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра.
Для
серии Бальмера m = 2, n = 3, 4, 5, ... .
Для ультрафиолетовой серии (серия
Лаймана) m = 1, n = 2, 3, 4, ... Для
инфракрасной серии: серия Пашена
(m = 3, n = 4, 5, 6),
серия Брекета (m = 4, n = 5, 6, 7)
и так далее (серии Порунда и Хэмфри).
Постоянная R в
этой формуле называется постоянной
Ридберга.
Ее численное значение R = 3,29·1015 1-й
постулат (постулат стационарных
состояний):
атомная
система может находиться только в
особых стационарных или квантовых
состояниях,
каждому из которых соответствует
определенная энергия En. В
стационарных состояниях атом не
излучает. Для
стационарных орбит используется
условие квантования момента импульса
2-й постулат (правило частот): при переходе электрона из одного состояния в другое, атом поглощает излучение одного фотона, частота которого равна => hνnm = En – Em, , где h – постоянная Планка. |
||
|
36). Соотношение неопределенностей Гейзенберга Согласно
двойственной корпускулярно-волновой
природе частиц вещества, для описания
микрочастиц используются то волновые,
то корпускулярные представления.
Поэтому приписывать им все свойства
частиц и все свойства волн нельзя.
Естественно, что необходимо внести
некоторые ограничения в применении
к объектам микромира понятий классической
механики. В. Гейзенберг, учитывая
волновые свойства микрочастиц и
связанные с волновыми свойствами
ограничения в их поведении, пришел к
выводу, что объект микромира невозможно
одновременно с любой наперед заданной
точностью характеризовать и координатой
и импульсом. Согласно соотношению
неопределенностей Гейзенберга,
микрочастица (микрообъект) не может
иметь одновременно и определенную
координату (х,
у, z),
и определенную соответствующую
проекцию импульса (рх, pу, pz),
причем неопределенности этих величин
удовлетворяют условиям
|
||
|
|
||
|
34). Опыт Франка и Герца Существование дискретных энергетических уровней атома подтверждается опытом Франка и Герца. В опытах использовалась трубка (рис. 6.9), заполненная парами ртути и три электрода: катод, сетка и анод. Электроны ускорялись разностью потенциалов U между катодом и сеткой. Эту разность потенциалов можно было изменять с помощью потенциометра. Между сеткой и анодом было тормозящее поле (метод задерживающих потенциалов). О С Из опыта следует, что при увеличении ускоряющего потенциала вплоть до 4,86 В анодный ток возрастает монотонно, его значение проходит через максимум (4,86 В), затем резко уменьшается и возрастает вновь. Ближайшим к основному, невозбужденному состоянию атома ртути является возбужденное состояние, отстоящее по шкале энергий на 4,86 В. Пока разность потенциалов между катодом и сеткой меньше 4,86 В, электроны, встречая на своем пути атомы ртути, испытывают с ними только упругие соударения. При = 4,86 эВ энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути всю кинетическую энергию, возбуждая переход одного из электронов атома из нормального состояния в возбужденное. Электроны, потерявшие свою кинетическую энергию, уже не смогут преодолеть тормозящий потенциал и достигнуть анода. Этим и объясняется резкое падение анодного тока при = 4,86 эВ. При значениях энергии, кратных 4,86, электроны могут испытывать с атомами ртути 2, 3, … неупругих соударения. При этом они полностью теряют свою энергию и не достигают анода, т.е. наблюдается резкое падение анодного тока. Таким образом, опыт показал, что электроны передают свою энергию атомам ртути порциями, причем 4,86 эВ – наименьшая возможная порция, которая может быть поглощена атомом ртути в основном энергетическом состоянии. Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала проверку экспериментом. Атомы ртути, получившие при соударении с электронами энергию , переходят в возбужденное состояние и должны вернуться в основное, излучая при этом, согласно второму постулату Бора, квант света с частотой . По известному значению можно вычислить длину волны светового кванта: . Таким образом, если теория верна, то атомы ртути, бомбардируемые электронами с энергией 4,86 эВ, должны являться источником ультрафиолетового излучения с , что действительно обнаружилось в опытах. Таким образом, опыты Франка и Герца экспериментально подтвердили не только первый, но и второй постулат Бора и сделали большой вклад в развитие атомной физики. |
35). Гипотеза де Бройля и её экспериментальное подтверждение. Волна де Бройля. Волны де Бойля - волны, связанные с любыми микрочастицами и отражающие их волновую природу. Гипотеза де Бройля заключается в том, что французский физик Луи де Бройль выдвинул идею приписать волновые свойства электрону. Проводя аналогию между квантом, де Бройль предположил, что движение электрона или какой-либо другой частицы, обладающей массой покоя, связано с волновым процессом. Гипотеза
де Бройля устанавливает,
что движущейся частице, обладающей
энергией E и импульсом p, соответствует
волновой процесс, частота которого
равна:
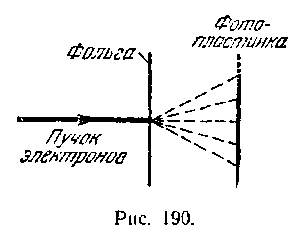
Гипотеза де-Бройля вскоре была блестяще подтверждена экспериментально. Дэвиссон и Джермер обнаружили, что пучок электронов, рассеивающийся от кристаллической пластинки, дает дифракционную картину. Томсон и независимо от него Тартаковский получили дифракционную картину при прохождении электронного пучка через металлическую фольгу. Опыт осуществлялся следующим образом (рис. 190). Пучок электронов, ускоренных разностью потенциалов порядка нескольких десятков киловольт, проходил через тонкую металлическую фольгу и попадал на фотопластинку. Электрон при ударе о фотопластинку оказывает на нее такое же действие, как и фотон. Полученная таким способом электронограмма золота сопоставлена с полученной в аналогичных условиях рентгенограммой алюминия. Сходство обеих картин поразительно. Штерн
и его сотрудники показали, что
дифракционные явления обнаруживаются
также у атомных и молекулярных пучков.
Во всех перечисленных случаях
дифракционная картина соответствует длине волны, определяемой соотношением (64.1). Из описанных опытов с несомненностью вытекает, что пучок микрочастиц определенной скорости и направления дает дифракционную картину, подобную картине, получаемой от плоской волны. |
37). Волновая функция и её свойства. Её физический смысл. Волнова́я
фу́нкция,
или пси-функция
где Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке пространства в данный момент времени считается равной квадрату абсолютного значения волновой функции этого состояния в координатном представлении. Физический смысл волновой функции. В
координатном представлении волновая
функция Тогда
в заданном квантовом состоянии системы,
описываемом волновой функцией
|
|
|
||
|
|
||
|
|
||
|
38). Уравнение Шредингера для стационарных состояний Основываясь
на основном
уравнением нерелятивистской квантовой
механики - временное уравнение
Шредингера в
уравнении
|
39). Движение свободной частицы Свободная частица — частица, движущаяся в отсутствие внешних полей. Так как на свободную частицу (пусть она движется вдоль оси х) силы не действуют, то потенциальная энергия частицы U(x) = const и ее можно принять равной нулю. Тогда полная энергия частицы совпадает с ее кинетической энергией. В таком случае уравнение Шредингера для стационарных состояний примет вид
П Функция (здесь |
40). Частица в одномерной потенциальной яме Стационарным состояниям частицы, запертой в потенциальной яме, соответствует дискретный набор длин волн. Поскольку в квантово-механическом случае длина волны λ однозначно связана с импульсом частицы: λ = h / p, а импульс частицы определяет энергию ее движения: E = p2 / (2m)(нерелятивистское приближение), то квантованной оказывается и энергия частицы. Квантово-механический расчет приводит к следующему выражению:
З Действительно,
у покоящейся частицы импульс строго
равен нулю, следовательно, Δpx = 0.
В то же время неопределенность
координаты частицы Δx ≈ L.
Поэтому произведение Δx · Δpx у
частицы, лежащей на дне потенциальной
ямы, должно было бы равняться нулю.
Соотношение неопределенностей
позволяет сделать оценку минимальной
энергии E1 частицы.
Если принять, что в состоянии с
минимальной энергией px ≈ Δpx,
то для минимальной энергии E1 получается
выражения
|
|
|
||
|
|
||
|
|

 ассмотрим
упругое столкновение двух частиц –
налетающего фотона, обладающего
энергией E0 = hν0 и
импульсом p0 = hν0 / c,
с покоящимся электроном, энергия покоя
которого равна
ассмотрим
упругое столкновение двух частиц –
налетающего фотона, обладающего
энергией E0 = hν0 и
импульсом p0 = hν0 / c,
с покоящимся электроном, энергия покоя
которого равна  огласно
боровской теории, каждый из атомов
ртути может получить лишь вполне
определенную энергию, переходя в одно
из возбужденных состояний. Поэтому
если в атомах действительно существуют
стационарные состояния, то электроны,
сталкиваясь с атомами ртути, должны
терять энергию дискретно, определенными
порциями,
равными разности энергии соответствующих
стационарных состояний атома.
огласно
боровской теории, каждый из атомов
ртути может получить лишь вполне
определенную энергию, переходя в одно
из возбужденных состояний. Поэтому
если в атомах действительно существуют
стационарные состояния, то электроны,
сталкиваясь с атомами ртути, должны
терять энергию дискретно, определенными
порциями,
равными разности энергии соответствующих
стационарных состояний атома.