
- •1. Основные положения и основное уравнение молекулярно-кинетической теории газов.
- •2. Уравнение Клапейрона-Менделеева. Изотермический, изохорический, изобарический процессы.
- •3. Уравнение переноса. Диффузия. Закон Фика.
- •4. Уравнение переноса. Теплопроводность. Закон Фурье.
- •5. Уравнение преноса. Внутреннее трение. Закон Ньютона.
- •6. Внутренняя энергия идеального газа. Теплоемкость.
- •7. Распределение молекул по скоростям. Наиболее вероятная, среднеарифметическая и среднеквадратичная скорости движения молекул.
- •8. Эффективный диаметр молекулы. Средняя длина свободного пробега молекул.
- •9. Барометрическая формула. Распределение Молекул по их энергиям.
- •10. Первое начало термодинамики и его применение к изотермическому процессу. Работа и теплоемкость при изотермическом процессе.
- •11. Первое начало термодинамики и его применение к изохорическому процессу. Работа и теплоемкость при изохорическом процессе.
- •12. Первое начало термодинамики и его применение к изобарическому процессу. Уравнение Майера. Работа при изобарическом процессе.
- •17. Экспериментальные изотермы реального газа. Критическая температура. Уравнение Ван-дер-Ваальса. Физический смысл поправок а и b.
- •18. Характеристика жидкого состояния вещества. Поверхностное натяжение. Формула Лапласа. Капиллярные явления.
- •19. Оптическая длина пути и оптическая разность хода. Интерференция световых волн.
- •20. Дифракция световых волн. Метод зон Френеля.
- •21. Естественный и поляризованный свет. Закон Малюса.
- •22. Поляризация света при отражении и преломлении. Закон Брюстера.
- •23. Естественный и поляризованный свет. Вращение плоскости поляризации.
- •24. Энергетическая светимость. Поглощательная способность. Абсолютно черное тело. Закон Кирхгофа.
- •25. Зависимость спектральной плотности энергетической светимости от длины волны и температуры. Закон смещения Вина.
- •26. Зависимость спектральной плотности энергетической светимости от длины волны и температуры. Закон Стефана-Больцмана.
- •27. Фотоэлектрический эффект. Уравнение Эйнштейна для фотоэффекта.
- •28. Энергия, импульс, масса фотона. Эффект Комптона.
- •29. Модель атома Бора. Постулаты Бора. Теория водородоподобного атома Бора.
- •30. Корпускулярно-волновой дуализм материи. Формула де Бройля. Соотношение неопределенностей Гейзенберга.
- •31. Волновая функция. Уравнение Шредингера.
- •32. Строение атомного ядра. Энергия связи. Дефект массы атомного ядра. Ядерные реакции.
- •33. Естественная радиоактивность. Α, β, γ излучения. Закон радиоактивного распада.
12. Первое начало термодинамики и его применение к изобарическому процессу. Уравнение Майера. Работа при изобарическом процессе.
При этом процессе часть тепла идет на изменение внутренней энергии, остальная часть на работу против внешних сил. Первое начало имеет вид: Q=dU+A=m/*i/2*R*dT+p*dV
Работа при изобарическом процессе: A=p(V2-V1)=pΔV
Удельная теплоемкость при p=const: Сp=dQ/mdT=(dU+A)/mdT=i*R/2+R/
Молярная теплоемкость: cp= dQ/(m/*dT)=cv+dA/(m/*dT)
Уравнение Майера: cp=cv+R
13. Адиабатный процесс. Уравнение Пуассона.
Процесс без теплообмена с внешней средой. dQ=0
Первое начало: -dQ=dA
Уравнение Пуассона: TV-1=const; pV=const; =Cp/Cv=i+2/I Для одноатомного газа =1.67, для двухатомного=1.4, для многоатомного=1.33
14. Адиабатный процесс. Работа, совершаемая идеальным газом при адиабатном процессе.
Процесс без теплообмена с внешней средой. dQ=0
A=p(V)dV=const dV/V
A=m/*i/2*R(T1-T2)
15. Тепловая машина, работающая по циклу Карно и ее коэффициент полезного действия.
Рассмотрим работу идеальной тепловой машины, совершающей цикл Карно, состоящей из 2х изотерм и 2х адиабат:
1-2 – изотермический. A=m/*R*T1*lnV2/V1
2-3 – адиабатический. A= m/*R*T1*(1/-1)(1-(V2/V1)-1)
3-4
A= -m/*R*T2*lnV3/V4
4-1 A= -m/*R*T1*(1/-1)(1-(V1/V4)-1)
Суммарная работа: A=m/*R(T1-T2)*lnV2/V1
КПД цикла Карно равен отношению полезной работы к затраченной
=A/Q1 = (T1-T2)/T1 = (Q1-Q2)/Q1 = 1-T2/T1 = 1-Q2/Q1
16. Приведенное количество теплоты. Энтропия и ее свойства. Неравенство Клаузиуса.
Приведенное количество теплоты – отношение теплоты к температуре, при котором происходит передача тепла. т.к Q2<0, то Q1/T1+Q2/T2=0 Т.о сумма, приведенных тепло для цикла Карно =0.
dQ/T=dS. Физический смысл – изменение энтропии, равное приведенному количеству тепла необходимому для перевода системы из состояния 1 в состояние 2. SB-SA=ΔS=∫σS/T
Свойства энтропии.
1. Энтропия системы тел = сумме энтропий этих тел S=S1+S2+…+Sn
2.ΔS=0 для обратимых процессов
3. ΔS>0 для необратимых
4. ΔS>=0 неравенство КЛАУЗИУСА.
Энтропия связана с термодинамической вероятностью соотношением S=K*ln Wт; Wт-т/д-кая вероятность.
17. Экспериментальные изотермы реального газа. Критическая температура. Уравнение Ван-дер-Ваальса. Физический смысл поправок а и b.
Учитывая размеры молекул и силы межмолекулярного взаимодействия Ван-дер-Ваальс ввел поправки а и b в уравнение Менделеева-Клапейрона и получил приближенное ур-е реального газа:
1.т.к. молекулы имеют объем, то свободный объем V, в котором могут передвигаться молекулы будет меньше на величину *b; b – учет вверенный объем молекул в одном моле вещества. b= 4V0NA; V0=1/6πd3- объем молекулы; NA-число молекул в 1 моле
2. Кроме внешнего давления Р, которое оказывают молекулы на стенки сосуда возникает добавочное (внетр) давление р|, обусловленное взаимодействием молекул (притяжение или отталкивание).
(р+р|)(V-b)=RT
p|=2(a/V2)
(p+2(a/V2))(
V-b)=RT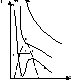
Изотерма реального газа.
T1>Tк>T2
1-3 и 4-6 давление увеличивается
3-4 сжаните ведет к уменьшению давления
Тк-газ, Т<Тк – пар
1-2 сжимаем пар, давление увеличивается
2-5 сжатие пара, не изменяется давление. Происходит распад вещества на 2 фазы: пар и жидкость. Пар, находящийся в т/д равновесии с жидкостью называется насыщенным.
5-6 сжатие жидкости приводит к увеличению давления.
Критическая изотерма (пунктирная линия) делит диаграмму на 3 области: жидкость, пар, газ).
