
chast_2
.pdf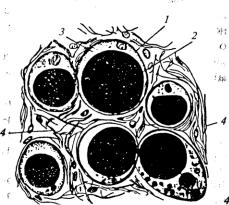
При нагревании препаратов коллагена с водой до 58...65 °С коллагеновые волокна резко (примерно на 1/3) сокращаются. При этом, по-видимому, разрушаются только связи, удерживающие полипептидные цепочки в направлении продольной оси структуры коллагена. Происходят неупорядоченное изгибание и скручивание полипептидных цепей, а также разрыв части преимущественно водородных связей в молекуле коллагена. Это явление называется свариванием коллагена. Сваренный коллаген более доступен действию пепсина. Его прочность резко снижается: например, сопротивление резанию соединительной ткани с большим содержанием коллагена падает до 0,067 МПа, то есть в 6 раз.
При дальнейшем осторожном нагреве коллагена полностью разрываются водородные и солевые связи, удерживающие полипептидные цепочки в структуре коллагена, без заметного изменения связей внутри цепей. Этот процесс, протекающий с участием воды, известен под названием пептизация коллагена. Продукт пептизации, состоящий из нескольких связанных с друг с другом полипептидных цепочек, называется глютином.
Практически одновременно с образованием глютина происходит гидролитический распад части полипептидных цепочек на более мелкие звенья, в совокупности образующие полидисперсный продукт гидролиза глютина — смесь желатоз (глютоз).
Тщательное механическое разрушение коллагена в воде приводит к нарушению структуры коллагена по плоскостям расположения водородных и солевых связей. Происходи разволокнение коллагена на полипептидные цепочки и образуется продукт сходный с желатином.
Эластин не содержит триптофана, и в нем очень мало метионина и гистидина. Он почти не переваривается пепсином, медленно — трипсином и сравнительно легко — эластазой. Он очень устойчив к действию химических реагентов, не изменяется в растворах кислот и щелочей, выдерживает длительный нагрев при 125 0С. Следовательно, эластин практически не имеет какой-либо пищевое ценности.
Жировая ткань
Жировая ткань представляет собой разновидность рыхлой соединительной ткани, в клетках которой содержится значительное количество нейтрального жира, В соединительной ткани они располагаются в одиночку или небольшими группами, в жировой — скапливаются в большие массы. Размеры жировых клеток достигают 120 мкм. Они обладают обычными для клеток структурными элементами, но их центральная часть заполнена жировой каплей, а протоплазма и ядро оттеснены к периферии (рис. 11.8). Жировые капли представляют собой сложную дисперсионную систему, образованную жиром и обводненной фазой. Наряду с жирами в составе жировой ткани содержатся различные липоиды (преимущественно фосфатиды). Но количество их не превышает долей процента.
В соответствии с распределением соединительной ткани в мясе различают внутримышечную, межмышечную и поверхностную жировую ткань. В мясе упитанных животных (крупного рогатого скота и свиней) жировая ткань как бы прослаивает мышечную, образуя на разрезе так называемую мраморность.
Рис. 11.8. Жировая ткань:
1 — жировая клетка;
2 — жировая капля;
3 — протоплазма;
4 — волокна соединительной ткани
51

Пищевая ценность жировой ткани определяется свойствами содержащихся в ней жиров и в известной степени пищевой ценностью липоидов.
Природные жиры скота и птицы представляют собой сложные смеси, главными компонентами которых являются глицериды, т. е. сложные эфиры глицерина и жирных кислот, преимущественно триглицериды типа
Здесь R1, R2, R3 — радикалы жирных, главным образом высших кислот, свойства и расположение в структуре молекулы которых решающим образом влияют на специфические особенности различных жиров и их пищевую ценность. Содержание в жирах ди- и моноглицеридов незначительно и непостоянно.
Биологическая ценность жиров обусловлена, во-первых, тем, что они служат носителями больших запасов энергии. Калорийность жиров превышает калорийность белков и углеводов и достигает 39 кДж на 1 г жира. В этом отношении животные жиры независимо от содержания в их составе радикалов насыщенных и ненасыщенных кислот мало отличаются друг от друга.
Во-вторых, жиры необходимы для всасывания в кишечнике жирорастворимых витаминов, поэтому при недостаточном их количестве в пище наблюдаются авитаминозы. Животные жиры и сами являются носителями небольших количеств некоторых жирорастворимых витаминов (A, D и Е).
И, наконец, биологическая ценность жиров зависит от содержания в них радикалов высоконенасыщенных жирных кислот с двумя и более двойными связями, разделенными метиленовым звеном с числом углеродных атомов 18 и более. Эти кислоты не синтезируются организмом в необходимых количествах. К ним относятся линоленовая (две двойные связи), линолевая (три двойные связи) и арахидоновая (четыре двойные связи).
Таб.11.5. Содержание радикалов ненасыщенных жирных кислот в животных жирах (%)
Жир |
Олеиновая |
Линолевая |
Линоленовая |
Арахидоновая |
Пантотеновая |
|
|
|
|
|
|
Говяжий: |
|
|
|
|
|
внутримышечный |
42,6 |
1,1 |
0,3 |
0,2 |
0,1 |
межмышечный |
41,9 |
1,2 |
0,2 |
— |
|
поверхностный |
44,9 |
1,1 |
0,2 |
— |
— |
Свиной:. |
|
|
|
|
|
внутримышечный |
45,2 |
4; 2 |
0,4 |
0,4 |
0,1 |
межмышечный |
44,9 |
6,8 |
0,4 |
0,4 |
|
поверхностный |
43,3 |
7,4 |
0,4 |
0,2 |
0,1 |
Бараний: |
|
|
|
|
|
внутримышечный |
41,6 |
2,7 |
1,5 |
0,8 |
0,7 |
межмышечный |
33,2 |
1,5 |
0,8 |
0,1 |
0,1 |
поверхностный |
34,8 |
1,7 |
0,7 |
0,1 |
0,1 |
Куриный |
29,5 |
18,2 |
1,0...1,5 |
0,6...1,5 |
|
поверхностный |
|
|
|
|
|
Гусиный |
31...41 |
19...35 |
0,4 |
0,05 |
|
поверхностный |
|
|
|
|
|
Утиный |
42 |
24 |
1,4 |
0,2 |
|
поверхностный |
|
|
|
|
|
Индюшиный |
36...48 |
17...32 |
0,7...1,3 |
0,2...1,7 |
|
поверхностный |
|
|
|
|
|
|
|
|
|
|
|
52
Жиры, содержащие большее количество радикалов ненасыщенных кислот, в большей степени способствуют усвоению организмом белкового азота. Характеристика биологической ценности отдельных видов животных жиров, входящих в состав мяса, приведена в табл. 11.5.
Фосфатиды внутримышечной жировой ткани содержат значительно больше радикалов высоконепредельных жирных кислот, чем триглицериды.
В процессе усвоения пищи около 20...25 % жира гидролизу-ется под действием панкреатического сока. Остальной жир всасывается стенками кишечника в нейтральном состоянии. Расщепление жира и его всасывание требуют эмульгирования его в водной среде до достижения частицами размера менее 0,5 мкм с отрицательным зарядом, поэтому усвояемость жиров зависит от их способности образовывать эмульсии в водной среде, что, в свою очередь, связано с их температурой плавления. Жиры с температурой плавления ниже температуры тела хорошо усваиваются, так как, попадая в организм, они целиком переходят в жидкое состояние и легко эмульгируются.
При большом содержании жира в пище он тормозит отделение желудочного сока и препятствует перевариванию белков до перехода в кишечник. И в этом случае большое значение имеет способность жира эмульгироваться. Таким образом, количество и свойства жира, содержащегося в пище, влияют на усвояемость белковых веществ. Вместе с тем жир, возбуждая панкреатическую железу, обеспечивает выделение панкреатического сока, необходимого для переваривания не только самого жира, но и белковых веществ.
Кости
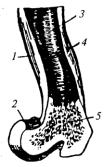
Костная ткань отличается сильноразвитым межклеточным (основным) веществом, состоящим из органической, неорганической частей и воды. В основном веществе расположены костные клетки и проходят кровеносные сосуды. В кости различают наружный слой, состоящий из так называемого плотного вещества, и внутренний, менее плотный, состоящий из губчатого вещества (рис. 11.9).
Вкостях сложного профиля и кулачках трубчатой кости плотный слой незначителен.
Вплоских костях он намного толще и иногда превосходит губчатый слой. Трубка трубчатой кости почти целиком состоит из плотного вещества. Плотное и губчатое вещества построены из окостеневших пластинок, образованных небольшими пучками коллагеновых фибрилл. В губчатом веществе пластины расположены менее упорядочение и образуют многочисленные мельчайшие поры, в которых находится красный костный мозг. Снаружи кость покрыта соединительнотканной оболочкой — надкостницей, а поверхность кулачков — хрящевым слоем.
Главный органический компонент основного вещества кости — коллаген (оссеин), составляющий 24...34 % массы сухой обезжиренной кости. Основное вещество содержит от 30 до 65 % минеральных составных частей. Около 70 % минеральных веществ приходится на фосфорнокислый кальций и около 10 % — на углекислый кальций.
Рис. 11.9. Разрез трубчатой кости:
1— диафиз (трубка);
2— эпифиз (кулачок);
3— полость трубки;
4— плотное вещество;
5— губчатое вещество
53
В соответствии с особенностями строения и состава различных костей, характером использования и особенностями технологической обработки их подразделяют на три группы: трубчатые кости (бедренная, берцовая, плечевая, предплечье, пястная, плюсневая); паспортная кость (плоские кости) и рядовая кость (кости сложного профиля и кулачки трубчатой кости).
Средняя часть трубчатой кости — трубка, или диафиз (см. рис. 11.9), состоящая в основном из плотного вещества, заполнена костным мозгом (около 17...22 % массы трубки без кулачков). Сама костная ткань трубки богата коллагеном, но содержит мало жира. Жир в этой части кости находится преимущественно в составе костного мозга, содержащего 84...95 % липидов, 1,2...2,4 — белка, 4... 12 % воды. В липидной фракции около 99,5 % жира, 0,19 — фосфатидов, 0,31 % холестерина. Соотношение количеств основных жирных кислот в жирах и фосфатидах желтого костного мозга примерно следующее: пальмитиновая — 7,8 %, стеариновая — 14,2, олеиновая — 78 %.
Кулачки, или эпифизы, образованы в основном губчатой тканью и лишь на поверхности состоят из плотной ткани. Мельчайшие полоски губчатой ткани заполнены красным мозгом (жировыми клетками, содержащими около 92 % липидов, в составе которых около 99,5 % жира, 0,21 — фосфатидов, 0,28 % холестерина). Соотношение количеств основных жирных кислот в составе красного костного мозга примерно следующее: пальмитиновой — 16,4 %, стеариновой — 35,2, олеиновой — 48,4 %.
Паспортная кость состоит главным образом из плотной ткани. Внутри имеется небольшой слой губчатой ткани. Плотная ткань богата коллагеном (около 93 % к общему количеству белков) и поэтому служит хорошим сырьем для производства желатина. К паспортной кости относятся плоские кости скелета: кости черепа, челюсти, кости таза, лопатки, опиленные ребра, а также отходы трубчатой кости.
Строение рядовой кости аналогично строению эпифизов; это кости сложной конфигурации: позвонки, запястья, предплюсны, путовой сустав и пальцы, носовые раковины черепа.
Содержание жира в костях неодинаково, иногда оно довольно велико (табл. 11.6). Состав кости заметно зависит от упитанности скота: с повышением упитанности
содержание жира и минеральных веществ несколько увеличивается и уменьшается содержание воды. В позвонках это же наблюдается в направлении от головы к задней части туши. В головке ребер больше жира и воды и меньше минеральных веществ, чем в их теле. Трубчатые кости задних конечностей содержат несколько больше жира и коллагена, чем трубчатые кости передних конечностей.
Содержание коллагена в кости зависит от вида скота, его пола, возраста и упитанности. Большое значение имеет анатомическое
происхождение кости. Плотное вещество кости богаче коллагеном, чем ее губчатая кость, поэтому в костях, где плотная ткань преобладает, коллагена больше, а других белковых веществ меньше.
Пищевое и промышленное значение костной ткани вытекает из ее свойств и химического состава. Диафиз трубчатой кости — отличное сырье для поделок. Остальная кость для этих целей непригодна. В составе кости от 10 до 25 % жира, большая часть которого может быть выделена вываркой в воде или другим способом. Коллаген кости также может быть извлечен горячей водой в виде глютина.
54

Таб.11.6. Химический состав мясных пищевых костей
Название кости |
Жир |
|
|
Коллаген |
Прочие |
Зола |
Вода |
||
|
|
|
|
|
|
белки |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Крупный рогатый скот |
|
|
|
|
|||
Позвоночник |
|
12.. 30 |
|
4. |
.8 |
20.. .30 |
30...41 |
||
|
|
10...15 |
|||||||
Грудная кость |
|
13.. 16 |
|
8...10 |
8.. |
11 |
14.. .17 |
48...53 |
|
Тазовая кость |
|
22...24 |
|
12...15 |
4. |
.5 |
30.. .33 |
24...30 |
|
Лопатка |
|
14.. 15 |
|
16...17 |
3. |
.4 |
44.. .45 |
19...20 |
|
Ребра |
|
10.. 11 |
|
14...16 |
5. |
.6 |
36.. .40 |
28...31 |
|
Трубчатая кость: |
> |
|
|
|
|
|
|
|
|
диафизы |
,. |
13.. |
24 |
|
14...17 |
3. |
.6 |
40.. .50 |
15...23 |
эпифизы |
,... „ |
18.. |
33 |
|
11...16 |
3. |
.5 |
28.. .36 |
17...32 |
Черепная кость |
|
6.. |
9 |
|
11...14 |
6. |
.9 |
26. .29 |
40...47 |
Нижняя челюсть |
|
8.. |
9 |
|
13...15 |
4. |
..5 |
47. .49 |
20...25 |
Цевочная кость |
|
|
|
|
|
|
|
|
|
(пястная и плюсневая): |
|
|
|
|
|
|
|
|
|
диафизы |
|
7.. |
8 |
|
14...17 |
4. |
..8 |
43. .50 |
20...25 |
эпифизы |
|
15.. |
16 |
|
14...16 |
2. |
..4 |
36. .40 |
24...31 |
Путовой сустав |
|
20.. |
22 |
|
— |
|
|
|
— |
(кости копыта) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Свиньи |
|
|
|
|
|
Ребра, позвоночник, |
17...25 |
|
|
|
16 |
43 |
|||
|
20 |
|
|
||||||
грудная и крестцовая |
|
|
|
|
|
|
|
|
|
кости |
|
|
|
|
|
|
|
|
|
Кости головы |
|
15 |
|
|
22 ,,-; |
|
|
21 |
42 |
Лопатка, тазовая |
|
17 |
|
|
— |
|
|
|
— |
кость |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ВЛИЯНИЕ СПОСОБОВ И РЕЖИМОВ ТЕПЛОВОЙ ОБРАБОТКИ МЯСА И МЯСОПРОДУКТОВ НА ИЗМЕНЕНИЕ ИХ ФИЗИКО-ХИМИЧЕСКИХ
ПОКАЗАТЕЛЕЙ И БИОЛОГИЧЕСКОЙ ЦЕННОСТИ
Изменение белков мяса в процессе нагрева
Белковая молекула при нагреве подвергается сложным физико-химическим изменениям, прежде всего денатурации и коагуляции, глубина которых зависит от температуры, продолжительности тепловой обработки и некоторых других факторов. При изучении всех классов белков необходимо установить уровни организации их макромолекулярной структуры. По терминологии Линдерштрема-Ланга и Бернала эти уровни принято именовать первичной, вторичной, третичной и четвертичной структурами белка. Под первичной структурой понимают вид, число и последовательность соединения аминокислотных остатков в полипептидной цепи белка, под вторичной — взаимосвязь и характер спирализации полипептидных цепей, под третичной — закономерное свертывание цепей, обладающих вторичной структурой в макромолекуле, под четвертичной — агрегацию макромолекул.
Любое изменение, рассматриваемое как взаимодействие белков друг с другом, предполагает предварительное разрушение этих связей, которыми они удерживаются в системе, и замену их другими. Образование новых случайных структур в сложных белковых системах представляется как следствие замены лабильных связей между белковыми частицами более стабильными связями. Если воздействие тех или иных факторов приводит к разрушению третичной или четвертичной стриктуры, то ослабляется защитное действие гидратационных слоев вблизи полярных группировок и образование новых более прочных структур становится неизбежным. Уменьшение гидрофильной и увеличение гидрофобной способности и, следовательно, снижение
55
защитного (стабилизирующего) действия гидратационных слоев вблизи полярных группировок происходят в результате внутримолекулярной перестройки белковой молекулы при денатурации. В этих условиях происходит агрегирование белковых частиц за счет межмолекулярных сил и коагуляция белка.
В свете подобных представлений рассмотрим вопрос о сущности и механизме денатурации белков. Денатурация, по мнению Жоли, — это любая модификация вторичной, третичной или четвертичной структуры белковой молекулы, за исключением разрыва ковалентных связей.
Влияние температуры и способа нагрева на скорость и температуру денатурации белков
Скорость тепловой денатурации зависит от температуры, влажности, способа нагрева и других факторов.
Денатурация тормозится при добавлении определенных веществ, таких, как пирофосфат, многоатомные спирты, сахара и F-актин, хотя механизмы торможения различны. Скорость денатурации АТФазы увеличивается при расщеплении мышечного протеина в результате уменьшения размера, плотности и симметрии молекул. Скорость денатурации белков зависит и от некоторых других факторов. Например, денатурация фибриногена мочевиной ускоряется при увеличении концентрации мочевины и при понижении рН ниже 7, однако в интервале рН 7,0...8,6 скорость реакции почти постоянна.
Присутствие тяжелой воды стабилизирует нативную структуру ферментов, обусловленную наличием водородных связей, уменьшая скорость инактивации.
В настоящее время установлено, что белки, входящие в состав мяса, денатурируют по мере достижения определенной для каждого белка температуры. Наиболее чувствителен к нагреву миозин. Температура денатурации, °С: миозина — 45...50, актина — 50, актомиозина — 42...48, миоальбуминов — 45...47, глобулина— 50, миогена — 50...60, коллагена — 58...62, миопротеидов — около 100. В интервале температур 45...50 °С денатурирует основная часть структурных белков мышц. Саркоплазматические белки (миоген и миоглобин) денатурируют при более высоких температурах (55...65 °С). Наиболее устойчивы к денатурации миопротеиды (большая часть ферментов), а также гемоглобин, сывороточный альбумин, коллаген.
Установлено, что денатурация происходит ступенчато, т. е. при достижении белком определенной температуры он приобретает соответствующую структуру с определенными свойствами. Согласно данным М. А. КалейджИева, денатурация сывороточного альбумина кролика осуществляется через три ступени. Зегель показал, что денатурация кристаллического альбумина проходит через 4 ступени: первая студень наступает при температуре 60 °С, вторая — 61...65, третья яе\ш между 65 и 80, четвертая
— при температуре выше 85 °С.
Изменение заряженные групп и рН белков
впроцессе тепловой обработки мяса
Впроцессе тепловой денатурации и последующей коагуляции происходят структурные изменения белков, разрыв прежних и образование новых связей при участии водородных связей, сульфгидрильных, дисульфидных, кислых и основных групп белков и гидрофобных взаимодействий.
Р. Гамм показал, что нагрев мяса в воде от 20 до 70 °С вызывает ступенчатое уменьшение числа карбоксильных групп в белках миофибрилл при существенно не изменяющемся количестве основных групп. Достоверные изменения кислых групп начинаются при температуре 40 °С. В интервале 40...50 °С количество их снижается, при 50...55 °С оно остается неизменным. При температуре выше 55 °С число кислых групп продолжает уменьшаться, а при температуре около 60 °С оно уменьшается очень значительно. Общее снижение числа кислых групп при нагревании до 70 °С составляет
56
85 %. При температуре От 70 до 120 °С наряду с дальнейшим сокращением числа кислых групп начинается уменьшение числа основных.
Изменение соотношения заряженных (кислых и основных) групп в результате денатурации и постденатурационных превращений связано с изменением рН. В тоже время установлен факт прямой корреляционной зависимости между значением рН сырья, водоудерживающей способностью и выходом готового продукта. Чем выше исходное значение рН сырья, тем лучше качество (сочность) готового продукта. Величина изменений рН зависит от температуры и способа нагрева, исходного значения рН сырого мяса.
На величину смещения рН влияет также анатомическое происхождение мышц.
С повышением температуры нагрева изменяется водоудерживающая способность и сдвигается изоточка фибриллярных белков к более высоким значениям рН, увеличивается число основных групп. При тепловой денатурации происходит также сдвиг изоточки к более высоким значениям рН, видимо вследствие расщепления водородных связей и освобождения дополнительных положительных зарядов.
Изменение растворимости мышечных и дезагрегация соединительнотканных белков в процессе нагрева мяса
Растворимость белков - один из показателей, характеризующих их денатурационные изменения. Известно, что нагрев сопровождается уменьшением растворимости белков. Разорвавшиеся при денатурации внутримолекулярные связи взаимодействуют межмолекулярно, в результате чего происходит агрегирование частиц. Иными словами, денатурационные изменения макромолекул белка, изменяя поверхностный слой молекул, ведут к нарушению соотношения гидрофильных и гидрофобных группировок в сторону повышения последних, что и приводит к уменьшению растворимости.
При традиционных методах нагрева впадение саркоплазматических белков наблюдается при температуре около 40 0С, причем наиболее сильно - при рН 5,5.
Основная масса этих белков коагулирует в интервале 55...65 °С. |
|
Имеются сведения о наличии термостойких белков |
например, аденилкиназа |
выдерживает температуру около 100 0С.
Изменение коллагена под воздействием тепла - сложный процесс, складывающийся из двух этапов: сваривания и гидролиза коллагена. Коллаген является гликопротеидом, в котором содержание ковалентно связанных углеводов варьирует в зависимости от источника получения белка.
Растворимая часть коллагена – проколлаген и нерастворимая - колластромин различаются температурами денатурации и характером денатурационных превращении. Денатурация коллагена протекает двухстадийно и заканчивается при температуре 36,5 0С, образуя при этом гомогенную прозрачную массу, переходящую в раствор.
Колластромин |
переходит |
в |
гомогенное |
состояние |
при |
6олее |
высокой температуре или при более длительном тепловом воздействии. |
|
|
||||
Винтервале температур 62...64 0С при нагреве в воде происходит мгновенное сморщивание коллагеновых волокон, которые складываясь втрое по отношению к своей первоначальной длине, превращаются в резиноподобную массу. В процессе сморщивания трехспиральная структура пептидных цепей отдельных молекул коллагена приобретает форму клубка. Однако неструктурированные пептидные цепи еще связаны ковалентными связями и не могут перейти в раствор.
Врезультате влажного нагрева коллагенсодержащих тканей образуются полидисперсные продукты распада. При медленном нагреве преобладают высокомолекулярные соединения, при интенсивном — соединения с меньшей молекулярной массой. При сваривании коллагена в раствор переходит около 60 % содержащихся в ткани мукоидов.
57
На дезагрегацию коллагена в процессе нагрева влияют и некоторые другие факторы. Смещение рН мяса от изоэлектрической точки усиливает дезагрегацию, увеличение возраста животных от одного до полутора лет снижает ее примерно в 2 раза.
Таким образом, степень дезагрегации коллагена и образование продуктов распада зависят не только от температуры, до которой нагревается продукт, состояния и состава мяса, но и от скорости, а, следовательно, и способа нагрева.
Коагуляция белков и ее влияние на качественные изменения и структуру мясопродуктов
Процесс нагрева белков сопровождается развертыванием глобул и высвобождением свободных радикалов, в связи, с чем возникает возможность образования межмолекулярных связей, агрегации частиц и их осаждения, что ведет к уменьшению растворимости белков.
Внутренняя перестройка белковой молекулы — собственно денатурация — проявляется в агрегировании полипептидных цепей. Процесс агрегирования протекает в две стадии: укрупнение размеров частиц без выхода из раствора и последующая коагуляция. Агрегация денатурированных белковых молекул, или изменение их четвертичной структуры, являющаяся следствием предшествующей перестройки вторичной и третичной структур, сопровождается сокращением лиофильных центров белковой молекулы и снижением водоудерживающей способности мяса. Агрегация и коагуляция белков определяют образование непрерывного пространственного каркаса готового продукта.
Перестройка белковой молекулы при денатурации ухудшает гидрофильные и усиливает гидрофобные свойства ткани, следовательно, защитное (стабилизирующее) действие гидратационных слоев вблизи полярных группировок ослабляется. Внутримолекулярные связи заменяются межмолекулярными, образуется нерастворимый сгусток, т. е. происходит коагуляция белков (из разбавленных растворов выпадают хлопья, из концентрированных — коагель).
Процесс денатурации белков сопровождается разрушением структуры воды, вследствие чего действующие между протофибриллами вторичные силы (силы Ван-дер- Ваальса) придают молекуле миозина более компактную форму, при этом выделяется часть жидкости.
В результате денатурации и коагуляции мышечных белков прочностные свойства мяса возрастают, а сваривание коллагена и последующий его гидролиз, напротив, их ослабляют.
ИЗМЕНЕНИЕ ЖИРОВ ПРИ НАГРЕВЕ МЯСА
Тепловая обработка мяса и мясопродуктов вызывает разрушение сложной внутриклеточной коллоидной системы, в составе которой содержится жир. Он при этом плавится, а затем коалесцирует, образуя в клетке гомогенную фазу в виде капли. Если жировые клетки были разрушены до тепловой обработки или разрушаются в процессе нагрева, расплавленный жир оттекает, сливаясь в единую объемную фазу. В тех случаях, когда нагрев происходит в водной среде, небольшая часть жира образует с водой эмульсию.
При достаточно длительном нагреве с водой (в том числе с внутриклеточной) жир претерпевает существенные химические изменения, при умеренном — они невелики, но легко обнаруживаются. В табл. 11.7 показаны изменения некоторых характеристик говяжьего жира, который нагревали с водой при 100 °С в течение 1 ч в присутствии небольшого количества натрия хлорида.
58
Таб.11.7. Влияние влажного нагрева жира на изменения некоторых его качественных характеристик
Состояние жира |
|
Число |
|
|
|
|
|
|
Кислотное |
Йодное |
Ацетильное |
|
|
|
|
До нагрева |
1,01 |
34,0 |
7,2 |
После нагрева |
1,26 |
32,2 |
21,0 |
|
|
|
|
Таб.11.8. Изменение кислотного числа жира под влиянием высокотемпературного нагрева
Продолжительность |
Кислотное число жира при температуре, 0С |
|
нагрева, ч |
|
|
|
120 |
130 |
|
|
|
7 |
0,64 |
0,98 |
8 |
0,68 |
1,02 |
9 |
0,74 |
1,20 |
10 |
0,80 |
1,30 |
|
|
|
Возрастание кислотного числа свидетельствует о гидролитическом распаде жира, уменьшение йодного числа — о насыщении непредельных связей радикалов жирных кислот, увеличение ацетильного числа — о присоединении гидроксильных групп к жирнокислотным радикалам. На фоне уменьшения йодного числа увеличение ацетильного числа можно считать свидетельством присоединения гидроксильных групп по месту двойных связей в результате взаимодействия триглицеридов с водой.
Если гидролиз жира в небольших масштабах не ведет к снижению пищевой ценности, то присоединение гидроксильных групп к кислотным радикалам — прямое свидетельство снижения пищевой ценности части жира.
В условиях влажного и продолжительного нагрева при температурах выше 100 °С значительно ускоряются гидролитические процессы, а именно гидролиз триглицеринов и насыщение двойных связей радикалов жирных кислот гидроксильными группами (табл.
11.8).
При варке мясопродуктов и костей в большом количестве воды при кипении (бульоны, супы) часть выплавленного жира эмульгируется, распределяясь по всему объему бульона в виде мельчайших шариков. Эмульгированный жир придает бульону неприятный салистый привкус и мутность. Эмульгирование жира усиливается при увеличении гидролиза и интенсивности кипения. Периодическое удаление жира с поверхности бульона снижает степень его эмульгирования.
При указанных в табл. 11.8 параметрах еще более заметно уменьшается йодное число жира и тем интенсивнее, чем выше температура. Поскольку наряду с этим возрастает ацетильное число, есть основания полагать, что происходит образование оксикислот.
Таб.11.9. Изменение свойств говяжьего жира, многократно использованного для жарки продуктов
Характеристика жира |
До жарки |
Порядковый номер жарки |
||
|
|
|
|
|
|
|
1 |
2 |
3 |
|
|
|
|
|
Кислотное число |
2,16 |
2,21 |
2,26 |
1,97 |
Число омыления |
195,5 |
197,6 |
199,9 |
201,8 |
Неомыляемые вещества |
0,34 |
0,74 |
0,78 |
0,83 |
Йодное число |
32,7 |
31,8 |
30,7 |
29,2 |
Ацетильное число |
4,7 |
9,0 |
9,7 |
9,6 |
Реакция на альдегиды |
Отрица- |
Положи- |
Положи- |
Ярко |
|
|
|
|
|
|
тельная |
тельная |
тельная |
выражена |
|
|
|
|
|
59
Вусловиях сухого нагрева, например при жарке, на первый план выступают окислительные изменения жиров и процессы полимеризации. В табл. 11.9 приведены некоторые характеристики говяжьего жира, многократно использованного для жарки.
Рост числа омыления свидетельствует о накоплении низкомолекулярных кислот, а ацетильного числа — об образовании оксикислот.
Впроцессе нагрева возрастает перекисное число жира и значительно увеличивается содержание в жире акролеина. Цвет жира темнеет, запах ухудшается главным образом в результате перехода в него окрашенных продуктов пирогенетического распада органических веществ. При длительном использовании жира для жарки уменьшается усвояемость в результате накопления в нем продуктов окисления и полимеризации. Нагрев жира до высоких температур даже под вакуумом приводит к небольшому снижению йодного числа и увеличению его вязкости.
Окислению, полимеризации и циклизации подвергаются в первую очередь линоленовая и линолевая кислоты. При этом возможно образование шестичленных непредельных циклических соединений, окисленных полимеров и других веществ, вредных для организма. Эти процессы становятся заметными при высоких температурах
нагрева, поэтому при жарке температура жира не должна превышать 170 °С. Прогревание бульона при 100 0С в течение часа предохраняет жир от прогоркания.
По-видимому, это обусловлено образованием антиокислителей.
Изменение экстрактивных веществ
Экстрактивные вещества мяса при его тепловой обработке претерпевают существенные изменения, которые играют решающую роль в образовании специфических аромата и вкуса вареного мяса. Тщательно отмытое от растворимых в воде веществ мясо после варки обладает очень слабым запахом, а водная вытяжка из него имеет вкус и запах вареного мяса. После диализа эта вытяжка почти утрачивает запах, присущий вареному мясу.
Изменения, обусловливающие появление такого запаха, еще не полностью изучены. Известно, однако, что важную роль в этом играют глутаминовая кислота и продукты распада инозиновой кислоты. Глутаминовая кислота и ее натриевая соль даже в незначительных количествах (0,03 %) придают продукту вкус, близкий к вкусу мяса.
При нагревании усиливается распад инозиновой кислоты: при 95 °С через 1 ч распадается около 80 % кислоты с образованием преимущественно гипоксантина. При этом несколько возрастает количество неорганического фосфора в результате образования фосфорной кислоты.
В процессе варки изменяется также содержание других экстрактивных веществ. Около 1/3 креатина, обладающего горьковатым вкусом, превращается в креатинин. Распадается около 10... 15 % холина. В результате распада соединений, содержащих лабильно связанную серу, в вареном мясе образуется сероводород, количество которого зависит от вида и состояния мяса, а также от условий варки. Оно возрастает с повышением температуры и увеличением продолжительности нагрева. В вареной говядине сероводорода меньше, чем в свинине, а в ней меньше, чем в телятине, в мороженом мясе больше, чем в охлажденном. Выделение сероводорода при умеренных температурах связывают с распадом глутатиона (трипептид, образуемый глицином глутаминовой кислоты и цистином), так как он возникает при исчезновении серы глутатиона. Одновременно с выделением сероводорода в результате распада глутамина и глутатиона образуется глутаминовая кислота. Введение окислителей (нитрита, нитрата) уменьшает скорость образования сероводорода.
При варке мяса в бульон выделяются вещества, в состав которых входят карбонильные группы, обладающие различным ароматом. В бульоне обнаружены ацетальдегид, ацетоин, диацетил.
60
