
- •Лабораторная работа №1
- •1. Окси-, оксокислоты
- •1.1.Гидроксикарбоновые кислоты Опыт1. Свойства молочной кислоты
- •Опыт 2. Свойства винной кислоты.
- •Опыт 3. Получение цитрата кальция
- •2.1. Кетокислоты. Ацетоуксусный эфир Опыт 4. Получение пировиноградной кислоты окислением молочной кислоты
- •Опыт 5. Свойства ацетоуксусного эфира
- •1.3. Ароматические оксикислоты Опыт 6. Взаимодействие бензойной, коричной и салициловой кислот с бромной водой
- •Опыт 7. Отношение бензойной и коричной кислот к перманганату калия
- •Опыт 8. Реакции бензойной и салициловой кислот с хлоридом железа (III)
- •Опыт 9. Взаимодействие эфиров салициловой кислоты с хлоридом железа (III)
- •Опыт 10. Образование фталевого ангидрида
- •2.2. Аминокислоты Опыт 12. Свойства аминокислот
- •2.3. Мочевина Опыт 13. Свойства мочевины
- •Ароматические амины Опыт14. Растворимость анилина и его солей в воде. Основные свойства анилина
- •Опыт 15. Взаимодействие анилина с бромной водой
- •Опыт 16. Ацилирование анилина
- •Опыт 17. Окисление анилина
- •2.5. Диазо- и азосоединения Опыт 18. Реакция диазотирования анилина (получение соли диазония)
- •Опыт 19. Разложение соли диазония (реакция с выделением азота)
- •Опыт 20. Реакции солей диазония без выделения азота (реакции азосочетания)
- •Опыт 21. Крашение шерсти и шелка кислотными азокрасителями
- •Опыт 22. Крашение хлопчатобумажной ткани (ледяное крашение)
- •Лабораторная работа №3
- •3. Углеводы
- •3.1. Моносахариды Опыт 23. Качественная реакция на углеводы с α -нафтолом (реакция Молиша)
- •Опыт 24. Реакции моносахаридов по карбонильной группе
- •Опыт 25. Реакции на гидроксильные группы в моносахаридах
- •Опыт 26. Цветные реакции на моносахариды
- •3.2. Дисахариды Опыт 27. Реакции на гидроксильные группы дисахаридов
- •Опыт 28. Реакции дисахаридов по карбонильной группе. Сравнение свойств восстанавливающих и невосстанавливающих дисахаридов
- •Опыт 29. Гидролиз (инверсия) сахарозы
- •Опыт 30. Реакция сахарозы с сульфатами кобальта и никеля
- •3.3. Высшие полисахариды Опыт 31. Отношение полисахаридов к реактиву Фелинга
- •Опыт 32. Взаимодействие крахмала и гликогена с иодом
- •Опыт 33. Гидролиз крахмала
- •Опыт 34. Кислотный гидролиз клетчатки
- •Лабораторная работа №4
- •Гетероциклические соединения Опыт 35. Получение фурфурола и его свойства
- •Опыт 36. Получение «белого» индиго и кубовое крашение
- •Опыт 37. Пиридин и его свойства
- •Опыт 38. Мочевая кислота
2.5. Диазо- и азосоединения Опыт 18. Реакция диазотирования анилина (получение соли диазония)
Реактивы и оборудование:анилин, концентрированная серная кислота, 30%-ный раствор нитрита натрия (свежеприготовленный), иодкрахмальная бумага; плоскодонные колбы на 50 мл, кристаллизаторы, лед.
В небольшую плоскодонную колбу вносят около 10 мл воды со льдом, приливают 2 мл анилина и перемешивают. Колбу ставят в кристаллизатор со льдом, приливают 3 мл концентрированной серной кислоты и снова перемешивают. Выпадает белый осадок гидросульфата фениламмония. К реакционной смеси по каплям при перемешивании и охлаждении добавляют 5 мл 30%-ного раствора нитрита натрия (свежеприготовленного). По мере образования соли диазония (гидросульфата фенилдиазония) осадок соли анилина растворяется, и жидкость становится прозрачной:
![]()

Окончание реакции диазотирования устанавливают по наличию в растворе избытка азотистой кислоты с помощью иодкрахмальной бумаги. Посинение индикатора свидетельствует об окончании реакции диазотирования:

Иодид калия, содержащийся в иодкрахмальной бумаге, реагирует с серной кислотой с образованием иодоводорода. В результате взаимодействия последнего с азотистой кислотой выделяется свободный иод, который с крахмалом образует окрашенные в синий цвет «комплексы включения». Если иодкрахмальная бумага не синеет, то в реакционную смесь добавляют раствор нитрита натрия.
Напишите механизм реакции диазотирования анилина и объясните, почему эта реакция идет при низких положительных температурах и в кислой среде.
Соль фенилдиазония оставляют на холоду для использования в следующих опытах.
Опыт 19. Разложение соли диазония (реакция с выделением азота)
Реактивы и оборудование:раствор соли фенилдиазония, бромная вода; водяные бани, изогнутые газоотводные трубки, стаканы на 100 мл, пробирки.
Часть раствора соли фенилдиазония, полученного в опыте 18, переливают в пробирку и нагревают на горячей водяной бане (или в стакане с горячей водой). Наблюдают выделение газа — азота. После окончания выделения азота ощущается запах фенола:
![]()
Образовавшийся фенол отгоняют. Для этого пробирку закрепляют в лапке штатива, кладут в нее кипятильники, закрывают пробкой с изогнутой газоотводной трубкой, конец которой опущен в пустую охлаждаемую пробирку-приемник, и осторожно нагревают на газовой горелке. Фенол отгоняется с водой и собирается в пробирке в виде эмульсии. В пробирку-приемник с отогнанным фенолом добавляют несколько капель бромной воды. Выпадает белый осадок трибромфенола.
Напишите механизм реакции разложения соли диазония при нагревании ее водного раствора и уравнение реакции взаимодействия фенола с бромной водой.
Опыт 20. Реакции солей диазония без выделения азота (реакции азосочетания)
Реактивы и оборудование: растворгидросульфата фенилдиазония, N.N-диметиланилин, насыщенный раствор ацетата натрия, 2М соляная кислота, 2М раствор гидроксида натрия, β-нафтол, сульфаниловая кислота, нитрит натрия; пипетки, химические стаканы на 50 мл, кристаллизаторы, лед, мерные цилиндры на 10 мл, стеклянные палочки, иод-крахмальная бумага, пробирки.
20.1. Получение диметиломиноазобензола.Часть раствора (около 1 мл) гидросульфата фенилдиазония, полученного в опыте 96, наливают в пробирку, а затем добавляют 1—2 капли N,N-диметиланилина и несколько капель насыщенного раствора ацетата натрия. Смесь энергично встряхивают. При этом выпадает желто-оранжевый осадок N,N-диметиламиноазобензола:

Образование азокрасителей происходит в результате реакции азосочетания соли диазония с ароматическими аминами или фенолами. Азосочетание относится к реакциям электрофильного замещения, в которых соль диазония является электрофильным реагентом.
Напишите механизм этой реакции. Одну каплю полученного красителя переносят в другую пробирку и добавляют 2—3 мл воды. К полученному раствору приливают 2—3 капли 2М соляной кислоты. Раствор приобретает ярко-красную окраску. Часть раствора отливают в другую пробирку и подщелачивают его 3—4 каплями 2М раствора гидроксида натрия. Снова появляется желто-оранжевая окраска:

Раствор N,N -диметиламиноазобензола применяется в качестве индикатора, и в частности для титрования свободной соляной кислоты при анализе желудочного сока. Переход красного цвета в желтый происходит при рН = 4,0.
20.2. Получение красителянафтолового оранжевого (β-нафтолоранжа).Исходные растворы готовят в трех небольших химических стаканах. В первом стакане растворяют 0,7 г – нафтола в 10 мл 2М раствора гидроксида натрия при нагревании, во втором — 1 г сульфаниловой кислоты в 2,5мл 2М раствора щелочи при слабом нагревании. К раствору натриевой соли сульфаниловой кислоты добавляют 0,4 г нитрита натрия в 5 мл воды. Полученную смесь охлаждают в кристаллизаторе со льдом и приливают ее при перемешивании в третий стакан с 10 мл предварительно охлажденной 2М соляной кислоты. Окончание реакции диазотирования конт- ролируют по иодкрахмальной бумаге:
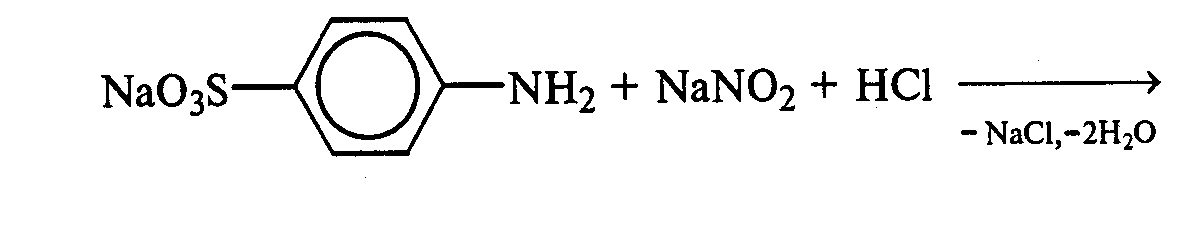

К раствору соли диазония добавляют щелочной раствор β -нафтола. находящийся в первом стакане. Выпадает осадок красителя β -нафтолоранжа:

Напишите механизм реакции азосочетания соли диазония с β -нафтолом. В какой среде проводят реакцию азосочетания с фенолами?
