
- •02080165 “Экология”, 11090165 “Водные биоресурсы и аквакультура”, 08040165 “Товароведение и экспертиза товаров”, колледж “Технолог”
- •Часть I
- •Содержание
- •Введение
- •Правила техники безопасности при работе в химической лаборатории
- •Правила техники безопасности при работе с кислотами и щелочами
- •Правила техники безопасности при работе с бромом
- •Правила техники безопасности при работе с металлическими натрием и калием
- •Техника безопасности при работе с легковоспламеняющимися жидкостями
- •Техника безопасности при работе под вакуумом
- •Меры безопасности при утечке газа и тушении локального пожара и горящей одежды
- •Оказание первой медицинской помощи при ожогах и отравлениях химическими веществами
- •1. Качественный элементный анализ органических соединений Лабораторная работа № 1
- •Опыт 1. Обнаружение углерода пробой на обугливание
- •Опыт 2. Обнаружение углерода и водорода окислением вещества оксидом меди (II)
- •Органическом веществе:
- •Опыт 5. Определение галогенов в органических веществах
- •2. Свойства углеводородов алифатического и ароматического ряда Лабораторная работа № 2 Опыт 6. Реакция углеводородов с бромом
- •Опыт 7. Отношение углеводородов к окислению( реакция Вагнера)
- •Опыт 8. Взаимодействие углеводородов с серной кислотой
- •Опыт 9. Получение ацетилена и исследование его свойств
- •3. Гидроксипроизводные углеводородов Лабораторная работа № 3
- •3.1. Алифатические спирты
- •Опыт 10. Образование и свойства этилата натрия
- •Опыт 11. Получение глицерата меди
- •Опыт 12. Реакции окисления этилового спирта
- •Опыт 13. Получение простого диэтилового эфира
- •3.2. Фенолы Осторожно! Фенолы вызывают ожоги кожи Опыт 14. Образование и разложение фенолятов
- •Опыт 15. Взаимодействие фенола с бромной водой
- •Опыт 16. Окисление фенола
- •Опыт 17. Взаимодействие фенолов с хлоридом железа (III)
- •4. Оксопроизводные углеводородов Лабораторная работа №4
- •4.1. Алифатические альдегиды и кетоны
- •Опыт 18 . Получение уксусного альдегида окислением этилового спирта дихроматом калия
- •Опыт 19. Реакции окисления альдегидов
- •Опыт 20. Альдольная и кротоновая конденсация уксусного альдегида и его осмоление
- •Опыт 21. Получение ацетона пиролизом ацетата кальция
- •4.2.Ароматические карбонильные соединения Опыт 22. Окисление бензальдегида (реакция «серебряного зеркала»)
- •Опыт 23. Получение фенилгидразона бензойного альдегида
- •Опыт 24. Получение бензальанилина (основание Шиффа)
- •Опыт 26. Получение высших жирных кислот и их свойства
- •Опыт 27. Взаимодействие бензойной и салициловой кислот с бромной водой
- •Опыт 28. Отношение бензойной кислоты к перманганату калия
- •Опыт 29. Свойства олеиновой кислоты
- •5.2. Двухосновные карбоновые кислоты Опыт 30. Свойства щавелевой кислоты
- •Опыт 31. Получение ангидрида янтарной кислоты
- •Опыт 32. Образование фталевого ангидрида
- •5.3. Сложные эфиры предельных одноосновных кислот Опыт 33. Получение этилацетата
- •Опыт 34. Гидролиз этилацетата
- •5.4. Жиры и масла Опыт 35. Определение непредельности растительного масла реакцией с бромом
- •Опыт 36. Взаимодействие растительного масла с водным раствором перманганата калия (реакция Вагнера)
- •Список рекомендуемой литературы
3. Гидроксипроизводные углеводородов Лабораторная работа № 3
3.1. Алифатические спирты
Опыт 10. Образование и свойства этилата натрия
Реактивы и оборудование: этиловый спирт (абсолютный), металлический натрий, 1%-ный спиртовой раствор фенолфталеина; прямые газоотводные трубки с оттянутыми концами, пробирки.
В сухую пробирку наливают 2—3 мл абсолютного этилового спирта и аккуратно вносят кусочек металлического натрия величиной с маленькую горошину. Пробирку закрывают пробкой с прямой газоотводной трубкой. Реакция идет бурно с выделением водорода:
2СН3СН2ОН + 2Na 2СН3СН2ONa + Н2
Почему для этого опыта нужно брать абсолютный спирт, а не ректификат? Какие свойства спирта (основные или кислотные) проявляются в реакции с металлическим натрием? Почему этанол взаимодействует с натрием более спокойно, чем вода?
Осторожно нагревая пробирку, доводят реакцию этанола с натрием до конца. На дне пробирки образуется белый осадок этилата натрия. (В пробирке не должен оставаться металлический натрий). В пробирку добавляют 1 каплю спиртового раствора фенолфталеина, а затем 1—2 мл дистиллированной воды. В присутствии воды происходит гидролиз этилата натрия:
СН3СН2ONa + Н2О СН3СН2ОН + NaOH
Так как при гидролизе этилата натрия образуется щелочь, то фенолфталеин окрашивает раствор в малиновый цвет.
Опыт 11. Получение глицерата меди
Реактивы и оборудование: глицерин, 2%- ный раствор сульфата меди (II), 10 % - ный
раствор гидроксида натрия, пробирки.
В пробирку наливают 3—4 капли 2%-ного раствора сульфата меди и 2—3 мл 10%-ного раствора гидроксида натрия:
CuSO4 + 2NaOH Cu(OH)2 + Na2SО4
К образовавшемуся осадку голубого цвета добавляют несколько капель глицерина. После перемешивания осадок растворяется, и появляется васильково-синее окрашивание вследствие образования комплексного соединения — глицерата меди:
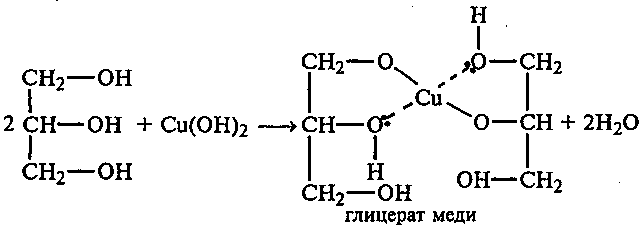
Какие свойства глицерина проявляются в опытах с гидроксидом меди (II)? Объясните образование глицерата меди.
Опыт 12. Реакции окисления этилового спирта
Реактивы и оборудование: этиловый спирт, хромовая смесь, перманганат калия кристаллический, концентрированная серная кислота; пипетки, пробирки.
12.1. Окисление спирта хромовой смесью. В пробирку наливают 1—2 мл хромовой смеси и добавляют по каплям при встряхивании 0,5 мл этилового спирта. Цвет смеси изменяется от оранжево-красного до зеленого. При этом ощущается запах уксусного альдегида, напоминающий запах зеленого яблока (нюхать осторожно):
3СН3СН2ОН + К2Сг2О7 + 4 H2SО4 3СН3СОH + K2SО4 + Cr2(SО4)3 + 7Н2О
Изменение окраски раствора связано с переходом хрома из степени окисления +6 (оранжево-красное окрашивание) в степень окисления +3 (зеленое окрашивание).
12.2. Окисление спирта перманганатом калия. В сухую пробирку, закрепленную в штативе, аккуратно пипеткой, не смачивая стенок, вносят 2—3 мл концентрированной серной кислоты. По стенке пробирки другой пипеткой приливают 2—3 мл этилового спирта таким образом, чтобы получилось два слоя. Затем насыпают 0,5—1 г перманганата калия, который будет размещаться на границе раздела двух слоев. Через 1—2 мин начинает протекать реакция, сопровождающаяся появлением ярких вспышек. При этом чувствуется запах уксусного альдегида:
5СН3СН2ОН + 2KMnO4 + 3H2SO4 5СН3СОH + 2MnSO4 + K2SO4 + Н2О
Сделайте вывод о легкости окисления алифатических спиртов.
