
- •02080165 “Экология”, 11090165 “Водные биоресурсы и аквакультура”, 08040165 “Товароведение и экспертиза товаров”, колледж “Технолог”
- •Часть I
- •Содержание
- •Введение
- •Правила техники безопасности при работе в химической лаборатории
- •Правила техники безопасности при работе с кислотами и щелочами
- •Правила техники безопасности при работе с бромом
- •Правила техники безопасности при работе с металлическими натрием и калием
- •Техника безопасности при работе с легковоспламеняющимися жидкостями
- •Техника безопасности при работе под вакуумом
- •Меры безопасности при утечке газа и тушении локального пожара и горящей одежды
- •Оказание первой медицинской помощи при ожогах и отравлениях химическими веществами
- •1. Качественный элементный анализ органических соединений Лабораторная работа № 1
- •Опыт 1. Обнаружение углерода пробой на обугливание
- •Опыт 2. Обнаружение углерода и водорода окислением вещества оксидом меди (II)
- •Органическом веществе:
- •Опыт 5. Определение галогенов в органических веществах
- •2. Свойства углеводородов алифатического и ароматического ряда Лабораторная работа № 2 Опыт 6. Реакция углеводородов с бромом
- •Опыт 7. Отношение углеводородов к окислению( реакция Вагнера)
- •Опыт 8. Взаимодействие углеводородов с серной кислотой
- •Опыт 9. Получение ацетилена и исследование его свойств
- •3. Гидроксипроизводные углеводородов Лабораторная работа № 3
- •3.1. Алифатические спирты
- •Опыт 10. Образование и свойства этилата натрия
- •Опыт 11. Получение глицерата меди
- •Опыт 12. Реакции окисления этилового спирта
- •Опыт 13. Получение простого диэтилового эфира
- •3.2. Фенолы Осторожно! Фенолы вызывают ожоги кожи Опыт 14. Образование и разложение фенолятов
- •Опыт 15. Взаимодействие фенола с бромной водой
- •Опыт 16. Окисление фенола
- •Опыт 17. Взаимодействие фенолов с хлоридом железа (III)
- •4. Оксопроизводные углеводородов Лабораторная работа №4
- •4.1. Алифатические альдегиды и кетоны
- •Опыт 18 . Получение уксусного альдегида окислением этилового спирта дихроматом калия
- •Опыт 19. Реакции окисления альдегидов
- •Опыт 20. Альдольная и кротоновая конденсация уксусного альдегида и его осмоление
- •Опыт 21. Получение ацетона пиролизом ацетата кальция
- •4.2.Ароматические карбонильные соединения Опыт 22. Окисление бензальдегида (реакция «серебряного зеркала»)
- •Опыт 23. Получение фенилгидразона бензойного альдегида
- •Опыт 24. Получение бензальанилина (основание Шиффа)
- •Опыт 26. Получение высших жирных кислот и их свойства
- •Опыт 27. Взаимодействие бензойной и салициловой кислот с бромной водой
- •Опыт 28. Отношение бензойной кислоты к перманганату калия
- •Опыт 29. Свойства олеиновой кислоты
- •5.2. Двухосновные карбоновые кислоты Опыт 30. Свойства щавелевой кислоты
- •Опыт 31. Получение ангидрида янтарной кислоты
- •Опыт 32. Образование фталевого ангидрида
- •5.3. Сложные эфиры предельных одноосновных кислот Опыт 33. Получение этилацетата
- •Опыт 34. Гидролиз этилацетата
- •5.4. Жиры и масла Опыт 35. Определение непредельности растительного масла реакцией с бромом
- •Опыт 36. Взаимодействие растительного масла с водным раствором перманганата калия (реакция Вагнера)
- •Список рекомендуемой литературы
4. Оксопроизводные углеводородов Лабораторная работа №4
4.1. Алифатические альдегиды и кетоны
Опыт 18 . Получение уксусного альдегида окислением этилового спирта дихроматом калия
Реактивы и оборудование: этиловый спирт, дихромат калия К2Сг2О7, концентрированная серная кислота; изогнутая газоотводная трубка, стакан на 100 мл, лед, пробирки.
В сухую пробирку насыпают 0,5 г дихромата калия, приливают 2 мл 10%-ного раствора серной кислоты и постепенно при встряхивании добавляют 2 мл этилового спирта. Смесь разогревается и происходит изменение ее цвета от оранжево-красного до зеленовато-бурого.
Уравнение реакции окисления спирта дихроматом калия в кислой среде:
3СН3СН2ОН + К2Сг2О7 + 4H2SО4 3СН3СОH + K2SО4 + Cr2(SО4)3 + 7Н2О
Пробирку закрывают пробкой с изогнутой газоотводной трубкой и закрепляют в лапке штатива. Конец газоотводной трубки опускают в пробирку-приемник с дистиллированной водой. Приемник предварительно помещают в стакан со льдом. Пробирку с реакционной смесью осторожно нагревают на пламени горелки и отгоняют летучие продукты в течение 3—4 мин. Наличие уксусного альдегида в пробирке-приемнике определяют по запаху.
Опыт 19. Реакции окисления альдегидов
Реактивы и оборудование: раствор ацетальдегида, 10%-ный раствор гидроксида натрия, 2%-ный раствор сульфата меди (II), 1%-ный раствор нитрата серебра, 5%-ный раствор аммиака (в капельнице); водяные бани, термометры, пробирки.
19.1. Окисление ацетальдегида аммиачным раствором гидроксида серебра (реакция «серебряного зеркала»). Реакцию «серебряного зеркала» проводят в тщательно вымытой пробирке. К прозрачному, бесцветному аммиачному раствору гидроксида серебра прибавляют несколько капель раствора ацетальдегида. Пробирку несколько минут нагревают на водяной бане при температуре воды 70—80ОС или на газовой горелке до начала побурения раствора(до кипения не доводить).Далее реакция идет без нагревания, и металлическое серебро выпадает в виде черного осадка или осаждается на стенках пробирки в виде блестящего серебряного налета («серебряное зеркало»):
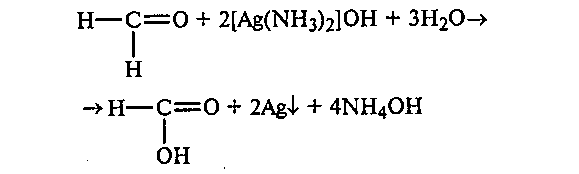
Вступают ли в эту реакцию кетоны? Приведите объяснение.
19.2. Окисление ацетальдегида гидроксидом меди (II). В пробирку наливают 1 мл раствора ацетальдегида и 1 мл 10%-ного раствора гидроксида натрия, а затем при встряхивании по каплям добавляют 2%-ный раствор сульфата меди (II) до появления неисчезающей взвеси гидроксида меди (II):
![]()
Верхнюю часть смеси нагревают до кипения. Наблюдают появление желтого осадка гидроксида меди (I), переходящего затем в красный осадок оксида меди (I):
![]()
![]()
Гидроксид меди (II) может восстанавливаться ацетальдегидом до металлической меди. В этом случае при использовании очень чистой пробирки можно наблюдать образование на ее стенках «медного зеркала».
Ацетон и другие кетоны не окисляются мягкими окислителями, в том числе и гидроксидом меди (II). Поэтому при нагревании гидроксид меди (II) дегидратируется с образованием черного осадка оксида меди (II):
![]()
