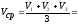- •Н.В. Слученкова, т.Е. Иванова
- •Качественный анализ Основные принципы качественного анализа
- •Титриметрический анализ Сущность титриметрического анализа. Основные понятия, определения, формулы
- •Техника выполнения титриметрического анализа
- •Кислотно-основное титрование
- •Комплексонометрическое титрование
Титриметрический анализ Сущность титриметрического анализа. Основные понятия, определения, формулы
Изучите материал, изложенный в учебнике (И.К. Цитович «Курс аналитической химии», 2004, с.227-245) и ответьте на вопросы:
1. Какая формула выражает сущность титриметрического анализа?
2. Что такое титрование?
3. Что такое точка эквивалентности, как её определяют?
4. Кратко охарактеризуйте методы титриметрического анализа.
5.Стандартные вещества (определение), требования к ним, примеры стандартных веществ.
6. Стандартизированные вещества (определение), примеры.
7. Что такое сходящиеся результаты?
8. В чем отличия титриметрического анализа от гравиметрического?
9. Приведите формулы расчета титра, молярной концентрации эквивалента (нормальности) раствора и формулу пересчета нормальной концентрации через титр.
Техника выполнения титриметрического анализа
Сделайте рисунки из учебника (И.К. Цитович «Курс аналитической химии», 2004, рис. 10, с. 184; рис. 11, с. 184; рис 12-в, с. 185; рис.31, с. 240; рис. 13-б, с. 185; рис. 25, с. 228; рис. 28, с. 238).
Кислотно-основное титрование
Лабораторная работа №2: «Кислотно-основное титрование»
Цель: закрепить навыки работы на аналитических весах. Приобрести навыки приготовления стандартных растворов, работы с мерной посудой, проведения титрования.
Необходимая посуда и реактивы: мерные колбы на 100 мл, воронки, стеклянные бюксы, технохимические весы ВЛКТ-500, аналитические весы ВЛР-200, мерные пипетки на 10 мл и 100 мл, груши, штативы, бюретки на 25 мл, колбы для титрования на 100 мл и 250 мл, карбонат натрия Na2CO3, 0,1н. раствор НСI, индикатор метиловый оранжевый.
Порядок выполнения работы:
А. Приготовление 100 мл стандартного раствора карбоната натрия
Рассчитать величину навески, исходя из уравнения реакции и используя для расчета формулы (29) и (27) (см. пособие с. 41, 38):
Na2CO3 + 2HCI = 2NaCI + H2O + CO2↑
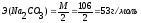

Взять навеску карбоната натрия первоначально на технохимических весах, затем на аналитических (см. пособие с. 30). Результаты взвешиваний занести в таблицу:
|
Измеряемая величина |
Технохимические весы |
Аналитические весы |
|
Масса навески, г |
0,53 |
|
|
Масса пустого бюкса, г |
|
|
|
Масса бюкса с навеской, г |
|
|
Приготовить стандартный раствор (см. пособие с. 41-43). Рассчитать титр и молярную концентрацию эквивалента (нормальность) раствора Na2CO3, используя точную величину навески (полученную на аналитических весах):

Б. Установление точной концентрации (стандартизация) 0,1н раствора соляной кислоты по карбонату натрия
Бюретку подготовить к титрованию, установить уровень кислоты на «0» деление (см. пособие с. 40,41).
В три колбы для титрования на 100 мл отобрать пипеткой по 10 мл стандартного раствора Na2CO3, предварительно ополоснув пипетку отбираемым раствором (техника отбора пробы – см. пособие с. 40).
Затем в каждую колбу добавить цилиндром по 20 мл дистиллированной H2O и 1 каплю индикатора метилового оранжевого, содержимое колбы перемешать.
Одновременно для сравнения приготовить раствор «свидетеля»: в колбу для титрования внести цилиндром 40 мл дистиллированной воды, 1 каплю индикатора метилового оранжевого и 1 каплю из бюретки 0,1н. раствора НСI (можно готовить «свидетель» и без соляной кислоты: он будет иметь чисто-желтую окраску, при сравнении с которой легко заметить перемену окраски титруемого раствора).
Титруют приготовленные пробы Na2CO3 путем медленного приливания 0,1н. раствора НСI из бюретки при постоянном перемешивании содержимого колбы. Нужно уловить момент, когда от одной капли соляной кислоты первоначально чисто-желтый раствор приобретает слабо розовый цвет (как раз такой, как у приготовленного «свидетеля»).
Результаты титрования занести в таблицу. Титрование провести до получения 3-х сходящихся результатов! Рассчитать по трем сходящимся результатам Vср с точностью до сотых.
Результаты титрования:
|
№ титрования |
Объем титранта, мл |
Средний объем титранта, мл |
|
1 |
V1 = |
|
|
2 |
V2 = | |
|
3 |
V3 = | |
|
4 |
V4 = | |
|
|
| |
|
|
|
Рассчитать точную концентрацию раствора НСI по формуле (33) (см. пособие с. 42):

В. Определение содержания гидроксида натрия в растворе (контрольно-аналитическая задача)
Подготовить бюретку. Заполнить ее 0,1н. раствором соляной кислоты. Полученный от преподавателя раствор NaOH в мерной колбе довести дистиллированной водой до метки, перемешать. В три колбы для титрования на 100 мл отобрать пипеткой по 10 мл раствора NaOH, предварительно ополоснув пипетку этим раствором. Прибавить в каждую колбу по 1 капле индикатора метилового оранжевого и титровать раствором НСI до перехода желтой окраски в слабо-розовую от одной капли кислоты.
Результаты титрования записать в таблицу. По 3-м сходящимся результатам рассчитать Vср (НСI) и массу NaOH в растворе в граммах с точностью до десятитысячных долей по формуле (34) (см. пособие с. 43).
Результаты титрования:
|
№ титрования |
Объем титранта, мл |
Средний объем титранта, мл |
|
1 |
V1 = |
|
|
2 |
V2 = | |
|
3 |
V3 = | |
|
4 |
V4 = | |
|
|
| |
|
|
|

Г. Определение временной (карбонатной) жесткости воды
В колбу для титрования емкостью 250 мл пипеткой отобрать 100 мл водопроводной воды. Добавить 3 капли метилового оранжевого и оттитровать 0,1н. раствором НСI до перехода желтой окраски раствора в бледно-розовую. Повторить титрование 2-3 раза.
Результаты титрования:
|
№ титрования |
Объем титранта, мл |
Средний объем титранта, мл |
|
1 |
V1 = |
|
|
2 |
V2 = | |
|
3 |
V3 = | |
|
4 |
V4 = | |
|
|
| |
|
|
|
Рассчитать временную
жесткость воды в ммоль·экв/л: