
лекции_1 / Молекулярка / МКТ
.docЛекция 11. Молекулярная физика и термодинамика. Молекулярно-кинетическая теория строения вещества. (2 часа)
11.1. Динамические и статистические закономерности в физике. Статистический и термодинамический методы исследования.
11.2. Макроскопическое состояние. Термодинамические функции состояния. Уравнение состояния. Внутренняя энергия. Интенсивные и экстенсивные параметры.
11.3. Модель идеального газа. Основное уравнение состояния идеального газа. Основные газовые законы.
11.4. Молекулярно-кинетический смысл абсолютной температуры.
Демонстрации:
1. Механическая модель броуновского движения.
2. Диффузия в газах, жидкостях и твердых телах.
Видеофильмы:
1. Смешивание спирта с водой - (2 мин.).
2. Броуновское движение - (3 мин.).
МОЛЕКУЛЯРНОЕ СТРОЕНИЕ ВЕЩЕСТВА
Молекулы в атомах, ядро, нейтроны, протоны, электроны неисчерпаемы, как и атом. 80 лет развития физики науки в целом подтвердили предсказание великого философа Цицерона.
Атомной единицей массы называют 1/12 массы атома углерода (С), т. е. удобная величина, численно равная 1,6605655(86)*10-27.
![]() -
количество вещества, 6,02*1023
штук структурных элементов (неделимых)
атомов или молекул.
-
количество вещества, 6,02*1023
штук структурных элементов (неделимых)
атомов или молекул.
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
Идеальный газ
Основное уравнение кинетической теории газов
является важнейшим в молекулярно-кинетической теории; из него можно вывести все газовые законы, получить соотношения между энергией молекул и температурой и т.д.
![]() , (11.13)
, (11.13)
где n0 = N'/V – концентрация молекул - число молекул в единице объема.
Уравнение (11.13) называют основным уравнением молекулярно-кинетической теории газов для давления. Его называют уравнением Клаузиуса. Сделав некоторые преобразования из (11.13) можно получить
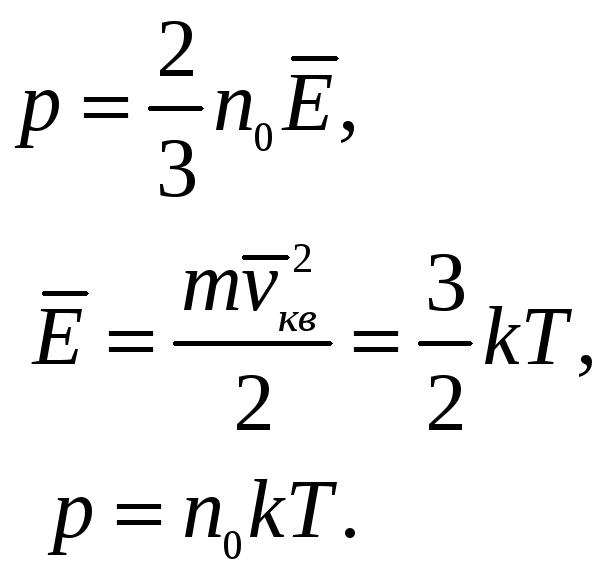 (11.14)
(11.14)
где n0 = N'/V - число молекул в единице объема;
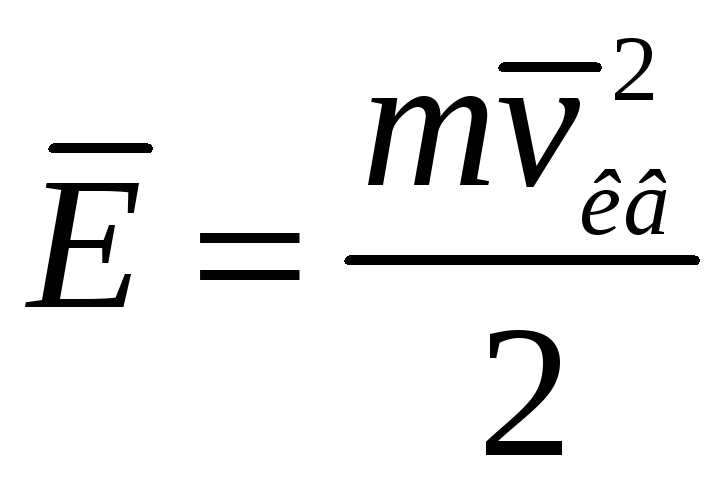 =- средняя кинетическая
энергия поступательного движения
молекул газа;
=- средняя кинетическая
энергия поступательного движения
молекул газа;
k - постоянная Больцмана.
ГАЗОВЫЕ ЗАКОНЫ
-
Идеальный газ
![]() -
уравнение Клапейрона.
-
уравнение Клапейрона.
P=P0=1,013*105 Па;
Т=Т0=273,15 К;
V=V0=22,4*10-3 м3;
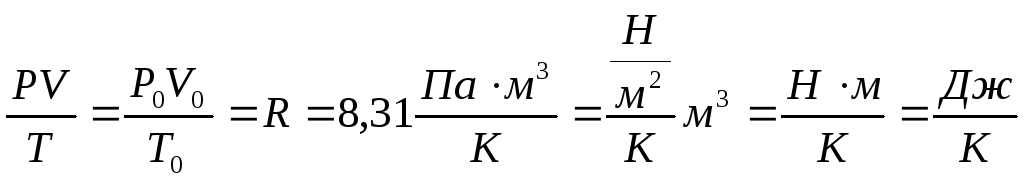
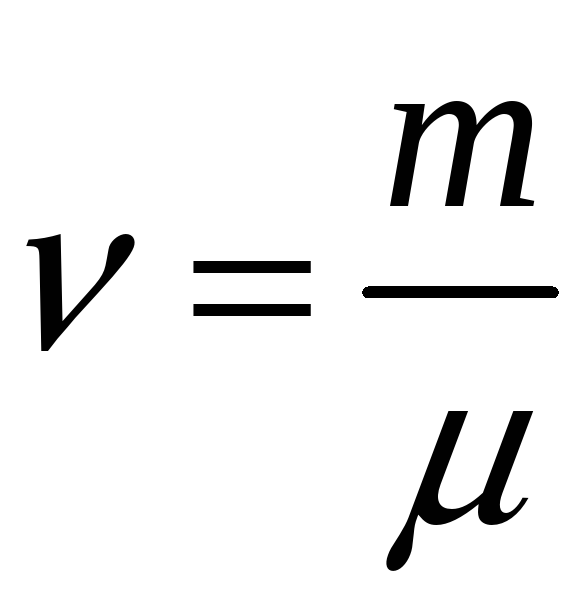
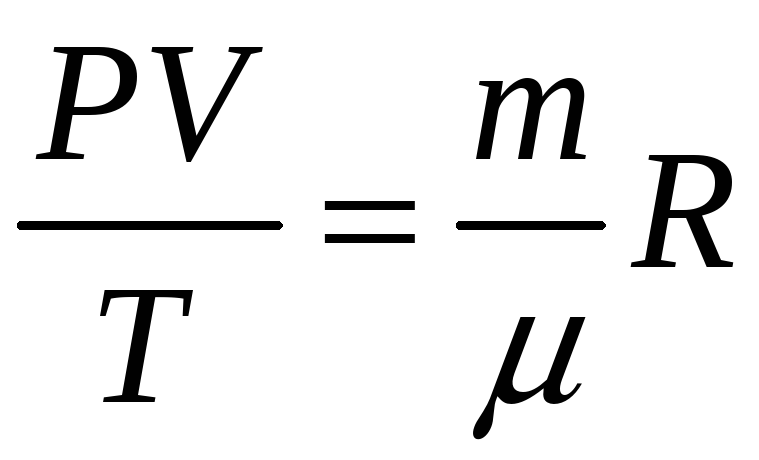

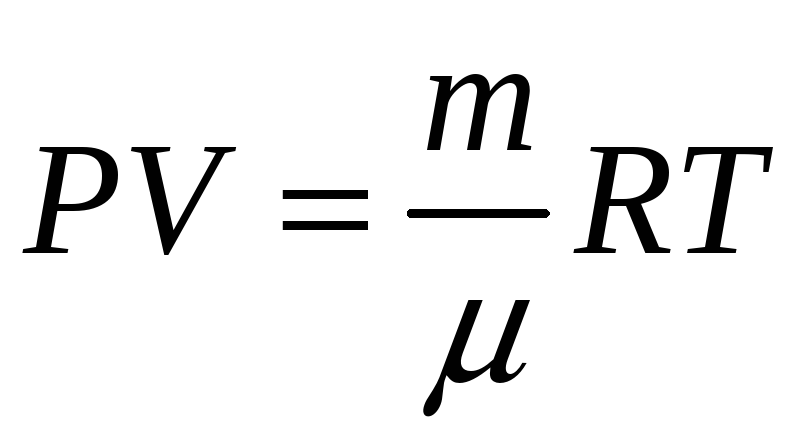 -
уравнение Менделеева-Клапейрона
-
уравнение Менделеева-Клапейрона
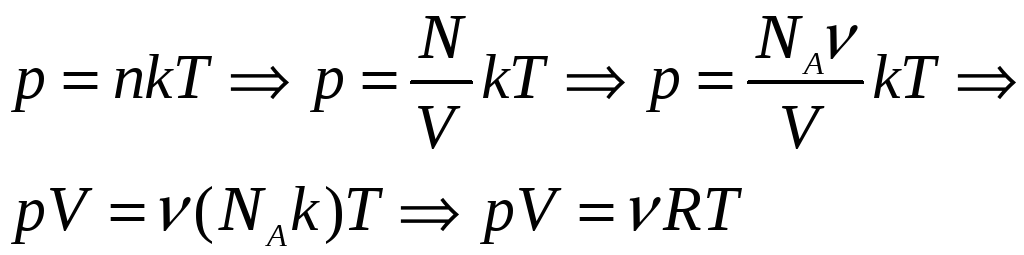
ИЗОПРОЦЕССЫ
-
P=const – изобарный процесс;
:
З АКОН
ГЕЙ-ЛЮССАКА:
АКОН
ГЕЙ-ЛЮССАКА:
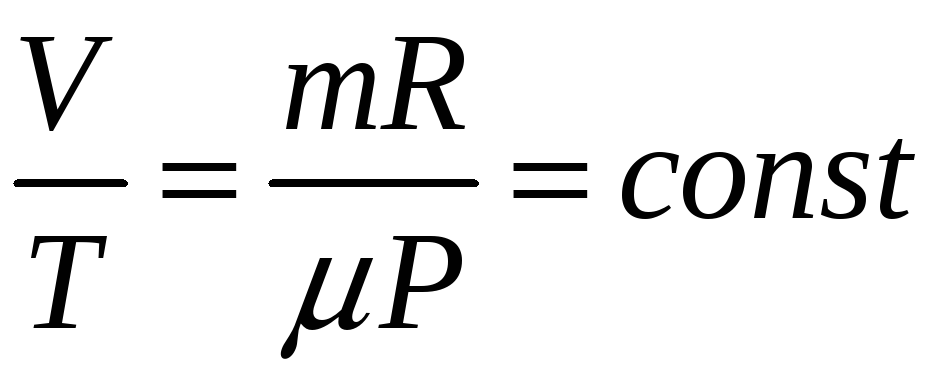
2. T=const – изотермический процесс;
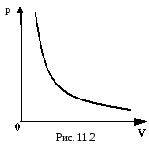
ЗАКОН
БОЙЛЯ-МАРИОТТА
P
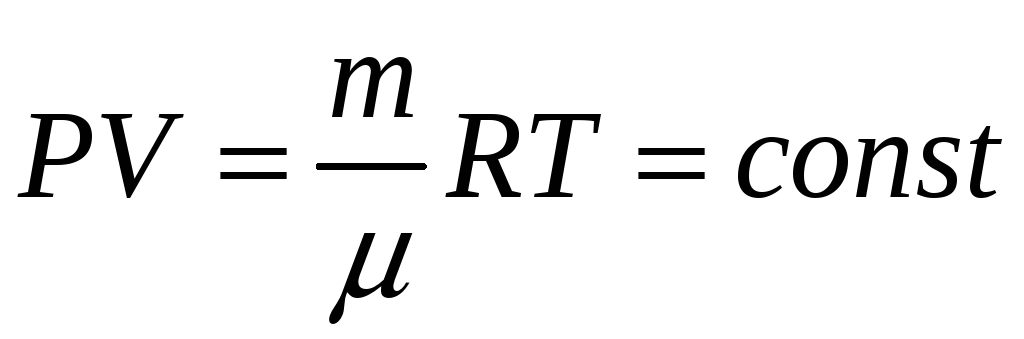
V
3.V=const – изохорный процесс;

ЗАКОН ШАРЛЯ:
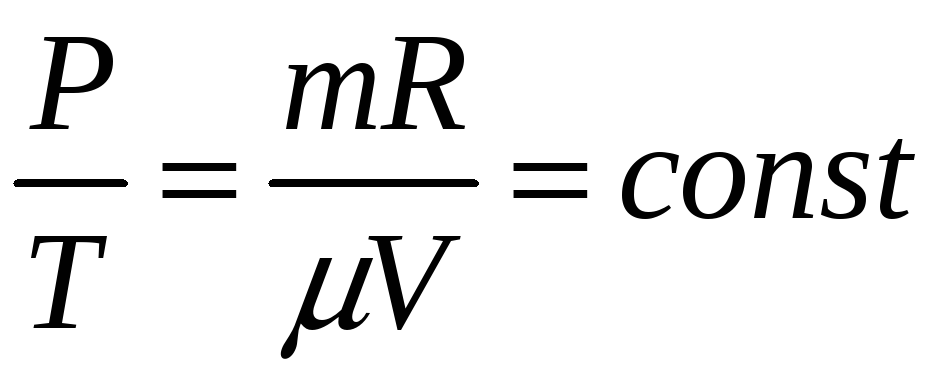
4. Адиабатический процесс;
Адиабатический процесс – процесс, протекающий без теплообмена с внешней средой.
ВЫВОД УРАВНЕНИЯ АДИАБАТЫ

![]()
- уравнение адиабаты или уравнение Пуассона.
![]() ;
;
![]() ;
;
![]() .
.
Адиабата в PV координатах убывает круче, чем изотерма.
PV=const
dP*V+P*dV=0
![]() ;
;
![]()
![]()
![]() ;
;
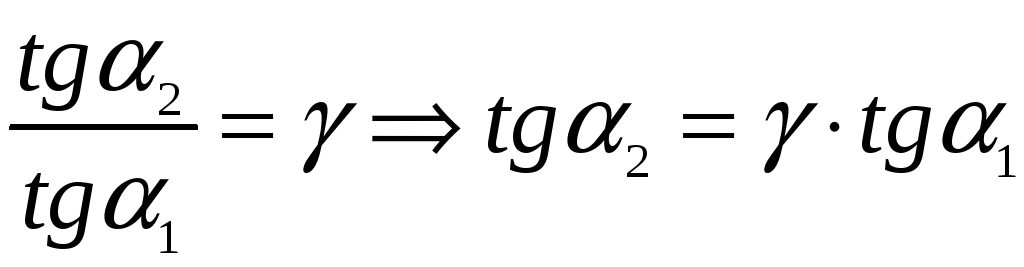
Касательная у
адиабаты в
![]() раз круче, чем у изотермы.
раз круче, чем у изотермы.
ПОЛИТРОПИЧЕСКИЙ ПРОЦЕСС
Политропический процесс – это процесс, в ходе которого теплоемкость тела не изменяется. Все рассмотренные нами изопроцессы можно представить себе, как политропические.

Изопроцессы – частные случаи политропического процесса.
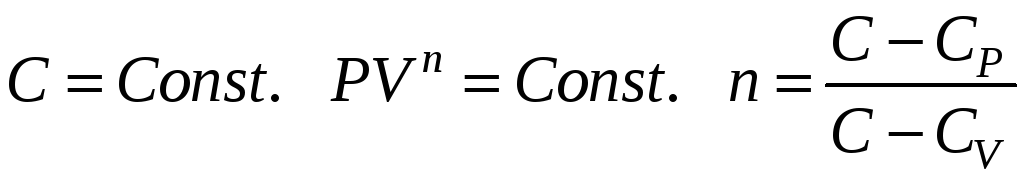
1. n=0 PV0=P*1=P=const;
![]() -
изобарический
процесс.
-
изобарический
процесс.
2.
![]() PVn=const
PVn=const
![]() ,
,
![]() ,
,
![]() ,
1*V=const,
V=const
– изохорический процесс.
,
1*V=const,
V=const
– изохорический процесс.
3. n=1 PV=const – изотермический процесс.
4. n=![]()
![]() - адиабатический процесс.
- адиабатический процесс.
РАБОТА ИДЕАЛЬНОГО ГАЗА В ИЗОПРОЦЕССАХ
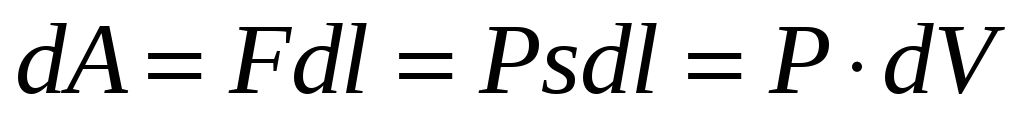
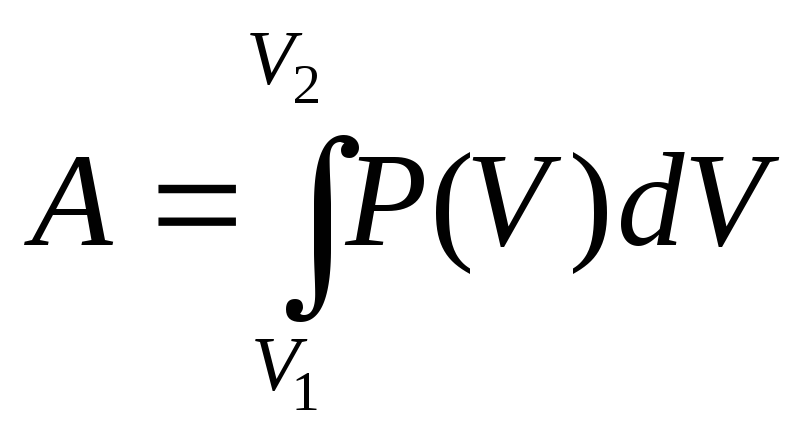
-
V=const – изохорический процесс
dA=PdV=0
-
P=const – изобарический процесс
A=P(V2-V1)
-
T=const – изотермический процесс
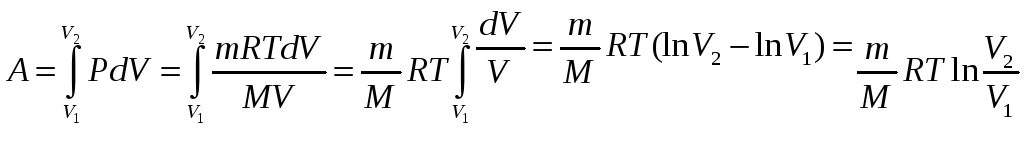
![]()
-
адиабатический процесс
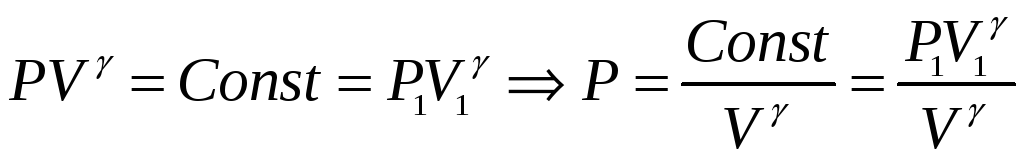
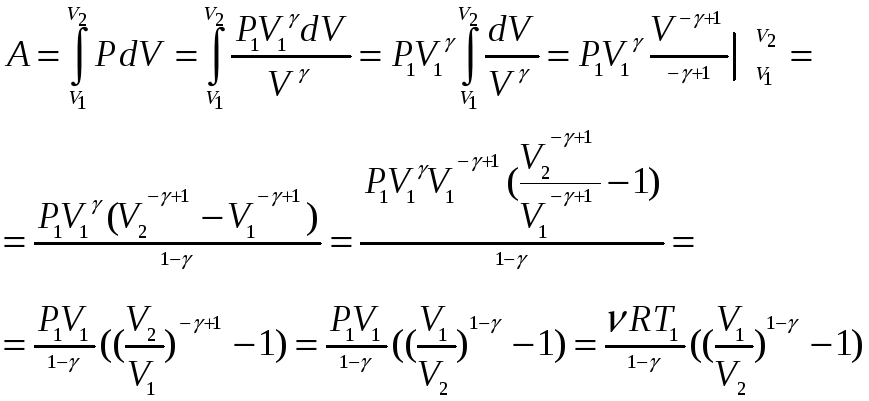
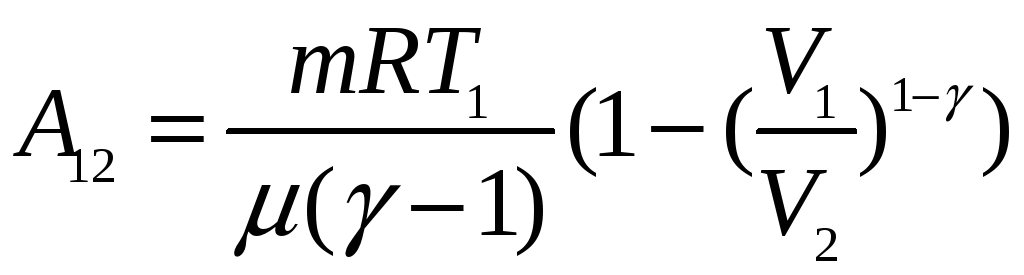
-
политропический процесс
![]()
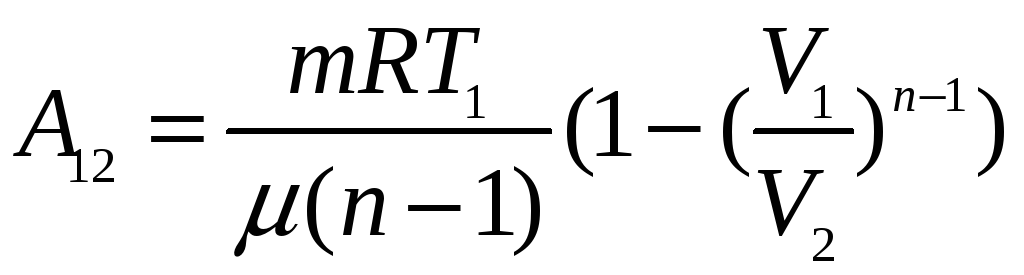
ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА
dQ=dU+dA
Теплоемкость тела - физическая величина равная производной от количества тепла по температуре.
C=dQ/dT
Для газа различают в зависимости от условий, в котором происходит нагрев газа следующую теплоемкость.
1. P=const Cp 2. V=const Cv
Для жидких и твердых тел теплоёмкость одинакова.
Теплоёмкость различают по количеству вещества:
1 - молярная теплоёмкость;
2 – удельная теплоемкость.
dQ=CdV
dQ=CvUdT, U - количество вещества;
dQ=CvMdT, M - масса вещества.
РАССМОТРИМ ДВА СЛУЧАЯ НАГРЕВАНИЯ ГАЗА.
1. При V=const C=Cv
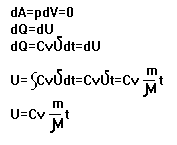
2 . При P=const C=Cp
Молярная теплоёмкость газа при постоянном давлении равно сумме молярной теплоёмкости при постоянном объеме плюс универсальная газовая постоянная.
Cp > Cv ==> Сp = Cv + P - Закон Майера
Количество теплоты, которое нужно подвести к газу при постоянном давлении больше чем при постоянном объеме связано это с тем что при постоянном давлении часть теплоты передаваемой газу переходит не во внутреннюю энергию, а идет на совершение работы при расширении газа.
Для идеального газа внутренняя энергия складывается исключительно из кинетической энергии поступательного движения бесконечно малых молекул идеального газа.
U=NWk, где N - число молекул.
Число степеней свободы механической системы - это количество независимых координат, с помощью которых может быть задано положение системы в пространстве. Если молекула рассматривается как бесконечно малый шарик, то её положение в пространстве задается координатами (x , y , z).
i - степень свободы.
Если молекула двухатомная, то i=5 , помимо трех координат поступательного движения эту молекулу будут определять еще две координаты вращательного движения.
Если же от идеального газа мы переходим к реальному газу, то есть, учитываем конечные размеры молекул или учитываем, что молекулы взаимодействуют дуг с другом, то к внутренней кинетической энергии поступательного или вращательного движения нужно добавить энергию взаимодействия молекул или энергию колебательного движения.
ЗАКОН О РАВНОРАСПРЕДЕЛЕНИИ ЭНЕРГИИ МОЛЕКУЛ ПО СТЕПЕНЯМ СВОБОДЫ:
1. На каждую степень свободы приходится одинаковая энергия равная 1/2 KT:

