
- •СТРОЕНИЕ АТОМА
- •Свойство материи - развитие – изменение, характеризующееся необратимостью, направленностью и закономерностью.
- •Виды материи частицы которых не имеют массы покоя – поля.
- •Между элементарными частицами совершаются взаимодействия, которые на сильные, электромагнитные и слабые.
- •Энергия – мера движения и взаимодействия всех видов материи.
- •ЭЛЕКТРОННАЯ ОБОЛОЧКА АТОМА. Этапы изучения строения атома:
- •4)В 1909 г. Р. Малликен определил заряд электрона: 1,6·10-19 Кл.
- •Противоречия модели Резерфорда:
- •Связь между частотой и энергией
- •Наибольшая энергия заключена в УФ-
- •Квантово-механическая модель атома
- •Постулат Планка
- •Модель Бора
- •Постулаты Бора:
- •Предположение де Бройля: электроны (как и все частицы) при движении проявляют свойства волны.
- •Согласно уравнению де Бройля:
- •Принцип дополнительности:
- •Материя (вещество и поле) обладает одновременно и корпускулярными и волновыми свойствами.
- •Неопределенность положения и скорости
- •Принцип неопределенности:
- •Волновое уравнение Шредингира
- •Решение уравнения Шредингира для атома водорода
- •зависит от трех пространственных координат.
- •-функция для 1s, 2s, 3s подуровней принимает разные значения. Для 2s и 3s
- •Квантовые числа
- •m - магнитное квантовое число –
- •s-подуровни в несильном постоянном магнитном поле не расщепляются.
- •Четвертое квантовое число - спиновое, обозначается ms, характеризует не орбиталь: а сам электрон.
- •Строение многоэлектронных атомов
- •Электроны, находящиеся на одной орбитали имеющие одинаковые значения квантовых чисел , кроме спинового
- •Вещества с неспаренными электронами парамагнитны.
- •Вещества, у которых все электроны спаренные-
- •Максимальное число электронов (энергетическая емкость):
- •Принцип наименьшего запаса энергии
- •На какой подуровень электрон должен
- •В каком порядке будут заполняться 3d, 5s, 4р орбитали?
- •Порядок заполнения подуровней:
- •Правило Хунда (Гунда): на данном подуровне электроны стремятся занять энергетические состояния таким образом,
- •Электроны верхнего заполняемого слоя - валентными электронами.
- •Возможные значения квантовых чисел для различных значений главного квантового числа
- •Подуровни р, d, f обладают повышенной устойчивостью, когда они не заполнены, заполнены наполовину
- •Энергетические характеристики атомов
- •Характеризует восстановительную способность вещества.
- •Сродство к электрону -
Принцип неопределенности:
В любой момент времени невозможно определить и положение в пространстве, и скорость (импульс) электрона.
В. Гейзенберг показал, что произведение неопределенностей в положении ( х) и в скорости ( или импульсе) электрона ( v) не может быть меньше определенной величины:
х· v x h/(2πm)
Так же и по всем остальным осям.

Волновое уравнение Шредингира
первые три члена – это сумма вторых производных волновой функции по координатам х, у, z (часто эту сумму обозначают), m – масса электрона, h – постоянная Планка
Физический. смысл волновой функции: её квадрат Ψ2 характеризует вероятность нахождения электрона в данной точке атомного пространства
Решение уравнения Шредингира для атома водорода
nlml = [N][Rnl(r)][Фlml (х/r, у/r, z/r)]
N – постоянная нормировки. Определяется из условия, что вероятность нахождения электрона где- либо в пространстве равна единице.
Rnl(r) – радиальная часть волновой функции.
/Rnl(r)/2 дает вероятность нахождения электрона на некотором расстоянии r от ядра.
Фlml(х/r, у/r, z/r) – угловая часть волновой функции
зависит от трех пространственных координат.
Электрон может находиться в любом месте пространства. В области, где значения 2 выше, он пребывает чаще и эти области соответствуют минимальной энергии электрона.
Совокупность мест пространства, где квадрат функции 2 имеет максимальное значение, называется электронной орбиталью, или электронным облаком атома.
Вероятность нахождения электрона в сферическом слое радиуса r толщиной dr называется плотностью электронного облака: D = 4 r2 2.
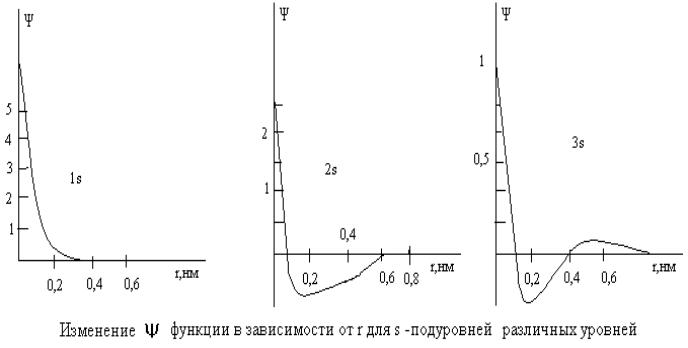
-функция для 1s, 2s, 3s подуровней принимает разные значения. Для 2s и 3s орбиталей может быть отрицательной, но 2 и D=4 r2 2 только положительны значения и поэтому кривые этих функций проходят через ряд максимумов.

Квантовые числа
Главное квантовое число n определяет энергию и размеры электронных орбиталей.
Оно принимает значения: 1,2,3,4,5...Чем больше n, тем выше энергия.
Орбитальное квантовое число l определяет форму атомной орбитали.
Принимает значения от 0 до n-1, всего n значений.
Каждое значение l имеет своё обозначение: s, p, d, f.

На первом энергетическом уровне (n = 1) могут находиться только s-электроны, его условная запись 1s. l=0(s-орбиталь). Форма орбитали сфера.

При n = 2 орбитальное квантовое число имеет два значения: l = 0 (s- электроны) и l = 1.
l = 1 (р- электроны), которым соответствует форма электронного облака, напоминающая гантель.
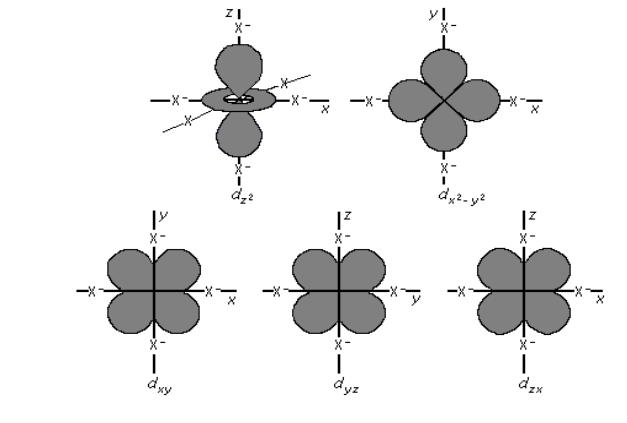
При n = 3 орбитальное квантовое число имеет три значения: 1=0, l=1 и 1=2.
1=2 (d-электроны). Их орбитали имеют более сложную форму, чем р –орбитали .
Электроны с 1=3 называют f–электронами, у них форма орбитали ещё более сложная, чем у d–электронов.
На одном и том же уровне энергия подуровней возрастает в ряду:
Es< Ep< Ed< Ef
1=4 -g-орбиталь , 1=5 - h –орбиталь.
