
- •Министерство образования российской
- •Содержание
- •От авторов
- •Молекулярная физика и термодинамика
- •11.1. Молекулярная физика и термодинамика. Основные положения и понятия. Динамические и статистические закономерности. Статистический и термодинамический методы исследования
- •11.2. Молекулярно-кинетическая теория
- •11.2.1. Модель идеального газа. Основное уравнение кинетической теории газов
- •11.2.2. Вывод основных газовых законов молекулярно кинетической теории
- •11.2.2.1. Закон Бойля-Мариотта
- •11.2.2.2. Закон Гей-Люссака
- •11.2.2.3. Закон Шарля
- •11.2.2.4. Объединенный газовый закон Мариотта - Гей-Люссака
- •11.2.2.5. Основное уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
- •11.2.2.6. Закон Авогадро
- •11.2.2.7. Закон Дальтона
- •11.3. Молекулярно-кинетический смысл абсолютной температуры
- •11.4. Экспериментальное подтверждение молекулярно-кинетической теории газов (опыт Штерна)
- •12.1. Распределение энергии по степеням свободы
- •12.2. Вероятность и флюктуации. Распределение молекул (частиц) по абсолютным значениям скорости. Распределение Максвелла. Скорости теплового движения частиц. Средняя длина свободного пробега молекул
- •12.3. Распределение Больцмана. Барометрическая формула
- •12.4. Внутренняя энергия и теплоемкости идеального газа. Классическая теория теплоемкостей
- •Формулы кинетической энергии молекул газа в зависимости от числа степеней свободы
- •13.1. Первое начало термодинамики
- •13.1.1. Первое начало термодинамики в применении к изопроцессам в идеальных газах
- •13.1.1.1. Изотермический процесс
- •13.1.1.2. Изобарический процесс
- •13.1.1.3. Изохорический процесс
- •13.1.1.4. Адиабатический процесс
- •13.2. Обратимые, необратимые и круговые процессы (циклы)
- •13.3. Цикл Карно. Максимальный кпд тепловой машины
- •13.4. Энтропия системы и её свойства. Определение изменения энтропии системы, совершающей какой-либо изопроцесс
- •1. Изотермический.
- •2. Изобарический.
- •3. Изохорический.
- •4. Адиабатический.
- •13.5. Второе начало термодинамики. Термодинамические потенциалы
- •13.5.1. Второе начало термодинамики
- •13.5.2. Термодинамические потенциалы
- •13.6. Третье начало термодинамики. Применения термодинамики
- •14.1. Термодинамика неравновесных процессов
- •14.2. Закон сохранения массы в термодинамике неравновесных процессов
- •14.3. Закон сохранения импульса в термодинамике неравновесных процессов
- •14.4. Закон сохранения энергии в термодинамике неравновесных процессов
- •14.5. Уравнение баланса энтропии
- •15.1. Реальные газы. Молекулярные силы. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и экспериментальны изотермы реальных газов
- •Критическая температура и температура кипения некоторых жидкостей
- •15.2. Внутренняя энергия реального газа
- •15.3. Эффект Джоуля - Томсона. Сжижение газов
- •15.4. Фазы и фазовые превращения. Фазовые диаграммы. Условия равновесия фаз
- •15.5. Уравнение Клапейрона-Клаузиуса. Метастабильные состояния. Критическая точка
- •15.6. Тройная точка. Фазовые переходы 1-го и 2-го рода
- •16.1. Понятие о физической кинетике. Вязкость жидкостей и газов. Коэффициент вязкости жидкостей и газов. Динамическая и кинематическая вязкости
- •16.2. Диффузия и теплопроводность. Коэффициенты диффузии и теплопроводности
- •Кинетические явления (явления переноса). Переносимая величина, уравнение процесса, коэффициент процесса
- •17.1. Строение жидкостей
- •17.2. Свойства жидкостей (вязкость, текучесть, сжимаемость и тепловое расширение)
- •17.3. Поверхностное натяжение. Энергия поверхностного слоя жидкости
- •17.4. Поверхностные явления на границе раздела двух жидкостей или жидкости и твердого тела
- •17.5. Капиллярные явления. Закон Жюрена
- •17.6. Кинематическое описание движения жидкости
- •17.7. Уравнения равновесия и движения жидкости. Стационарное движение идеальной жидкости. Уравнение Бернулли
- •17.8. Гидродинамика вязкой жидкости. Силы внутреннего трения. Коэффициент вязкости. Стационарное течение вязкой жидкости. Уравнение неразрывности. Течение по трубе. Формула Пуазейля
- •17.9. Жидкие кристаллы
- •17.9.1. Строение жидких кристаллов (жк)
- •17.9.2. Физические свойства жидких кристаллов и их применение
- •17.10. Магнитные жидкости
- •17.10.1. Структура магнитных жидкостей (мж)
- •17.10.2. Получение магнитных жидкостей
- •17.10.3. Свойства магнитных жидкостей
- •17.10.4. Применение магнитных жидкостей
- •17.11. Кристаллическое состояние
- •17.11.1. Отличительные черты кристаллического состояния
- •17.11.2 Классификация кристаллов
- •17.11.3 Физические типы кристаллических решеток
- •17.11.4 Тепловое движение в кристаллах. Теплоемкость кристаллов
- •17.11.5. Скорость звука в кристалле. Цепочечная модель
- •Можно записать дифференциальное уравнение
- •Библиографический список Основной
- •Дополнительный
- •Полунин Вячеслав Михайлович
- •Сычев Геннадий Тимофеевич
- •Конспект лекций по молекулярной физике и термодинамике для студентов инженерно-технических специальностей
12.2. Вероятность и флюктуации. Распределение молекул (частиц) по абсолютным значениям скорости. Распределение Максвелла. Скорости теплового движения частиц. Средняя длина свободного пробега молекул
Статистическая физика это раздел молекулярной физики, в котором изучаются свойства и движения не отдельных молекул (частиц), а совокупности частиц, характеризующиеся средними величинами.
Статистические закономерности - количественные закономерности, устанавливаемые статистическим методом, в котором рассматриваются лишь средние значения величин, характеризующих данную совокупность молекул (рассматривается конкретная молекулярная модель и к ней, применяются математические методы статистики, основанные на теории вероятностей).
Одними из основных понятий статистической физики являются: вероятность и флуктуации.
Вероятность это число способов, которыми может быть реализовано данное состояние макроскопической физической системы (предел, к которому стремится относительная частота появления некоторого события при достаточно большом, стремящемся к бесконечности числе повторений опыта при неизменных внешних условиях):
w = n/N, (12.3)
где N - число опытов;
n - число раз получено определенное событие.
Флуктуации это случайные отклонения физических величин от их среднего значения.
Согласно молекулярно-кинетической теории молекулы идеального газа находятся в непрерывном хаотическом движении с равномерным распределением по направлениям. Скорости молекул при этом изменяются по величине. Наиболее близкой к истинному значению скорости является средняя квадратичная скорость молекул, которая для газа массой "m" находящегося в состоянии равновесия, при T = const, остаётся постоянной
 или
или
![]() ,
(12.4)
,
(12.4)
где Ni - число молекул, обладающих скоростью vi;
N - число всех молекул.
Рассчитаем среднюю квадратичную скорость молекул воздуха при температуре 300К (270С). Будем считать, что воздух состоит из молекул азота (N2) с молярной массой 28 кг/кмоль, тогда
![]()
![]() м/с.
м/с.
Постоянство <vкв> объясняется тем, что в стационарном состоянии газа устанавливается стационарное распределение молекул по скоростям, подчиняющееся статистическому закону Максвелла.
Этот закон указывает на существование некоторой наиболее вероятной скорости движения молекул, в окрестности, которой в интервале (v + dv) находится большее число молекул, чем в окрестности другой скорости.
Возможные скорости движения молекул, заключенные в пределах от нуля до бесконечности, не равновероятны. Слишком большие по сравнению со средним квадратичным значением скорости могут реализоваться крайне редко, т.к. для этого должно реализоваться маловероятное явление, когда в результате случайных столкновений молекулы полностью передадут свою энергию одной (или нескольким) молекуле. Точно также практически исключено, что в результате соударений скорость молекулы станет равной нулю. Следовательно, очень малые и очень большие по сравнению со средним значением скорости маловероятны.
Из сказанного следует, что скорости молекул группируются в основном вблизи некоторого наиболее вероятного значения. Впервые функцию распределения молекул по скоростям получил Максвелл в 1860г. Мы воспользуемся готовым результатом и проанализируем его.
Пусть
![]() - общее число молекул, заполняющих сосуд,
- общее число молекул, заполняющих сосуд,![]() - число молекул, скорости которых
заключены в интервале отv
до v+dv.
Естественно считать, что
- число молекул, скорости которых
заключены в интервале отv
до v+dv.
Естественно считать, что
![]() прямо пропорционально общему числу
частиц
прямо пропорционально общему числу
частиц![]() и ширине интервала скоростейdv,
т.е.
и ширине интервала скоростейdv,
т.е.
![]() (12.5)
(12.5)
При этом коэффициент пропорциональности должен зависеть от v, т.е. = f(v). Максвелл получил
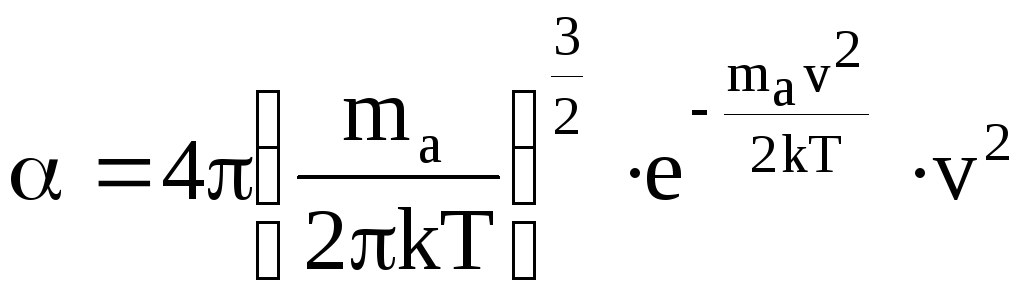 .
(12.6)
.
(12.6)
Подставляя (12.6) в (12.5) и разделив, обе части равенства, на dv получим
 .
(12.7)
.
(12.7)
Н а
рисунке 12.1 приведен график зависимости
а
рисунке 12.1 приведен график зависимости![]() для двух температур.
для двух температур.
Проанализируем эту зависимость. Зависимость имеет выраженный максимум, в точке v = vн. Значение vн называют наивероятнейшей скоростью. Если выделить три одинаковых по ширине интервала скоростей в области малых скоростей, в окрестности наивероятнейшей скорости и в области больших скоростей, как показано на рисунке, то можно сделать следующие выводы:
1. Число молекул, имеющих малые скорости, относительно мало.
2. Число молекул, имеющих очень большие скорости, относительно мало.
3. Большая часть молекул движется со скоростями, близкими к наивероятнейшей.
Неожиданным оказывается ответ на вопрос - сколько же молекул имеют вполне определенное значение скорости, например, имеют наивероятнейшую скорость? Ответ – нисколько, нуль !!! Действительно, поскольку ширина заданного интервала скоростей равна нулю, то площадь соответствующей полоски на графике также равна нулю. Т. е., в большой массе молекул, в данное мгновение может не найтись ни одной молекулы, имеющей скорость с точно заданным значением.
Найдем
значение наивероятнейшей скорости, для
чего исследуем функцию
![]() на экстремум. Возьмем от функции dN/dv
производную по v
и приравняем ее нулю:
на экстремум. Возьмем от функции dN/dv
производную по v
и приравняем ее нулю:
![]() .
Для упрощения операции обозначим
постоянный множитель буквой А, т.е.
.
Для упрощения операции обозначим
постоянный множитель буквой А, т.е.
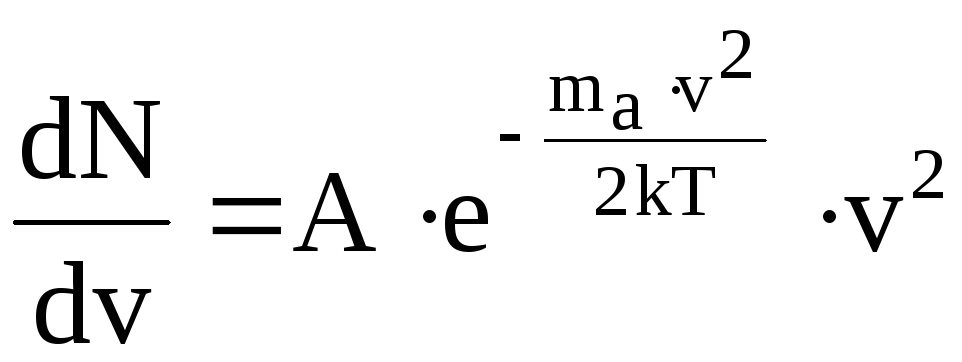 .
(12.8)
.
(12.8)
Тогда
 (12.9)
(12.9)
Откуда
![]() .
(12.10)
.
(12.10)
Таким
образом, получаем
![]() .
.
Из
выражений (12.10) видно, что с повышением
температуры Т максимум исследуемой
зависимости смещается вправо (рис.
12.1). Вместе с тем максимум становится
ниже. Это объясняется просто: если
максимум сместился вправо, то кривая
![]() становится шире, но площадь фигуры,
образованной кривой
становится шире, но площадь фигуры,
образованной кривой![]() и осью «O
- v»
– должна быть одинаковой при Т1
и T2,
т.к. указанные площади численно равны
одной и той же величине - числу молекул
внутри сосуда. Поэтому максимум для
кривой
и осью «O
- v»
– должна быть одинаковой при Т1
и T2,
т.к. указанные площади численно равны
одной и той же величине - числу молекул
внутри сосуда. Поэтому максимум для
кривой
![]() при T2
должен быть ниже чем максимум этой
кривой для Т1.
при T2
должен быть ниже чем максимум этой
кривой для Т1.
По своему численному значению наивероятнейшая скорость близка к средней квадратичной скорости, характеризуется аналогичной зависимостью от температуры.
Молекулы
газа, находясь в тепловом движении,
непрерывно сталкиваются друг с другом.
Минимальное расстояние, на которое
сближаются при столкновении центры
двух молекул, называется эффективным
диаметром молекулы
d.
Эффективный диаметр несколько уменьшается
при увеличении скорости молекул, т. е.
с повышением температуры. Величина
![]() называетсяэффективным
сечением молекулы.
называетсяэффективным
сечением молекулы.
Средний путь, проходимый молекулой между двумя последовательными столкновениями, называется средней длиной свободного пробега .
За
1 с молекула проходит в среднем путь,
равный средней скорости
![]() .
Если за 1 с в среднем происходит
.
Если за 1 с в среднем происходит![]() столкновений,
то средняя длина пробега
столкновений,
то средняя длина пробега
![]() . (12.11)
. (12.11)
П редположим,
что все молекулы, кроме данной молекулы,
застыли неподвижно на своих местах
(рис. 12.2).
редположим,
что все молекулы, кроме данной молекулы,
застыли неподвижно на своих местах
(рис. 12.2).
Столкновение
происходит в том случае, если центр
молекулы, с которой сталкивается данная
молекула, лежит внутри цилиндра радиуса
d. За
1 с данная молекула столкнется с
неподвижными молекулами столько раз,
сколько находится внутри такого цилиндра
длиной l
= │v│∙1 c.
Объем этого цилиндра составляет V
=
![]() ;
число молекул, заключенных в немN
=
;
число молекул, заключенных в немN
=
![]() (n – концентрация), следовательно, число
столкновений
(n – концентрация), следовательно, число
столкновений
![]() .
(12.12)
.
(12.12)
В
действительности все молекулы движутся,
вследствие чего число соударений
определяется средней скоростью движения
молекул по отношению друг к другу. Как
показывает расчет, средняя скорость
относительного движения молекул в
![]() раз больше │v│ (относительно стенок
сосуда). Поэтому
раз больше │v│ (относительно стенок
сосуда). Поэтому
![]() (12.13)
(12.13)
Подставляя (12.13) в (12.11), получим
![]() или
или
![]() .
(12.14)
.
(12.14)
Поскольку, при постоянной температуре, n изменяется пропорционально p (p = n∙k∙T), то
![]() (12.15)
(12.15)
Так, например, при нормальных условиях n = 2,681025 м ˉ³, эффективный диаметр молекулы ~1 Å = 10-10 м, поэтому длина свободного пробега 0 = 210-7 м, а при давлении 0,1 Па 0,10 м.
Учёт взаимодействия между молекулами показывает, что при возрастании температуры средняя длина свободного пробега несколько увеличивается. Средняя длина свободного пробега при какой-то температуре Т может быть определена по формуле
![]() (12.16)
(12.16)
где C - постоянная Сезерленда, зависящая от интенсивности молекулярных взаимодействий.
<o>- длина свободного пробега молекул без учёта их взаимодействий.
Средняя длина свободного пробега молекул играет большую роль при молекулярно-кинетическом объяснении явлений переноса.
