
- •Министерство образования российской
- •Содержание
- •От авторов
- •Молекулярная физика и термодинамика
- •11.1. Молекулярная физика и термодинамика. Основные положения и понятия. Динамические и статистические закономерности. Статистический и термодинамический методы исследования
- •11.2. Молекулярно-кинетическая теория
- •11.2.1. Модель идеального газа. Основное уравнение кинетической теории газов
- •11.2.2. Вывод основных газовых законов молекулярно кинетической теории
- •11.2.2.1. Закон Бойля-Мариотта
- •11.2.2.2. Закон Гей-Люссака
- •11.2.2.3. Закон Шарля
- •11.2.2.4. Объединенный газовый закон Мариотта - Гей-Люссака
- •11.2.2.5. Основное уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
- •11.2.2.6. Закон Авогадро
- •11.2.2.7. Закон Дальтона
- •11.3. Молекулярно-кинетический смысл абсолютной температуры
- •11.4. Экспериментальное подтверждение молекулярно-кинетической теории газов (опыт Штерна)
- •12.1. Распределение энергии по степеням свободы
- •12.2. Вероятность и флюктуации. Распределение молекул (частиц) по абсолютным значениям скорости. Распределение Максвелла. Скорости теплового движения частиц. Средняя длина свободного пробега молекул
- •12.3. Распределение Больцмана. Барометрическая формула
- •12.4. Внутренняя энергия и теплоемкости идеального газа. Классическая теория теплоемкостей
- •Формулы кинетической энергии молекул газа в зависимости от числа степеней свободы
- •13.1. Первое начало термодинамики
- •13.1.1. Первое начало термодинамики в применении к изопроцессам в идеальных газах
- •13.1.1.1. Изотермический процесс
- •13.1.1.2. Изобарический процесс
- •13.1.1.3. Изохорический процесс
- •13.1.1.4. Адиабатический процесс
- •13.2. Обратимые, необратимые и круговые процессы (циклы)
- •13.3. Цикл Карно. Максимальный кпд тепловой машины
- •13.4. Энтропия системы и её свойства. Определение изменения энтропии системы, совершающей какой-либо изопроцесс
- •1. Изотермический.
- •2. Изобарический.
- •3. Изохорический.
- •4. Адиабатический.
- •13.5. Второе начало термодинамики. Термодинамические потенциалы
- •13.5.1. Второе начало термодинамики
- •13.5.2. Термодинамические потенциалы
- •13.6. Третье начало термодинамики. Применения термодинамики
- •14.1. Термодинамика неравновесных процессов
- •14.2. Закон сохранения массы в термодинамике неравновесных процессов
- •14.3. Закон сохранения импульса в термодинамике неравновесных процессов
- •14.4. Закон сохранения энергии в термодинамике неравновесных процессов
- •14.5. Уравнение баланса энтропии
- •15.1. Реальные газы. Молекулярные силы. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса и экспериментальны изотермы реальных газов
- •Критическая температура и температура кипения некоторых жидкостей
- •15.2. Внутренняя энергия реального газа
- •15.3. Эффект Джоуля - Томсона. Сжижение газов
- •15.4. Фазы и фазовые превращения. Фазовые диаграммы. Условия равновесия фаз
- •15.5. Уравнение Клапейрона-Клаузиуса. Метастабильные состояния. Критическая точка
- •15.6. Тройная точка. Фазовые переходы 1-го и 2-го рода
- •16.1. Понятие о физической кинетике. Вязкость жидкостей и газов. Коэффициент вязкости жидкостей и газов. Динамическая и кинематическая вязкости
- •16.2. Диффузия и теплопроводность. Коэффициенты диффузии и теплопроводности
- •Кинетические явления (явления переноса). Переносимая величина, уравнение процесса, коэффициент процесса
- •17.1. Строение жидкостей
- •17.2. Свойства жидкостей (вязкость, текучесть, сжимаемость и тепловое расширение)
- •17.3. Поверхностное натяжение. Энергия поверхностного слоя жидкости
- •17.4. Поверхностные явления на границе раздела двух жидкостей или жидкости и твердого тела
- •17.5. Капиллярные явления. Закон Жюрена
- •17.6. Кинематическое описание движения жидкости
- •17.7. Уравнения равновесия и движения жидкости. Стационарное движение идеальной жидкости. Уравнение Бернулли
- •17.8. Гидродинамика вязкой жидкости. Силы внутреннего трения. Коэффициент вязкости. Стационарное течение вязкой жидкости. Уравнение неразрывности. Течение по трубе. Формула Пуазейля
- •17.9. Жидкие кристаллы
- •17.9.1. Строение жидких кристаллов (жк)
- •17.9.2. Физические свойства жидких кристаллов и их применение
- •17.10. Магнитные жидкости
- •17.10.1. Структура магнитных жидкостей (мж)
- •17.10.2. Получение магнитных жидкостей
- •17.10.3. Свойства магнитных жидкостей
- •17.10.4. Применение магнитных жидкостей
- •17.11. Кристаллическое состояние
- •17.11.1. Отличительные черты кристаллического состояния
- •17.11.2 Классификация кристаллов
- •17.11.3 Физические типы кристаллических решеток
- •17.11.4 Тепловое движение в кристаллах. Теплоемкость кристаллов
- •17.11.5. Скорость звука в кристалле. Цепочечная модель
- •Можно записать дифференциальное уравнение
- •Библиографический список Основной
- •Дополнительный
- •Полунин Вячеслав Михайлович
- •Сычев Геннадий Тимофеевич
- •Конспект лекций по молекулярной физике и термодинамике для студентов инженерно-технических специальностей
15.4. Фазы и фазовые превращения. Фазовые диаграммы. Условия равновесия фаз
Испарение жидкости, плавление твердого тела являются процессами, которые называются фазовыми превращениями (переходами).
Фазовые превращения это переход вещества из одной фазы в другую, связанный с качественными изменениями свойств вещества, при изменении внешних условий. Характерной особенностью этих процессов является их скачкообразность.
Состояние вещества, между которыми происходит фазовый переход, называются фазами. В этом смысле различными фазами являются агрегатные состояния вещества: газообразное, жидкое и твердое (кристаллическое). Однако понятие фаз является более широким, чем понятие об агрегатных состояниях, так как в пределах одного и того же состояния вещества могут существовать различные фазы.
В термодинамике фаза это равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества.
Переход вещества из одной фазы в другую происходит (при заданном давлении) всегда при строго определенной температуре. Так при атмосферном давлении лед начинает плавиться при 0 0С и при дальнейшем нагревании температура остается неизменной вплоть до момента, когда лед превратится в воду. В течение этого процесса лед и вода существуют одновременно, соприкасаясь, друг с другом. Точка перехода - значение температуры, давления или какой-либо другой величины, при котором происходит фазовый переход.
Температура, при которой происходит фазовое превращение, называется температурой фазового перехода. При температуре фазового превращения (перехода) наблюдается тепловое равновесие между двумя фазами.
В отсутствии внешних воздействий (в том числе подвода извне тепла) две фазы могут существовать неограниченно долго. При температурах выше или ниже температуры фазового перехода может существовать лишь одна (та или иная) из фаз.
При изменении давления изменяется и температура фазового перехода. Между температурой фазового перехода (превращения) вещества и давлением имеется строго определенная зависимость. Эту зависимость можно изобразить графически в виде кривой на так называемой фазовой диаграмме (диаграмме состояний), на осях координат которой откладываются давление p и температура T (рис.15.7). Таким образом, линии (поверхности) равновесия фаз это графики, изображающие зависимость одних термодинамических переменных от других в условиях фазового равновесия. Диаграммы состояния - совокупность линий (поверхностей) равновесия фаз. Точка на диаграмме состояния, соответствующая критическому состоянию вещества называется критической точкой. В случае двухфазного равновесия - точка окончания линии (поверхности) равновесия фаз. Состояние вещества в критической точке определяется критическими значениями температуры Tk, давления pk и объема Vk.
К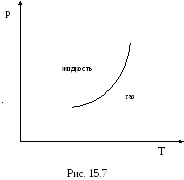 ривая
фазового перехода, например, между
жидкостью и ее паром, определяет условия,
при которых жидкость и пар могут
существовать в равновесии друг с другом.
Кривая разделяет плоскость на две части,
одна из которых соответствует состояниям
одной фазы, а другая – состояниям другой
фазы. Так как в данном случае при заданном
давлении более высоким температурам
соответствует пар, а более низким
температурам – жидкость, то область
справа от кривой соответствует
газообразной фазе, а область слева -
жидкой фазе. Точки самой кривой
соответствуют состояниям, в которых
существуют одновременно обе фазы.
ривая
фазового перехода, например, между
жидкостью и ее паром, определяет условия,
при которых жидкость и пар могут
существовать в равновесии друг с другом.
Кривая разделяет плоскость на две части,
одна из которых соответствует состояниям
одной фазы, а другая – состояниям другой
фазы. Так как в данном случае при заданном
давлении более высоким температурам
соответствует пар, а более низким
температурам – жидкость, то область
справа от кривой соответствует
газообразной фазе, а область слева -
жидкой фазе. Точки самой кривой
соответствуют состояниям, в которых
существуют одновременно обе фазы.
Ф азовую
диаграмму можно изобразить не только
в координатахp
и T,
но и в других координатах, например p,
V
или V,
T,
где V
– объем, отнесенный к какому-либо
определенному количеству вещества.
Обычно под V
подразумевается удельный объем – объем
единицы массы вещества (объем, который
занимает единица массы вещества).
азовую
диаграмму можно изобразить не только
в координатахp
и T,
но и в других координатах, например p,
V
или V,
T,
где V
– объем, отнесенный к какому-либо
определенному количеству вещества.
Обычно под V
подразумевается удельный объем – объем
единицы массы вещества (объем, который
занимает единица массы вещества).
Рассмотрим фазовую диаграмму в координатах V, T (рис.15.8). Пусть имеется газ с удельным объемом и температурой, соответствующими некоторой точке "а". При уменьшении объема (сжатии) газа при неизменной температуре, точка, отображающая его состояние, будет перемещаться влево по прямой, параллельной оси V. При некотором определенном давлении, которому соответствует удельный объем Vг (точка А), начнется конденсация газа в жидкость. Дальнейшее уменьшение объема (сжатие) системы количество жидкости будет возрастать, а количество газа – уменьшаться и, наконец, при достижении определенной точки (В) все вещество станет жидким с удельным объемом Vж.
Удельные объемы газа (Vг) и жидкости (Vж) являются функциями температуры, при которой происходит переход. Изобразив эти две функции Vг = f1(T) и Vж = f2(T) получим фазовую диаграмму изображенную на рис.15.8. Области диаграммы справа и слева от заштрихованной части соответствуют газообразной и жидкой фазам. Заштрихованная же область между кривыми – область существования двух фаз. Горизонтальные прямые диаграммы имеют определенный смысл: точки "А" и "В" пересечения горизонтальной прямой, проведенной через некоторую точку "С" этой области, определяют удельные объемы сосуществующих в этой точке жидкости и пара. Различные точки отрезка "АВ" соответствуют равновесию одних и тех же жидкости и пара, но в различных относительных количествах. Количества пара и жидкости обратно пропорциональны длинам отрезков от точки "С" до точек "А" и "В"
![]() .
(15.26)
.
(15.26)
Аналогично выглядит и диаграмма в координатах p, V. Отличие рассмотренной диаграммы (и диаграммы, построенной в координатах p, V) от диаграммы, представленной на рис.15.7, состоит в том, что на диаграмме в координатах p, T, область существования двух фаз сжата в одну линию. Отличие связано с тем, что находящиеся в равновесии фазы имеют одинаковые давления и температуры (согласно условиям всякого теплового равновесия); удельные же объемы этих фаз различны.
