8
.docx8.
|
№ задачи |
Формула вещества |
Масса одного моля |
Масса вещества (г) |
Количество молей |
Количество молекул |
Объем данного количества вещества при н. у. Указать только для газов |
|
8 |
NН3 |
17 |
3,4 |
0,2 |
0,2 |
4,48 |
|
NH4NO3 |
80 |
0,8 |
0,01 |
6,02 |
Твердое вещество |
14. Составьте формулы всех солей, соответствующих кислотам и основаниям, приведенным для вашего задания в таблице 2. Написать уравнения реакций их получения из кислоты и основания в молекулярной и ионной форме. Для амфотерных гидроксидов необходимо составлять формулы их солей, образованных как при реакциях с кислотами, так и с основаниями.
При написании уравнений руководствоваться таблицей растворимости и таблицей степеней диссоциации.
|
14 |
NH4OH |
Cu(OH)2 |
H2CO3 |
H2SeO4 |
(NH4)2CO3 –Карбонат аммония
NH4HCO3 – гидрокарбонат аммония
NH4 HSeO4 - Гидроселенат аммония
CuCO3 – карбонат меди
Cu(HCO3)2 – гидрокарбонат меди
(CuOH)2CO3 - -гидроксокарбонат меди
CuSeO4 – селенат меди
Cu(HSeO4) – гидроселенат меди
(CuOH)2SeO4 – гидроксоселенат меди
2NH4OH + H2CO2 → (NH4)2CO3+ 2H2O
2NH4OH + H2CO2 → 2NH4+ +CO32- + 2H2O
2NH4OH + NH4 HSeO4 → (NH4)2 SeO4 + 2H2O
2NH4OH + 2H + SeO42- → 2NH4+ + SeO42- +2H2O
2NH4OH + 2H+ → 2NH4+ + 2H2O
NH4OH +H2CO3 → NH4HCO3 + H2O
NH4OH + H2CO3 → NH4+ +HCO3 + H2O
Cu(OH)2 + H2CO3 → X
Cu(OH)2 +H2SeO4 →CuSeO4 + 2H2O
Cu(OH)2 + 2H+ + SeO42- → Cu2+ + SeO42- + 2H2O
Cu(OH)2 + 2H+ → Cu2++ 2H2O
Cu(OH)2 + H2SeO4→ Cu(OH)2SeO4 + 2H2O
Cu(OH)2+ 2H+ + SeO42 → 2CuOH++ SeO42+ 2H2O
Cu(OH)2+ 2H+ → 2CuOH+ + H2O
Cu(OH)2 + 2H2SeO4 → Cu(HSeO4) +H2O
Cu(OH)2+2H+ + 2SeO42- → Cu2++ H2O+ 2H++ 2SeO42-
Cu(OH)2+2H+ → Cu2++H2O
30.
+18 Ar ) ) )
2e 8e- 8e-
1s22s22p63s23p6
N=3
s
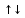
p
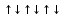
Слой завершённый, распаривания электронов не происходит
+26 Fe ) ) ) )
2e- 8e- 14 2e-
1s22s22p63s23p64823d6
|
|
|
|


|
|
|
|
|
|
s p d
Возможно переход на 4p подуровней и проявление валентности II и III.
38. Элементы 5 А группы.
Заряд ядра увеличивается.
Радиус ядра увеличивается.
Электроотрицательность увеличивается.
Степень окисления одинаковая.
С увеличением радиуса атома увеличивается металлическое свойство и уменьшаются неметаллические свойства.
Увеличивается способность отдавать электроны с последнего слоя.
Свойства оксидов и гидроксидов изменяются от кислотных через амфотерных к основным.
48.
Нитрит аммония
NH4NO2
NH4 – O – N = O
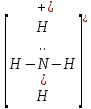
NH4+ NO2- ионная связь
В ионе NH4+ ковалентная полярная связь
55.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
|
№ задания |
Реакция |
Изменение температуры |
Температурный коэффициент у |
Изменение давления |
|
55 |
СаО+СО2 = СаСО3 |
- |
- |
увеличение в 3 раза |
СаО+СО2 = СаСО3
Vx•p1 = k• [CO2]
Увеличение давления в 3 раза
Vx•p2 = k•3 [CO2]
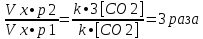
69.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
![]()
![]()
Константа Kв,- равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
73.
|
№ задания |
Растворенное вещество |
Концентрация раствора |
|
||
|
процента. |
молярная |
нор-мальн. |
Плотность раствора |
||
|
73 |
NаОН |
5 |
|
|
1,05 |
NaOH
W(NaOH) = 5%
P = 1.05г/моль
mраствора= 100г
M(NaOH) = 40г/моль
m(NaOH) = 5г
V(NaOH) = 5/40= 0.125 моль
Vраствора = 100/1,05= 95,24 мл - 0,09524л
См = 0,125/0,09524 = 1.3 моль/л
Mэ = 40/1 = 40 г .
Сн = 5/40*0,09524 = 1.3
90. Сульфат железа (II), фосфат калия.
1.FeSO4 → Fe2+ + SO42-
FeSO4
+ HOH
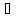 FeOH2+
+ H+
р.ср.кисл.
FeOH2+
+ H+
р.ср.кисл.
2Fe2+
+ 2HOH+
SO42-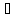 2FeOH2+
+ SO42+
+2H+
2FeOH2+
+ SO42+
+2H+
2FeSO4
+ 2H2O
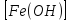 2
+ SO4
+ H2SO4
2
+ SO4
+ H2SO4
Kr=
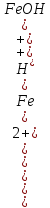
2.K3PO4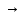 3K+
+ PO43-
3K+
+ PO43-
PO43-
+ HOH
 HPO42-
+ OH-
р.ср.
щелоч.
HPO42-
+ OH-
р.ср.
щелоч.
3K++
PO43-
+ HOH
 3K+
+ HPO42-
+ OH-
3K+
+ HPO42-
+ OH-
K3PO4
+ HOH
 K2HPO4
+ KOH
K2HPO4
+ KOH
Kr=

96.
|
№ задания |
Комплексообразо-ватель |
Лиганд |
Координационное число |
Внутренняя сфера комплекса |
Ионы внешней сферы |
Формула комплексного соединения |
Выражение для общей константы устойчивости комплексного иона |
|
96 |
|
|
|
[PtBr6]2- |
Na+ |
Fe3[Fe(CN)6]4 |
|
Pt4+ - комплексообразователь
Br – лиганд
6 – координатное число
Na2[PtBr6] – гексобромплатинат натрия (IV)
118. Хлор
Xлор имеет tкип - 34,05 °С, tпл - 101 °С. Плотность газообразного хлора при нормальных условиях 3,214 г/л; насыщенного пара при 0 °С 12,21 г/л; жидкого хлора при температуре кипения 1,557 г/см3; твёрдого хлора при -102 °С 1,9 г/см3. Давление насыщенных паров хлора при 0 °С 0,369; при 25 °С 0,772; при 100 °С 3,814 Мн/м2 или соответственно 3,69; 7,72; 38,14 кгс/см2. Теплота плавления 90,3 кдж/кг (21,5 кал/г); теплота испарения 288 кдж/кг (68,8 кал/г); теплоёмкость газа при постоянном давлении 0,48 кдж/(кг*К) [0,11 кал/(г*°С)]. Xлор хорошо растворяется в ТiСl4, SiCl4, SnCl4 и некоторых органических растворителях (особенно в гексане и четырёххлористом углероде). Молекула хлора двухатомна (Cl2). Степень термической диссоциации Cl2+243 кдж 2Cl при 1000 К равна 2,07*10-4%, при 2500 К 0.909%.
Внешняя электронная конфигурация атома Сl Зs2 3р5. В соответствии с этим хлор в соединениях проявляет степени окисления -1, +1, +3, +4, +5, +6 и +7. Ковалентный радиус атома 0,99А, ионный радиус Сl- 1,82А, сродство атома хлора к электрону 3,65 эв, энергия ионизации 12,97 эв.
Химически хлор очень активен, непосредственно соединяется почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании) и с неметаллами (кроме углерода, азота, кислорода, инертных газов), образуя соответствующие хлориды, вступает в реакцию со многими соединениями, замещает водород в предельных углеводородах и присоединяется к ненасыщенным соединениям. Хлор вытесняет бром и иод из их соединений с водородом и металлами; из соединений хлора с этими элементами он вытесняется фтором. Щелочные металлы в присутствии следов влаги взаимодействуют с хлором с воспламенением, большинство металлов реагирует с сухим хлором только при нагревании. Сталь, а также некоторые металлы стойки в атмосфере сухого хлора в условиях невысоких температур, поэтому их используют для изготовления аппаратуры и хранилищ для сухого хлора. Фосфор воспламеняется в атмосфере хлора, образуя РСl3, а при дальнейшем хлорировании - РСl5; сера с хлором при нагревании дает S2Сl2, SСl2 и другие SnClm. Мышьяк, сурьма, висмут, стронций, теллур энергично взаимодействуют с хлором. Смесь хлора с водородом горит бесцветным или желто-зеленым пламенем с образованием хлористого водорода (это цепная реакция).
Максимальная температура водородно-хлорного пламени 2200 °С. Смеси хлора с водородом, содержащие от 5,8 до 88,3% Н2, взрывоопасны.
С кислородом хлор образует окислы: Cl2O, ClO2, Cl2O6, Cl2O7, Cl2O8, а также гипохлориты (соли хлорноватистой кислоты), хлориты, хлораты и перхлораты. Все кислородные соединения хлора образуют взрывоопасные смеси с легко окисляющимися веществами. Окислы хлора малостойки и могут самопроизвольно взрываться, гипохлориты при хранении медленно разлагаются, хлораты и перхлораты могут взрываться под влиянием инициаторов.
Xлор в воде гидролизуется, образуя хлорноватистую и соляную кислоты:
Сl2 + Н2О НСlО + НСl.
При хлорировании водных растворов щелочей на холоду образуются гипохлориты и хлориды:
2NаОН + Сl2 = NаСlO + NаСl + Н2О,
а при нагревании - хлораты. Хлорированием сухой гидроокиси кальция получают хлорную известь. При взаимодействии аммиака с хлором образуется трёххлористый азот. При хлорировании ограниченных соединений хлор либо замещает водород:
R--Н + Сl2 = RСl + НСl,
либо присоединяется по кратным связям:
С=С + Сl2 СlС--ССl
образуя различные хлорсодержащие органические соединения.
Xлор образует с другими галогенами межгалогенные соединения. Фториды СlF, СlF3, СlF5 очень реакционноспособны; например, в атмосфере СlF3 стеклянная вата самовоспламеняется. Известны соединения хлора с кислородом к фтором - оксифториды хлора: СlО3F, СlО2F3, СlOF, СlОF3 и перхлорат фтора FСlO4.

 6,0223
6,0223 1021
1021