
Химия ЗФ 2008
.pdf
Подставляем значения в формулу (1.21): J = 3 А; t = 36000 с; n = 2. Получаем:
63,5 36000 3
mCu = 2 96500 0,8 = 28,4 (г).
Масса кислорода
mO 2 |
= |
MO |
J t |
|
2 |
|
ВТ , |
||
n F
где М(О2) = 32 г/моль – мольная масса кислорода, n = 4. Получаем:
32 36000 3
mO2 = 4 96500 0,8 = 72 (г).
1.8. Коррозия металлов
Литература: [8, § 58 – 61; 9].
Пример 17. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в кислую среду (HCl)? Приведите схему образующегося при этом гальванического элемента.
Решение. Исходя из положения металлов в ряду напряжений видим, что хром является более активным металлом, чем медь (более низкое значение
электродного потенциала: ϕ°Cr3+/Cr = –0,744 В), и в образующейся гальвани-
ческой паре будет анодом. Медь является катодом, ϕ°Cu2+/Cu = 0,337 В. Хромовый анод растворяется, а на медном катоде выделяется водород:
|
0 |
_ |
_ |
|
|
3+ |
|
Cr |
|
|
3 e |
|
|
Cr |
2 |
|
|
_ |
|||||
2 H+ + 2 e |
H0 |
3 |
|||||
|
|
|
|
|
|
2 |
|
2 Cr + 6 H+ |
|
2 Cr3+ + 3 H |
|
||
|
2 |
|
2 Cr + 6 HCl |
|
2 CrCl3 + 3 H2 |
Схема работающего гальванического элемента может быть представлена следующим образом:
e
(_ ) 2 Cr / 2 Cr3+ | HCl | 3 H2 (Cu) (+)
Пример 1 8 . При нарушении целостности поверхностного слоя медного покрытия на алюминии будет протекать коррозия алюминия из-за образования
21

гальванопары:
e
(_ ) 2 Al / Al3+ | H2SO4 | 3 H2 / 6 H+ (Cu) (+)
За 45 с работы этой гальванопары на катоде выделилось 0,09 л водорода (измеренного при н. у.). Сколько граммов алюминия растворилось за это время и какую силу тока дает эта гальванопара?
Решение. Максимальная сила тока, получаемая от гальванического элемента, определяется соотношением:
I = m F / Мэ |
(27а) |
или |
|
I = V F / Vэ |
(27б) |
где I – сила тока, А; m (V) – масса (объем) растворившегося за 1 с более активного электрода или выделившегося за 1 с вещества на катоде; F − постоянная Фарадея; Мэ (Vэ) – эквивалент (эквивалентный объем) элемента, из которого сделан более активный электрод, или эквивалент элемента, выделяющегося на катоде.
За 1 с на катоде выделится 0,002 л Н2 (0,09 : 45).
Гальванический элемент дает ток I силой 17,2 А (0,002·96500 / 11,2). Эквивалент алюминия равен 9 г/моль-экв.
Вычислим масса растворившегося алюминия за 45 с работы коррозийной гальванопары:
m = 9 17,2 45 = 0,072 г.
Al |
96500 |
|
Пример 19. Как происходит атмосферная коррозия луженого железа при нарушении целостности покрытия? Приведите уравнения реакций образования вторичных продуктов коррозии железа с учетом окисления гидроксида железа (II) до гидроксида железа (III), приводящего к образованию ржавчины.
Решение. Для защиты железа от коррозии используются различные покрытия: краска, слой металла (олова, цинка). При этом краска и олово предохраняют железо от коррозии до тех пор, пока защитный слой цел. Появление в защитном слое трещин и царапин способствует проникновению влаги и воздуха
к поверхности железа (ϕ°Fe2+/Fe = –0,44 В), и процесс коррозии возобновляется, 22

причем в случае оловянного покрытия он даже ускоряется, поскольку олово служит катодом в электрохимическом процессе (ϕ°Sn2+/Sn = –0,14 В). При соприкосновении поверхности железа с электролитом происходит процесс окисления железа и перехода его катионов в электролит:
Fe0 _ 2 e_  Fe2+
Fe2+
Поток электронов перемещается от железа к олову – к металлу с меньшей активностью, на нем накапливается избыточное количество электронов. Если бы в воде не было растворенного кислорода, то коррозия была бы невозможна. Следовательно, железо корродирует в слое воды, насыщенном кислородом. При восстановлении кислорода образуется гидроксильная группа. Представим процессы, осуществляемые в образовавшемся коррозийном гальваническом элементе:
А) Fe0 _ 2 e_ |
|
|
Fe2+ |
4 2 |
|||
|
|||||||
|
|
|
_ |
|
_ |
||
К) O2 + 2 H2O + 4 e |
|
|
4 OH 2 1 |
||||
|
|
||||||
2 Fe + O2 + 2 H2O |
|
|
|
2 Fe(OH)2 |
|||
|
|
|
|||||
Известно, что в водной среде ионы Fe2+ в присутствии кислорода окисляются до Fe3+, в результате чего полученный гидроксид железа (II) в присутствии кислорода и воды переходит в гидроксид железа (III):
4 Fe(OH)2 + O2 + 2 H2O  4 Fe(OH)3.
4 Fe(OH)3.
Таким образом образуется смесь гидроксидов железа, разлагающихся в дальнейшем на соответствующую смесь оксидов (ржавчину), а именно: Fe3O4
(FeO · Fe2O3 · nH2O).
2.КОНТРОЛЬНАЯ РАБОТА
2.1.Таблица вариантов к контрольной работе
Данные методические указания содержат 50 вариантов контрольной работы. Номер варианта определяется по двум последним цифрам индивидуального шифра студента. Если последние две цифры составляют число от 1 до 50, то номер варианта совпадает с этим числом. Если последние
23
две цифры шифра составляют число, которое больше 50, то для определения варианта их необходимо складывать.
Пример:
Иванов А. А., специальность – 1507, шифр – 7018, вариант – 18; Сидоров А. А., специальность – 1508, шифр – 6576, вариант – 13 (7 + 6). В соответствии с вариантом по таблице выбираются номера задач.
При изучении курса химии, решении контрольных задач и подготовке к экзамену необходимо выполнять следующие рекомендации. Изучение отдельных тем рекомендуется проводить в два этапа. При первом чтении следует получить общее представление о содержании темы и выявить наиболее сложные вопросы. При повторном чтении необходимо усвоить сущность темы, теоретические положения, математические зависимости, уравнения химических реакций.
При самостоятельном изучении теоретических вопросов курса рекомендуется вести рабочий конспект, в который следует записывать основные положения и определения, законы и понятия химии, формулы, уравнения реакций, математические зависимости, незнакомые термины и названия соединений, поскольку это способствует концентрации внимания, пониманию материала и является средством самоконтроля, источником информации. Кроме того, лучшему восприятию теоретического материала способствует составление графиков, схем, таблиц.
После изучения теоретического материала следует приступить к решению задач. Для этого рекомендуется ознакомиться с примерами решения задач в данных методических указаниях и в сборниках задач [3, 9]. Следует прорешать основные типы задач и сверить полученные результаты с ответами. Далее необходимо приступить к решению задач контрольной работы. Условие задачи должно быть записано полностью. Решение задачи должно содержать уравнения реакций, необходимые математические расчеты, используемый справочный материал, единицы измерения, ответ.
24
Номера задач к вариантам контрольной работы
Ва- |
Номера задач |
Ва- |
Номера задач |
ри- |
ри- |
||
ант |
|
ант |
|
|
|
|
|
1 |
1, 11, 21, 31, 41, 51, 61, 71 |
26 |
6, 15, 24, 33, 42, 51, 70, 79 |
2 |
2, 12, 22, 32, 42, 52, 62, 72 |
27 |
7, 16, 25, 34, 43, 52, 61, 80 |
3 |
3, 13, 23, 33, 43, 53, 63, 73 |
28 |
8, 17, 26, 35, 44, 53, 62, 71 |
4 |
4, 14, 24, 34, 44, 54, 64, 74 |
29 |
9, 18, 27, 36, 45, 54, 63, 72 |
5 |
5, 15, 25, 35, 45, 55, 65, 75 |
30 |
10, 19, 28, 37, 46, 55, 64, 73 |
|
|
|
|
6 |
6, 16, 26, 36, 46, 56, 66, 76 |
31 |
1, 19, 27, 35, 43, 60, 68, 76 |
7 |
7, 17, 27, 37, 47, 57, 67, 77 |
32 |
2, 20, 28, 36, 44, 51, 69, 77 |
8 |
8, 18, 28, 38, 48, 58, 68, 78 |
33 |
3, 11, 29, 37, 45, 52, 70, 78 |
9 |
9, 19, 29, 39, 49, 59, 69, 79 |
34 |
4, 12, 30, 38, 46, 53, 61, 79 |
10 |
10, 20, 30, 40, 50, 60, 70, 80 |
35 |
5, 13, 21, 39, 47, 54, 62, 80 |
|
|
|
|
11 |
1, 12, 23, 34, 45, 56, 67, 78 |
36 |
6, 14, 22, 40, 48, 55, 63, 71 |
12 |
2, 13, 24, 35, 46, 57, 68, 79 |
37 |
7, 15, 23, 31, 49, 56, 64, 72 |
13 |
3, 14, 25, 36, 47, 58, 69, 80 |
38 |
8, 16, 24, 32, 50, 57, 65, 73 |
14 |
4, 15, 26, 37, 48, 59, 70, 71 |
39 |
9, 17, 25, 33, 41, 58, 66, 74 |
15 |
5, 16, 27, 38, 49, 60, 61, 72 |
40 |
10, 18, 26, 34, 42, 59, 67, 75 |
|
|
|
|
16 |
6, 17, 28, 39, 50, 51, 62, 73 |
41 |
1, 18, 25, 32, 49, 56, 63, 80 |
17 |
7, 18, 29, 40, 41, 52, 63, 74 |
42 |
2, 19, 26, 33, 50, 57, 64, 71 |
18 |
8, 19, 30, 31, 42, 53, 64, 75 |
43 |
3, 20, 27, 34, 41, 58, 65, 72 |
19 |
9, 20, 21, 32, 43, 54, 65, 76 |
44 |
4, 11, 28, 35, 42, 59, 66, 73 |
20 |
10, 11, 22, 33, 44, 55, 66, 77 |
45 |
5, 12, 29, 36, 43, 60, 67, 74 |
|
|
|
|
21 |
1, 20, 29, 38, 47, 56, 65, 74 |
46 |
6, 13, 30, 37, 44, 51, 68, 75 |
22 |
2, 11, 30, 39, 48, 57, 66, 75 |
47 |
7, 14, 21, 38, 45, 52, 69, 76 |
23 |
3, 12, 21, 40, 49, 58, 67, 76 |
48 |
8, 15, 22, 39, 46, 53, 70, 77 |
24 |
4, 13, 22, 31, 50, 59, 68, 77 |
49 |
9, 16, 23, 40, 47, 54, 61, 78 |
25 |
5, 14, 23, 32, 41, 60, 69, 78 |
50, 00 |
10, 17, 24, 31, 48, 55, 62, 79 |
|
|
|
|
2.2.Контрольные задачи
2.2.1.Строение атома. Периодическая система элементов Д. И. Менделеева
1.Напишите электронно-графические формулы и энергетические диаграммы атомов Fe и Ru в нормальном и возбужденном состояниях и покажите наличие свободных орбиталей у железа и рутения, объясните их высшие степени окисления.
25

2.Напишите электронно-графические формулы атомов Ne, Ar, Kr в нормальном и возбужденном состояниях. Определите наличие свободных орбиталей у этих атомов.
3.Напишите электронно-графические формулы атомов марганца и мышьяка в нормальном и возбужденном состояниях. Какое правило используют для определения числа неспаренных электронов у каждого из этих элементов?
4.Составьте электронно-графические диаграммы ионов Fe3+ и Fe2+. Чем можно объяснить особую устойчивость электронной конфигурации иона Fe3+?
5.Составьте электронно-графические формулы атомов скандия и галлия. Приведите, если возможно, электронно-графическую формулу возбужденного состояния атомов. Являются ли они элементами-аналогами?
6.Сколько валентных электронов имеют атомы свинца, галлия, сурьмы, кальция, иода? Поясните ответ, используя электронно-графические формулы этих элементов в основном и возбужденном состояниях.
7.Напишите электронно-графические формулы элементов с порядковыми номерами 105Э, 106Э, 107Э. Поясните возможные валентные состояния и напишите электронно-графические формулы ионов этих элементов.
8.Объясните, в чем сущность явления «провал электрона». Укажите особенности электронных формул атомов хрома, молибдена, палладия, платины, гадолиния, нептуния.
9.Напишите электронно-графические формулы элементов с порядковыми номерами 108Э, 109Э, 110Э. Поясните возможные валентные состояния, химические свойства этих элементов. К какому семейству относятся данные элементы (s-, p-, d- или f-)?
10.Электронные конфигурации каких ионов более сходны: у Ва2+ и Cs+ или Ba2+ и Hg2+? Ответ поясните, используя электронно-графические формулы атомов этих элементов.
2.2.2.Основы термохимии и термодинамики
11.Рассчитайте стандартный тепловой эффект реакции
1/2 Na2O (к) + 1/2 H2O (ж) |
|
NaOH (к) |
|
по известным значениям стандартных энтальпий образования веществ. Запишите термохимическое уравнение данной реакции.
26

12. Стандартный тепловой эффект реакции 2А + В = 2С равен 150 кДж/моль. Рассчитайте стандартную теплоту (энтальпию) образования вещества А, если ∆H°298 (В) = –45 кДж/моль и ∆H°298 (С) = –60 кДж/моль.
13. Установите, может ли при 298 К самопроизвольно протекать реакция С2Н4 (г) → С2Н2 (г) + Н2 (г). Ответ подтвердите расчетом.
14. Реакция горения этана выражается термохимическим уравнением:
C H |
+ 3 |
1 |
O |
2 (г) |
|
2 CO |
2 (г) |
+ 3 H O |
(ж) |
, ∆Hο |
=_ 1559,87 кДж |
|
|||||||||||
2 6 (г) |
|
2 |
|
|
|
2 |
298. |
|
Вычислите теплоту образования этана, если известны значения теплоты образования СО2(г) и Н2О(ж).
15.Напишите термохимическое уравнение реакции между СО(г) и водородом, в результате которой образуются СН4 (г) и Н2О(г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана?
16.Реакция горения ацетилена описывается уравнением:
C2H2 (г) + 5/2 O2 (г) 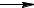 2 CO2 (г) + H2O (ж).
2 CO2 (г) + H2O (ж).
Вычислите ∆G°298 и ∆S°298 . Объясните уменьшение энтропии в результате этой реакции.
17.При какой температуре установится равновесие в системе: CH4 (г) + 2 CO2 (г)  2 CO (г) + 2 H2 (г), ∆H298ο = +247,37 кДж?
2 CO (г) + 2 H2 (г), ∆H298ο = +247,37 кДж?
18.Вычислите ∆Н°298, ∆S°298 и ∆G°298 для реакции, которая описывается уравнением:
Fe2O3 (к) + 3 C  2 Fe + 3 CO.
2 Fe + 3 CO.
Возможна ли реакция восстановления Fe2O3 углеродом при температуре
500 и 1000 °С?
19. Исходя из теплоты образования газообразного диоксида углерода (∆H°298 = −393,5 кДж/моль) и термохимического уравнения
C (графит) + 2 N2O (г) 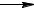 CO2 (г) + 2 N2 (г), ∆H298ο = 557,7 кДж,
CO2 (г) + 2 N2 (г), ∆H298ο = 557,7 кДж,
вычислите теплоту образования N2O(г).
20. На основании стандартной теплоты образования и абсолютных стандартных энтропий соответствующих веществ вычислите ∆G°298 реакции,
27

которая описывается уравнением:
4 NH3 (г) + 5 O2 (г) |
|
4 NO (г) + 6 H2O (г). |
|
Возможна ли эта реакция при стандартных условиях?
2.2.3.Химическая кинетика и химическое равновесие
21.Рассчитайте, как изменится скорость прямой и обратной реакций в
гомогенной системе 2 SO2 (г) + O2 (г) 2 SO3 (г), если объем, занимаемый газами, уменьшить в два раза? Сместится ли при этом равновесие системы?
22. Процесс окисления аммиака можно описать уравнением:
4 NH3 (г) + 5 O2 (г) 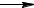 4 NO (г) + 6 H2O (г).
4 NO (г) + 6 H2O (г).
Определите, как изменяется скорость реакции: а) при увеличении давления в системе в два раза; б) при уменьшении концентрации аммиака в три раза.
23.Рассчитайте, как и во сколько раз изменится скорость химической реакции 2Cu2O + O2 = 4CuО: а) при повышении температуры на 30° (γ = 3); б) при уменьшении парциального давления кислорода в газовой фазе в два раза.
24.В химической реакции Na2S2O3 + 2 HCl = 2 NaCl + S↓ + SO2↑ + Н2О
исходная концентрация реагирующих веществ [Na2S2O3]исх = 1 моль/л и [HCl]исх = 2 моль/л. Как изменится скорость реакции, если увеличить концентрацию тиосульфата натрия до 3 моль/л, а концентрацию соляной кислоты – до 6 моль/л?
25.Во сколько раз увеличится скорость прямой реакции H2 + Cl2 = 2HCl при повышении температуры от 25 до 200 °С, если известно, что при повышении температуры на каждые 25 °С скорость этой реакции увеличивается
вчетыре раза?
26.Вычислите константу равновесия для обратимой реакции, которая описывается уравнением: 2 NO2 (г) 
 2 NО (г) + O2 (г), если известно, что в
2 NО (г) + O2 (г), если известно, что в
состоянии равновесия [NO2]р = 0,06 |
моль/л, [NO]р = 0,24 моль/л и [O2]р = |
= 0,22 моль/л. В каком направлении |
сместится равновесие при повышении |
давления? |
|
27. Начальная концентрация веществ NO, Н2 и Н2О в гомогенной системе
2 NO (г) + 2 H2 (г)
 N2 (г) + 2 H2O (г)
N2 (г) + 2 H2O (г)
соответственно равна 0,10; 0,05 и 0,10 моль/л. Вычислите равновесную кон28
центрацию веществ Н2, N2 и Н2О, если равновесная концентрация [NO]р равна 0,07 моль/л. Чему равна константа равновесия?
28. При некоторой температуре константа равновесия Кp гомогенной системы N2 + 3Н2 2NH3 равна 0,1. Равновесная концентрация водорода и аммиака соответственно равна 0,2 и 0,08 моль/л. Вычислите равновесную и начальную концентрацию азота.
29. Реакция разложения пентахлорида фосфора протекает по уравнению:
PCl |
|
PCl |
+ Cl |
, ∆ H0 |
= +92,6 кДж. |
|
|||||
5 (г) |
|
3 (г) |
2 (г) |
298 |
|
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции разложения PCl5?
30. Обратимая гомогенная химическая реакция выражается уравнением:
A (г) + В(г) 
 С(г).
С(г).
Вычислите константу равновесия и исходную концентрацию веществ А и В, если при установлении равновесия концентрация [А]р = 0,06 моль/л, [В]р =
=0,12 моль/л, [С]р = 0,0216 моль/л..
3.2.4.Ионно-молекулярные уравнения и гидролиз солей
31. Смешивают попарно растворы: а) Сu(NОЗ)2 и Na2SО4; б) ВаCl2 и
K2SO4; в) КNО3 и NaCl; г) АgNО3 и KCl; д) Са(ОН)2 и HCl. В каких из приведенных случаев реакция пройдет до конца? Составьте для этих реакций молекулярные и молекулярно-ионные уравнения.
32. Смешивают попарно растворы: а) NaOH и KCl; б) К2SО3 и НСl;
в) CuCl2 и Ca(OH)2; г) HCOONa и H2SO4; д) H2SO4 и НCl. В каких из приведенных случаев реакция пойдет до конца? Составьте для этих реакций молекулярные и молекулярно-ионные уравнения.
33.Выразите молекулярными и молекулярно-ионными уравнениями реакции взаимодействия между а) хлоридом бария и сульфатом алюминия; б) хлоридом аммония и гидроксидом калия при нагревании; в) гидроксидом стронция и соляной кислотой; г) фосфорной кислотой и нитратом кальция; д) ацетатом калия и серной кислотой.
34.Составьте молекулярные, полные и сокращенные молекулярноионные уравнения реакций взаимодействия между а) нитратом бария и сульфатом натрия; б) карбонатом натрия и серной кислотой; в) цианидом калия
29
и азотной кислотой; г) сульфатом меди и гидроксидом натрия; д) сульфитом натрия и серной кислотой.
35. Составьте по три молекулярных уравнения к каждому молекулярноионному уравнению:
а) Fе3+ + 3 OН– → Fе(ОН)3;
б) NН4 + + ОН– → NН3↑ + Н2О; в) СНзСОО– + Н+ → СН3СООН.
36. Какие из солей подвергаются гидролизу: а) KNO2, б) Na2CO3, в) NH4Cl, г) ZnSO4, д) NaCl? Напишите возможные молекулярные и ионномолекулярные уравнения гидролиза. Укажите, какое значение рН (>7 или <7) имеют растворы этих солей.
37. Какие из солей подвергаются гидролизу: а) NaCN; б) K2CO3; в) Zn(NO3)2; г) CuSO4; д) KNO3? Напишите возможные молекулярные и ионномолекулярные уравнения гидролиза. Укажите, какое значение рН (>7 или <7) имеют растворы этих солей.
38. Какие из солей подвергаются гидролизу: а) Na3PO4, б) ZnSO4, в) Al2(SO4)3, г) KNO2, д) K2SO4? Напишите возможные молекулярные и ионномолекулярные уравнения гидролиза. Укажите, какое значение рН (>7 или <7) имеют растворы этих солей.
39.При смешении растворов Al2(SO4)3 и К2S в осадок выпадает А1(ОН)3, Укажите причину этого и составьте соответствующие молекулярные и молекулярно-ионные уравнения.
40.При смешении растворов Al2(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо и до конца с образованием основания и кислоты. Составьте молекулярное и ионно-молекулярное уравнения совместного гидролиза.
3.2.5. Окислительно-восстановительные реакции
41 – 50. Расставьте коэффициенты в окислительно-восстановительных реакциях, используя метод электронного баланса или метод полуреакций. Укажите окислитель и восстановитель, процессы окисления и восстановления. Определите тип окислительно-восстановительных реакции.
41.МnO2 + H2SO4 → MnSO4 + Na2SO4 + Br2 + Н2О; НС1 + MnO2 → MnCl2 + CI2 + H2O.
30
