
1.При прохождении светового потока через коллоидный раствор наблюдается образование светящегося конуса, которое возникает в результате дифракционного рассеяния света
2. К дисперсным системам, которые называют эмульсиями, относятся молоко майонез
3. Формула вещества, которое является ядром мицеллы, образующейся при взаимодействии раствора хлорида меди (II) с избытком сероводорода, имеет вид CuS
4. Единицей измерения величины поверхностного натяжения является Дж/м2
5. Формулы кислот, для которых не характерно образование кислых солей, имеют вид CH3COOH HNO3
6. Формула вещества, в котором реализуется ионный тип связи, имеет вид Na2SO4
7. Общая сумма коэффициентов в уравнении окислительно-восстановительной реакции KMnO4+ KI+H2SO4=MnSO4+I2+K2SO4+H2O равна 41
8. В ряду водных растворов HF-HCl-HBr-HI сила кислот увеличивается
9. Масса медного купороса, необходимого для приготовления 500 мл раствора сульфата меди (II) с массовой долей растворенного вещества 3,2% сост 25
10. Формула соли, процесс гидролиза которой в водном растворе протекает практически до конца, имеет вид Al2(CO3)3
11. Влияние изменений, которые происходят в равновесной химической системе под влиянием внешних воздействий, определяется принципом Ле Шателье
12. Согласно второму началу термодинамики в изолированных системах самопроизвольно протекают процессы, для которых справедливо выражение dS>0
13. Металлом, который нельзя получить электролизом водного раствора его соединения, является Ba
14. Уравнение закона Рауля выражает зависимость между давлением насыщенного пара растворителя над раствором и мольной долей
15. Если температурный коэффициент скорости равен 2, то при увеличении температуры от 120С до 170С скорость химической реакции увеличится в 32
16. При нарушении оловянного покрытия на железном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид Fe(0)-2e=Fe(2+)
17. Качественным реагентом на ацетиленовые углеводороды, содержащие концевую тройную связь, является аммиачный раствор оксида серебра
18. Одним из основных промышленных методов получения метанола является взаимодействие, схема которого имеет вид CO+H2
19. Соединения, соответствующие гомологической формуле CnH2nO, относятся к классам насыщенных альдегидов и насыщенных кетонов
20. При гидролизе н-пропилацетата в водном растворе гидроксида калия в качестве продуктов реакции образуются ацетат калия и пропанол-1
21. Природный и синтетический каучук представляют собой полимеры, макромолекулы которых характеризуются линейной структурой
22. Число мономерных звеньев, которые образуют макромолекулу полимера, называется степенью полимеризации
23. К природным высокомолекулярным соединениям не относятся полиуретаны
24. Получение полистирола в промышленности основано на полимеризации винилбензола
------------------------------------------------------------------------------
1. Образование макромолекул белков происходит в результате реакции поликонденсации альфа-аминокислот
2. Получение полистирола в промышленности основано на полимеризации винилбензола
3. Мономером для синтеза полистирола является вещество, формула которого имеет вид C6H5CH=CH2
4. Для замедления процесса старения полимерных материалов в их состав вводятся вещества, которые называются антиоксидантами
5. Наибольшее число пи-связей содержится в молекуле N2
6. Число нейтронов совпадает с числом протонов в ядрах атомов изотопов 14,7N и 40,20Ca
7. Число моль электронов, которое отдает 1 моль восстановителя в окислительно-восстановительной реакции H2O2+KMnO4+H2SO4=MnSO4.... равно 2
8. При пропускании аммиака в раствор ортофосфорной кислоты образуются соли, формулы которых имеют вид NH4H2PO4 и (NH4)2HPO4
9. Формула соли, в водном растворе которой индикатор лакмус приобретает красную окраску, имеет вид CuSO4
10. Объем хлороводорода ( н.у.), который содержится в 50 литрах 0,1 М раствора соляной кислоты, составляет 112 литров
11. Жемчуг относится к дисперсным системам с твердой дисперсионной средой и жидкой дисперсной фазой.
12. В коллоидной частице, образующейся при взаимодействии избытка разбавленного раствора хлорида марганца (II) с раствором сульфида аммония, потенциалопределяющим является ион Mn(2+)
13. Физическая адсорбция газов на твердых адсорбентах возрастает с увеличением парциального давления газа и уменьшением температуры
14. Для золя гидроксида железа (III), полученного гидролизом его хлорида FeCl3+3H2O наилучшим коагулирующим действием будет обладать ион PO4(3-)
15. Осмотическое давление крови при температуре 37о С составляет 780 кПа. Концентрация глюкозы в растворе, изотоничном раствору крови при той же температуре, равна 0,3
16. Уравнение реакции, в которой при понижении давления равновесие смещается в сторону продуктов, имеет вид C(граф)+2H2O(г)=2H2(г)+CO2(г)
17. Энтальпия образования CaCO3 соответствует тепловому эффекту реакции Ca+C+3/2O2=CaCO3
18. Если температурный коэффициент скорости равен гамма, то при понижении температуры от 130°С до 90°С скорость химической реакции уменьшится в гамма в 4 степени
19. Наибольшим значением ЭДС при стандартных условиях будет обладать гальванический элемент, в котором катодом является медный электрод, а анодом магниевый электрод
20. При электролизе водного раствора сульфата натрия на инертном аноде протекает процесс, уравнение которого имеет вид 2H2O-4e=O2+4H(+)
21. Образование кетонов происходит в результате гидратации алкинов
22. Исходным веществом для одностадийного способа получения уксусной кислоты в промышленности является бутан
23. При взаимодействии пропина с избытком раствора брома в четыреххлористом углероде образуется 1,1,2,2-тетрабромпропан
24. Структурными изомерами бутена-2 являются метилпропен циклобутан
-----------------------------------------------------------------------------
1. Раствор гидроксида бария массой 200 г и массовой долей растворенного вещества 17,1% разбавили водой до объема 400 мл. Молярная концентрация эквивалентов Ba(OH)2 в полученном растворе составляет 1моль/л
2. Формула молекулы вещества, в которой реализуется только ковалентный неполярный тип связи, имеет вид P4
3. Наибольшее число ионов образуется при диссоциации в воде 1 моль соли, формула которой имеет вид Al(NO3)3
4. Коэффициент перед формулой восстановителя в уравнении окислительно-восстановительной реакции KMnO4+FeSO4+H2SO4=MnSO4+Fe2(SO4)3+K2SO4+H2O равен 10
восстановителем является сульфат железа (II), коэффициент перед восстановителем равен 10
5. В схеме превращений HCl-NH4Cl-NH3 веществами Х и Y являются NH3 и NaOH
6. Электронная конфигурация валентного энергетического уровня ...4d105s1 соответствует основному состоянию атома элемента 108,47Ag
7. Диффузионный слой золя, образующегося при взаимодействии разбавленного раствора сульфата меди (II) с избытком раствора гидроксида натрия, образован ионами Na(+)
8. К высокодисперсным системам, в которых дисперсионная среда и дисперсная фаза находятся в твердом агрегатом состоянии, относятся металлические сплавы и окрашенные драгоценные камни
9. Формула вещества, которое обладает выраженными поверхностно-активными свойствами, имеет вид стеарат калия C17H35COOK
10. При прохождении светового потока через коллоидный раствор наблюдается образование светящегося конуса, которое возникает в результате дифракционного рассеяния света
11. Внутримолекулярная дегидратация предельных алифатических спиртов протекает согласно правилу Марковникова
12. К частицам, которые проявляют электрофильные свойства, относятся NO2(+) и FeCl3
13. При нагревании этанола в присутствии серной кислоты при температуре менее 150С в качестве основного органического продукта образуется диэтиловый эфир
14. Бромирование насыщенных карбоновых кислот бромом в присутствии красного фосфора происходит преимущественно в альфа-положение относительно карбоксильной группы.
15. При электролизе раствора, содержащего равные количества ионов Ni(2+) ,Cu(2+) , Zn(2+) , последовательность выделения металлов на инертном катоде имеет вид Cu,Ni,Zn
16. Метод определения молекулярной массы вещества-неэлектролита, основанный на измерении понижения температуры замерзания его раствора, называется криоскопией
17. При уменьшении объема реакционной смеси в 4 раза скорость элементарной гомогенной реакции CO2+Cl2=COCl2 увеличится в 16 раз
18. При нарушении оловянного покрытия на железном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид Fe(0)-2e=Fe(2+)
19. Если для реакции N2(г)+3H2(г)=2NH3(г) dH=-92,4 кДж и dS=-198,3Дж/К то температура, при которой возможно ее протекание в прямом и обратном направлениях, равна 193 С
20. Уравнение процесса, в котором при увеличении температуры равновесие смещается в сторону продуктов реакции, имеет вид 2CuSO4(т)=2CuO(т)+2SO2(г)+O2(г); dH>0
21. К природным веществам, имеющим полимерное строение, относится хитин
22. В реакцию поликонденсации может вступать вещество, формула которого HOOCCH2-CH2COOH
23. К полимерам, обладающим термопластическими свойствами, относится полипропилен
24. Представителем гетероцепных высокомолекулярных соединений является капрон
---------------------------------------------------------------------------------------
1. Уравнение константы равновесия гетерогенной химической реакции MgCO3(т)=MgO(т)+CO2(г) имеет вид K=[CO2]
2. При работе гальванического элемента, состоящего из железного и никелевого электродов, погруженных в 0,5М растворы их сульфатов, на аноде протекает реакция, уравнение которой имеет вид Fe(0)-2e=Fe(2+)
3. При уменьшении объема реакционной смеси в 4 раза скорость элементарной гомогенной реакции CO+Cl2=COCl2 увеличится в 16 раз
4. Согласно второму началу термодинамики, в изобарно-изотермических системах самопроизвольно протекают процессы, для которых справедливо выражение dG<0
5. Сила тока, которую необходимо поддерживать для получения 16,2 г серебра путем электролиза раствора нитрата серебра за 30 минут, составляет 8А
6. Соотношение между температурами кипения растворов этанола t1 и метанола t2 в воде с одинаковой массовой долей растворенного вещества, равной 0,2 %, определяется выражением t1<t2
7. К частицам, которые проявляют электрофильные свойства, относятся NO2(+) и FeCl3
8. При щелочном гидролизе жиров образуются соли высших карбоновых кислот и глицерин
9. Существование геометрических изомеров возможно для углеводорода, который называется бутеном-2
10. В качестве исходного вещества для получения фенола путем реакции окисления может выступать изопропилбензол
11. Масса медного купороса, необходимая для приготовления 2 л 0,1 М раствора сульфата меди (II), составляет 50г
12. Схема реакции, соответствующая сокращенному молекулярно-ионному уравнению 2H(+)+S(2-)=H2S имеет вид K2S+H2SO4=
13. В узлах кристаллической решетки фторида кальция располагаются ионы кальция и фтора
14. Формулы кислот, для которых не характерно образование кислых солей, имеют вид CH3COOH и HNO3
15. Формула вещества, которое способно проявлять только восстановительные свойства, имеет вид NaI
16. Электронная конфигурация валентного энергетического уровня 3d2 4s2 соответствует основному состоянию атома 48,22Ti
17. Получение полистирола в промышленности основано на полимеризации винилбензола
18. К природным веществам, имеющим полимерное строение, относится гликоген
19. Представителем гетероцепных высокомолекулярных соединений является эпоксидная смола
20. Процесс сшивания макромолекул каучука в результате его взаимодействия с серой при нагревании называется вулканизацией
21. Противоионы, не входящие в состав коллоидной частицы (гранулы), образуют слой, который называется диффузионным
22. С увеличением величины заряда коагулирующего иона его коагулирующая способность увеличивается
23. К дисперсным системам, которые называют аэрозолями, относятся пылевое облако и дымовая завеса
24. Величина поверхностного натяжения характеризует работу , необходимую для образования единицы площади поверхности на границе раздела фаз
-------------------------------------------------------------------------------
1. Изменение линейной структуры полимеров на сетчатую или пространственную приводит к уменьшению их эластичности
2. Продукт, образующийся при полном гидролизе макромолекул белков, представляет собой смесь альфа-аминокислот
3. Мономером для получения изопренового (природного) каучука является CH2=C(CH3)-CH=CH2
4. Мономером для синтеза полипропилена является вещество, формула которого CH3CH=CH2
5. Уравнение закона Рауля выражает зависимость между давлением насыщенного пара растворителя над раствором и мольной долей растворенного вещества
6. Значение ЭДС гальванического элемента, состоящего из медного и магниевого электродов, погруженных в 0,1М растворы их нитратов, равно 2,70 В
7. Если температурный коэффициент скорости равен γ, то при увеличении температуры на 30°С скорость химической реакции увеличится в гамма в 3 раз
8. В результате полного электролиза водного раствора нитрата серебра с инертными электродами образуется раствор, значение рН которого <7
9. Система, для которой термодинамические параметры во всех точках сохраняют свое постоянное значение, находится в равновесном состоянии.
10. Если в колонне синтеза этанола установилось равновесие C2H4(г)+H2O(г)=C2H5OH(г); dH<0 то для увеличения выхода продукта необходимо повысить давление
11. Формулы гидроксидов, проявляющих только основные свойства, имеют вид Mg(OH)2 и Ba(OH)2
12. Массовая доля гидрокарбоната натрия в растворе, полученном при смешении 50 г раствора с массовой долей NaНСO3 8% и 150 г раствора с массовой долей соли 4%, составляет 5 % (с точностью до целого значения).
13. Формула соли, в водном растворе которой индикатор лакмус приобретает красную окраску, имеет вид CuSO4
14. К окислительно-восстановительным не относится реакция, схема которой имеет вид (CuOH)2CO3--->CuO+CO2+H2O
15. Формула вещества, в молекуле которого атомы расположены в одной плоскости, имеет вид HNO3
16. На энергетической диаграмме распределения электронов в основном состоянии атома 3s-1 3p-3 3d-5 4s-1 нарушений нет
17. Для золя хлорида серебра, полученного реакцией AgNO3+NaCl(изб)=AgCl+NaNO3 наилучшим коагулирующим действием будет обладать раствор AlCl3
18. При повышении температуры способность веществ к физической адсорбции уменьшается
19. При взаимодействии равных объемов 0,002 М раствора AgNO3 и 0,001 М раствора NaCl потециалопределяющими будут являться ионы Ag(+)
20. К методам получения коллоидных систем, основанным на образовании более крупных частиц из более мелких, относятся химическая конденсация и замена растворителя
21. Качественным реагентом на этиленовые углеводороды является бромная вода
22. Отличить бутаналь от бутанона можно при использовании реакции с гидроксидом меди (II)
23. Ориентантами второго рода в реакциях электрофильного замещения в ароматическом ядре являются группы -NO2 -COOH
24. При сплавлении бензоата натрия с гидроксидом натрия в качестве основного продукта образуется бензол
-------------------------------------------------------------------------------------
1. Для соотношения значений осмотического давления растворов метанола (пи1) и этанола (пи2) в воде при 20оС с одинаковой массовой долей растворенного вещества, равной 0,05 %, справедливо выражение пи1>пи2
2. Сила тока, которую необходимо поддерживать для получения 16,2 г серебра путем электролиза раствора нитрата серебра за 30 минут, составляет 8А (выход по току 100%, F=96500).
3. При нарушении оловянного покрытия на железном изделии в кислой среде на аноде будет протекать реакция, уравнение которой имеет вид F(0)-2e=F(2+)
4. Для увеличения выхода продуктов реакции в равновесной системе C(графит)+ 2H2O(г)=2H2(г)+CO2(г); dH>0 необходимо повысить температуру
5. Если температурный коэффициент скорости равен 2, то при увеличении температуры от 120°С до 170°С скорость химической реакции увеличится в 32
6. Если для реакции N2(г)+3H2(г)=2NH3(г); dH=-92,4 dS=-198,3 то температура, при которой возможно ее протекание в прямом и обратном направлениях, равна 193C
7. В ряду насыщенных одноосновных карбоновых кислот с увеличением длины углеводородного радикала сила кислот уменьшается
8. Углеводородами, которым соответствует гомологическая формула CnH2n-2 являются алкины циклоалкены
9. В отличие от бутина-2 бутин-1 вступает в реакцию с аммиачным раствором оксида серебра
10. Одним из основных промышленных методов получения метанола является взаимодействие, схема которого имеет вид CO+H2=
11. Коллоидная частица, образующаяся при взаимодействии избытка разбавленного раствора нитрата кадмия с раствором сероводорода, в постоянном электрическом поле будет двигаться к катоду
12. Согласно правилу Шульце – Гарди, наилучшим коагулирующим действием по отношению к золю, коллоидная частица которого заряжена отрицательно, обладает ион с наибольшим значением положительного заряда
13. Основными отличиями между физической и химической адсорбцией являются значительная обратимость и низкий тепловой эффект
14. Жемчуг относится к дисперсным системам с твердой дисперсионной средой и жидкой дисперсной фазой.
15. Число моль электронов, которое отдает 1 моль восстановителя в окислительно-восстановительной реакции H2O2+KMnO4+H2SO4=MnSO4+K2SO4+O2+H2O равно 2
16. Соль, водный раствор которой имеет рН >7, имеет формулу CH3COONa
17. Максимальная степень окисления элемента, основному состоянию атома которого соответствует электронная конфигурация валентного энергетического уровня ...3d5 4s2 , равна 7
18. Веществами, между которыми возможно протекание химической реакции в водном растворе, являются ZnO и NaOH CuSO4 и KOH
19. Объем аммиака (н.у.), который необходим для приготовления 25 литров 0,05 М раствора, составляет 28 литров
20. В узлах кристаллической решетки фторида кальция располагаются ионы кальция и фтора
21. Процесс разрушения связей, обеспечивающих сохранение четвертичной и третичной структур белка, называется денатурацией
22. Добавление наполнителей в состав полимерных материалов проводится, как правило, с целью увеличения их механической прочности
23. Представителем синтетических неорганических полимеров является корунд
24. Формула вещества, которое используется в качестве одного из исходных для синтеза полимеров методом поликонденсации, имеет вид C6H5-OH
----------------------------------------------------------------------------------------
1. Исходным веществом для одностадийного способа получения уксусной кислоты в промышленности является бутан
2. Углеводородами, которым соответствует гомологическая формула CnH2n являются алкены циклоалканы
3. Формула изомера этилового спирта имеет вид CH3-O-CH3
4. Образование бутадиена-1,3 происходит в результате реакции, схема которой имеет вид BrCH2CH2CH2CH2+2KOH--->спирт
5. Движение частиц дисперсионной среды к одному из электродов при пропускании через коллоидный раствор постоянного электрического тока называется электроосмосом
6. Способность дисперсной системы противодействовать оседанию частиц под действием силы тяжести называется кинетической или устойчивостью
7. При химической адсорбции в отличие от физической происходит изменение природы частиц адсорбирующегося вещества
8. В коллоидной частице, образующейся при взаимодействии избытка разбавленного раствора хлорида марганца (II) с раствором сульфида аммония, потенциалопределяющим является ион Mn(2+)
9. Число неспаренных электронов в основном состоянии атома элемента, образующего летучее водородное соединение состава ЭН, равно 1
10. Объем аммиака (н.у.), который необходим для приготовления 25 литров 0,05 М раствора, составляет 28 литров
11. Формула вещества, в котором валентные орбитали центрального атома находятся в sp-гибридном состоянии, имеет вид BeF2
12. Продуктом восстановления перманганата калия сероводородом в нейтральной среде является вещество, формула которого MnO2
13. В схеме превращений NaOH-NaHCO3-CO2 веществами Х и Y являются CO2 HCl
14. Соль, водный раствор которой имеет рН >7, имеет формулу CH3COONa
15. Значение ЭДС гальванического элемента, состоящего из медного и магниевого электродов, погруженных в 0,1М растворы их нитратов, равно 2,70
16. Энтальпия образования K2SiO3 соответствует тепловому эффекту реакции 2K+Si+3/2O2=K2SiO3
17. Если температурный коэффициент скорости равен 2, то при увеличении температуры от 120°С до 170°С скорость химической реакции увеличится в 32
18. Уравнение константы равновесия гетерогенной химической реакции 2H2S(г)+SO2(г)=3S(кр)+2H2O(г) имеет вид K=[H2O]^2/[H2S]^2 *[SO2]
19. В результате полного электролиза водного раствора хлорида калия с инертными электродами образуется раствор, значение рН которого > 7
20. Температура замерзания раствора, содержащего 12,0 г формальдегида HCHO в 400 г воды, составляет -1,86 C (K(H2O)=1,86)
21. Начальной стадией процесса полимеризации, сопровождающейся образованием активных центров, является инициирование
22. Полимеры, обладающие кристаллической структурой, характеризуются, как правило, более узким интервалом температуры плавления по сравнению с аморфными.
23. При получении полимеров путем реакции поликонденсации в отличие от полимеризации масса образовавшегося полимера меньше массы(е) исходных мономеров.
24. Процесс разрушения связей, обеспечивающих сохранение четвертичной и третичной структур белка, называется денатурацией
-----------------------------------------------------------------------------------------
1. Муравьиная кислота в отличие от уксусной вступает в реакцию «серебряного зеркала»
2. Образование кетонов происходит в результате гидратации алкинов
3. При взаимодействии пропина с избытком раствора брома в четыреххлористом углероде образуется 1,1,2,2-тетрабромпропан
4. Системой сопряженных пи-связей обладают молекулы бутадиена-1,3 винилбензола
5. Исходное вещество, которое используется в производстве ацетатного шелка, является сложным эфиром целлюлозы и уксусной кислоты.
6. Вещества, при взаимодействии которых с активными радикалами происходит образование малоактивных центров, не способных инициировать дальнейший процесс полимеризации, называются ингибиторами
7. Стереорегулярные полимеры по сравнению с нерегулярными обладают большей способностью находиться в кристаллическом состоянии.
8. Полимерный материал тефлон производится на основе продукта полимеризации вещества, формула которого имеет вид C2F4
9. При пропускании сероводорода в раствор, содержащий ионы свинца, значение ЭДС гальванического элемента Mg(0)|Mg(2+)|Pb(2+)|Pb(0) уменьшится
10. Энтальпия образования BaSO4 соответствует тепловому эффекту реакции Ba+S+2O2=BaSO4
11. Осмотическое давление крови при температуре 37о С составляет 780 кПа. Концентрация глюкозы в растворе, изотоничном раствору крови при той же температуре, равна 0,3 моль/л.
12. При увеличении объема реакционной смеси в 3 раза скорость элементарной гомогенной реакции 2NO+O2=2NO2 уменьшится в 27 раз
13. Время, необходимое для получения 9,6 г меди путем электролиза раствора сульфата меди (II) при силе тока 25 А, составляет 19,3 минуты
14. Уравнение константы равновесия гетерогенной химической реакции MgCO3(т)=MgO(т)+CO2(г) имеет вид K=[CO2]
15. Для золя гидроксида железа (III), полученного реакцией FeCl3(изб)+3NaOH=Fe(OH)3+3NaCl наилучшим коагулирующим действием будет обладать ион PO4(3-)
16. Вещество, обладающее способностью концентрироваться на поверхности других веществ, называется адсорбатом
17. Коллоидная частица, образующаяся при взаимодействии избытка раствора йодида калия с раствором нитрата серебра, в постоянном электрическом поле движется к аноду
18. Коллоидные растворы относятся к высокодисперсным системам, которые состоят из дисперсионной среды и дисперсной фазы
19. В схеме превращений HCl-NH4Cl-NH3 веществами Х и Y являются NH3 NaOH
20. Электронная конфигурация основного состояния валентного энергетического уровня 3d5 4s0 соответствует иону Mn(2+)
21. Для приготовления 10 л 0,1 М раствора гидроксида натрия требуется 40 г твердой щелочи (с точностью до целого значения).
22. Молярная масса вещества-окислителя в окислительно-восстановительной реакции, схема которой имеет вид KBr+KBrO3+H2SO4=Br2+K2SO4+H2O равна 167 г/моль
23. Формулы солей, водные растворы которых можно различить, используя индикатор фенолфталеин, имеют вид Na2S и Na2SO4
24. Формула частицы, обладающей тетраэдрическим строением, имеет вид NH4(+)
-----------------------------------------------------------------------------------------------
1. Исходным веществом для одностадийного способа получения уксусной кислоты в промышленности является бутан
2. Структурными изомерами бутадиена-1,3 являются бутин-2 циклобутен
3. Третичные спирты в отличие от первичных и вторичных не реагируют с оксидом меди(II) при нагревании
4. Образование пропанона происходит в результате реакции, схема которой имеет вид CH3C=CH+H2O-->Hg,H
5. Если в колонне синтеза аммиака при 4500С установилось равновесие N2(г)+3H2(г)=2NH3(г);dH<0 то для увеличения выхода продукта необходимо увеличить давление
6. При увеличении объема реакционной смеси в 2 раза скорость элементарной гомогенной реакции 2CO+O2=2CO2 уменьшится в 8 раз
7. Если для реакции Fe2O3(к)+3H2(г)=2Fe(к)+3H2O(г) dH=96,74 dS=-141 то температура, при которой возможно ее протекание в прямом и обратном направлении, равна 413
8. Одинаковые продукты образуются на инертных электродах при электролизе расплава и водного раствора соединения, формула которого CuCl2
9. Для соотношения значений осмотического давления растворов метанола пи1 и этанола пи2 в воде при 20оС с одинаковой массовой долей растворенного вещества, равной 0,05 %, справедливо выражение пи1>пи2
10. При добавлении щелочи в раствор, содержащий ионы серебра Zn(0)|Zn(2+)|Ag(+)|Ag(0) значение ЭДС гальванического элемента уменьшится
11. Уравнение реакции, которая в водном растворе протекает практически до конца, имеет вид Fe(NO3)3+3KOH=FeOH3+3KNO3
12. Формула вещества, способного проявлять свойства как окислителя, так и восстановителя, имеет вид H2SO3
13. Формула соединения, в котором реализуется донорно-акцепторный механизм образования химической связи, имеет вид Na2[Zn(OH)2]
14. Электронная конфигурация валентного энергетического уровня 3d5 4 s1 соответствует основному состоянию атома элемента 52,24Cr
15. Масса медного купороса, необходимая для приготовления 2 л 0,1 М раствора сульфата меди (II), составляет 50 г (с точностью до целого значения).
16. В схеме превращений HCl-NH4Cl-NH3 веществами Х и Y являются NH3 NaOH
17. В лабораторной практике электрофорез наиболее часто используют для определения знака заряда коллоидной частицы
18. Работа, необходимая для образования единицы площади поверхности на границе раздела фаз, называется поверхностным натяжением
19. К методам получения коллоидных растворов, основанным на образовании более мелких частиц из более крупных, относятся диспергационные и пептизационные
20. При взаимодействии равных объемов 0,002 М раствора AgNO3 и 0,001 М раствора NaCl потециалопределяющими будут являться ионы Ag(+)
21. Представителем гетероцепных высокомолекулярных соединений является эпоксидная смола
22. Метод радикальной полимеризации используется в промышленности для получения поливинилацетата
23. В результате полного гидролиза как крахмала, так и целлюлозы образуется глюкоза
24. Полимеры, макромолекулы которых содержат звенья разных мономеров, называются сополимерами
-------------------------------------------------------------------------------------------------
1. Число нейтронов совпадает с числом протонов в ядрах атомов изотопов 28,14Si (14) и 20,10Ne (10)
2. Объем хлороводорода (н.у.), который необходим для приготовления 20 литров 0,5 М раствора соляной кислоты, составляет 224 литров (с точностью до целого значения).
3. Коэффициент перед формулой окислителя в уравнении окислительно-восстановительной реакции NaClO3+HCl=NaCl+Cl2+H2O равен 1
4. Число общих электронных пар, участвующих в образовании связей в молекуле фосгена – COCl2 равно 4
5. Формула соли, гидролиз которой протекает необратимо, имеет вид Cr2S3
6. При пропускании оксида серы (IV) в раствор щелочи возможно образование кислой и средней солей.
7. Мономером для получения изопренового (природного) каучука является CH2=C(CH3)-CH=CH2
8. Полимеры, которые по значению молекулярной массы занимают промежуточное положение между низкомолекулярными и высокомолекулярными соединениями, называются олигомерами
9. Образование макромолекул белков происходит в результате реакции поликонденсации альфа-аминокислот
10. К полимерам, обладающим термореактивными свойствами, относится эпоксидная смола
11. При щелочном гидролизе жиров образуются соли высших карбоновых кислот и глицерин
12. К частицам, которые проявляют электрофильные свойства, относятся NO2(+) FeCl3
13. При взаимодействии 1,4-дибромбутана с водным раствором щелочи образуется бутандиол-1,4
14. В отличие от бутина-2 бутин-1 вступает в реакцию с аммиачным раствором оксида серебра
15. Влияние изменений, которые происходят в равновесной химической системе под влиянием внешних воздействий, определяется принципом Ле Шателье
16. Если для реакции Fe2O3(к)+3H2(г)=2Fe(к)+3H2O(г) dH=96,74 dS=-141 то температура, при которой возможно ее протекание в прямом и обратном направлении, равна 413
17. Масса никеля, выделившегося на катоде при пропускании тока силой 13,7 А в течение 120 минут через раствор сульфата никеля (II) с выходом по току 80%, составляет 24 г A(Ni)=58,7
18. Для соотношения значений осмотического давления растворов метанола пи1 и этанола пи2 в воде при 20оС с одинаковой массовой долей растворенного вещества, равной 0,05 %, справедливо выражение пи1>пи2
19. Для защиты никелевых изделий от коррозии в качестве катодного покрытия можно использовать Cu
20. При уменьшении объема реакционной смеси в 4 раза скорость элементарной гомогенной реакции CO+Cl2=COCl2 увеличится в 16
21. Ион избыточного реагента, адсорбирующийся на поверхности ядра и определяющий заряд коллоидной частицы (гранулы), называется потенциалопределяющим
22. Вещество, обладающее способностью концентрировать другие вещества на своей поверхности, называется адсорбентом
23. Уравнения реакций, в результате которых происходит образование коллоидных растворов методом химической конденсации, имеют вид AgNO3+NaCl= и CuCl2+H2S=
24. Для золя сульфида свинца, полученного реакцией Pb(NO3)2(изб)+H2S=PbS+2HNO3 наилучшим коагулирующим действием будет обладать раствор K3PO4
2. Число неспаренных электронов в основном состоянии атома никеля равно 2 3. В периодах с увеличением порядкового номера элемента значение электроотрицательности возрастает 4. Электронная конфигурация валентного энергетического уровня 3s23p2 соответствует основному состоянию атома 28,14 Si 5. Число валентных электронов в основном состоянии атома элемента, образующего высший оксид состава ЭО2 равно 4 6. Число неспаренных электронов в основном состоянии атома элемента, образующего летучее водородное соединение состава ЭН, равно 1 7. Максимальная степень окисления элемента, основному состоянию атома которого соответствует электронная конфигурация валентного энергетического уровня …3d54s2, равна7 8. Максимальное число неспаренных электронов, которые могут располагаться на d-орбиталях, составляет 5 9. На энергетической диаграмме распределения электронов в основном состоянии атома
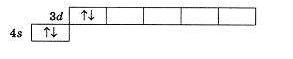
нарушается правило Гунда 10. Число нейтронов совпадает с числом протонов в ядре атома изотопа 12,6 C 11. Число нейтронов совпадает с числом протонов в ядрах атомов изотопов 28,14 Si(14) и 20,10 Ne(10) 12. Электронная конфигурация валентного энергетического уровня 3d54 s1 соответствует основному состоянию атома элемента 52,24 Cr 13. На энергетической диаграмме распределения электронов в основном состоянии атома
![]()
нарушается принцип Паули
II. Химическая связь и строение вещества
1. Наибольшей полярностью в молекуле уксусной кислоты характеризуется связь между атомами водорода и кислорода
2. Формула вещества, в котором валентные орбитали центрального атома находятся в sp-гибридном состоянии, имеет вид BeF2
3. Частицей, для которой характерен донорно-акцепторный механизм образования химической связи, является BF4(-)
4. В узлах кристаллической решетки хлорида калия располагаются ионы калия и хлора
5. Формула молекулы вещества, в которой реализуется только ковалентный полярный тип связи, имеет вид HCl
6. Формула вещества, в молекуле которого содержатся пи-связи, имеет вид N2
7. Формула молекулы с наибольшей полярностью связи Э−Н имеет вид HF
8. Формула вещества, в молекулах которого валентные орбитали центрального атома находятся в sp-гибридном состоянии, имеет вид CO2
9. Наибольшее число пи-связей содержится в молекуле N2
10. Формула вещества, в молекуле которого атомы расположены в одной плоскости, имеет вид HNO3
11. Атомной кристаллической решеткой обладает вещество, формула которого имеет вид SiO2
12. Число общих электронных пар, участвующих в образовании связей в молекуле фосгена – COCl2, равно 4
13. Наибольшей полярностью в молекуле уксусной кислоты характеризуется связь между атомами водорода и кислорода
14. Формула вещества, в молекуле которого содержится одинаковое число сигма- и пи-связей, имеет вид CO2
III. Классы неорганических соединений
1. В схеме превращений CuSO4-->CuCl2-->Cu(OH)2 веществами Х и Y являются BaCl2 и KOH
2. Формулы гидроксидов, проявляющих только основные свойства, имеют вид Mg(OH)2 и Ba(OH)2 3. Формулы гидроксидов, которые которые нельзя получить растворением соответствующих оксидов в воде, имеют вид Mg(OH)2 Zn(OH)2 4. Формула гидроксида, который можно получить растворением в воде его оксида, имеет видKOH 5. Формула оксида, при растворении которого вводе образуется кислота общей формулы H2ЭО4 имеет вид SO3 6. Формула кислоты, для которой характерно образование кислых солей, имеет вид H3PO4 7. Формула вещества, относящегося к классу кислых солей, имеет вид NaHCO3 8. При пропускании оксида серы (IV) в раствор щелочи возможно образование ___ и ____ солей. кислой и средней 9. Формулы оксидов, которые при растворении в воде образуют кислоты общей формулы H2ЭО3, имеют вид SO2 и CO2 10. Формулы гидроксидов, которые реагируют с водными растворами и кислот, и оснований, имеют вид Zn(OH)2 и Al(OH)3 11. В схеме превращений Fe-->FeCl3-->Fe(NO3)3 веществами Х и Y являются Cl2 и AgNO3 12. В схеме превращений Na-->NaOH-->NaHSO3 веществами Х и Y являются H2O и SO2 13. В схеме превращений NaOH-->NaHCO3-->CO2 веществами Х и Y являются CO2 и HCl 14. При пропускании аммиака в раствор ортофосфорной кислоты образуются соли, формулы которых имеют вид ____ и ____. NH4H2PO4 и (NH4)2HPO4 IV. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ 1. Масса серной кислоты, содержащейся в 1 мл раствора с молярной концентрацией эквивалентов H2SO4 равной 2 моль/л, составляет 98 мг (с точностью до целого значения). 2. Массовая доля хлорида кальция в растворе, полученном при растворении 20 г CaCl2 и 180 г воды, составляет 10 % (с точностью до целого значения). 3. Моляльная концентрация сульфата меди (II) в растворе, полученном при растворении 16 г CuSO4 в 100 г воды, составляет 1 моль/кг (с точностью до целого значения). 4. Масса сульфата магния, необходимого для приготовления 500 мл раствора с молярной концентрацией растворенного вещества 0,5 моль/л, составляет 30 г (с точностью до целого значения). 5. Объем хлороводорода (н.у.), который содержится в 847,5 мл 36,5 %-го раствора соляной кислоты (ро=1,18 г/см3 ), составляет 224 литра (с точностью до целого значения). 6. Масса кристаллогидрата (MgSO4*7H2O ), необходимого для приготовления 1000 г раствора сульфата магния с массовой долей растворенного вещества 6%, составляет 123 г (с точностью до целого значения). 7. Массовая доля гидроксида натрия в растворе, полученном при разбавлении 200 мл 2,5М раствора NaOH в 5 раз, составляет 2 % (с точностью до целого значения;ро раствора=1г/см3). 8. Массовая доля сульфата меди (II) в растворе, полученном при растворении 50 г медного купороса (CuSO4*5H2O ) в 350 мл воды, составляет 8 % (с точностью до целого значения). 9. 100 г 40%-ного раствора гидроксида натрия разбавили водой до объема 500 мл. Молярная концентрация эквивалентов NaOH в полученном растворе составляет 2 моль/л(с точностью до целого значения). 10. Масса медного купороса, необходимого для приготовления 500 мл раствора сульфата меди (II) с массовой долей растворенного вещества 3,2%(ро=1г/см3) , составляет 25 г(с точностью до целого значения). 11. Объем хлороводорода ( н.у.), который содержится в 50 литрах 0,1 М раствора соляной кислоты, составляет 112 литров (с точностью до целого значения). 12. Для приготовления 10 л 0,1 М раствора гидроксида натрия требуется 40 г твердой щелочи (с точностью до целого значения). 13. Масса кристаллогидрата (Na2CO3*10H2O ), необходимая для приготовления 500 г раствора карбоната натрия с массовой долей растворенного вещества 10,6%, составляет 143 г (с точностью до целого значения). 14. Массовая доля хлорида кальция в растворе, полученном при смешении 300 г раствора с массовой долей CaCl2 15% и 200 г раствора с массовой долей 2,5%, составляет 10 %(с точностью до целого значения). 15. Объем хлороводорода (н.у.), который необходим для приготовления 20 литров 0,5 М раствора соляной кислоты, составляет 224 литра (с точностью до целого значения). V. РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ 1. Формула соли, в водном растворе которой индикатор лакмус приобретает красную окраску, имеет вид CuSO4 2. Схема реакции, соответствующая сокращенному молекулярно-ионному уравнению
![]()
имеет вид Na2CO3+H2SO4-->
3. Формула соли, процесс гидролиза которой в водном растворе протекает практически до конца, имеет вид Al2(CO3)3
4. Наибольшее число катионов образуется при диссоциации в воде 1 моль соли, формула которой Na3PO4
5. Схема реакции, соответствующая сокращенному молекулярно-ионному
![]()
имеет вид FeCl3+NaOH-->
6. Схема реакции, соответствующая сокращенному молекулярно-ионному
![]()
имеет вид K2S+H2SO4---> 7. Наибольшее число ионов образуется при диссоциации в воде 1 моль соли, формула которой имеет вид Al(NO3)3 8. Сильным электролитом является раствор вещества, формула которого имеет вид Al2(SO4)3 9. Формула соли, в водном растворе которой индикатор метиловый оранжевый приобретает желтую окраску, имеет вид Na3PO4 10. Формула соли, в водном растворе которой индикатор фенолфталеин приобретает малиновую окраску, имеет вид K2HPO4 11. Схема реакции, соответствующая сокращенному молекулярно-ионному уравнению
![]()
имеет вид CuSO4+NaOH--> 12. Уравнение реакции, которая в водном растворе протекает практически до конца, имеет вид
![]()
13. Формула соли, значение рН водного раствора которой равно 7, имеет вид K2SO4
14. Схема реакции, соответствующая сокращенному молекулярно-ионному уравнению
![]()
имеет вид H2SO4+KOH--->
15. Уравнение реакции, которая в водном растворе протекает практически до конца, имеет вид
![]()
16. Формула соли, водный раствор которой характеризуется рН <7, имеет вид CuSO4
17. Наибольшее число ионов образуется при диссоциации 1 моль соли, имеющей формулу Fe2(SO4)3
