- •Введение
- •1.2 Задача 2
- •2. Газовые циклы
- •2.1 Задача 1.Расчет цикла двс
- •2.1.1.4 Определим параметры газа в точке 4
- •2.1.3 Определим полезную работу l, подведенное и отведенное тепло q1, q2 в цикле и его кпд t (двумя способами)
- •2.2 Задача 2. Расчет цикла гту
- •2.2.1.3 Определим параметры газа в точке 3
- •2.2.1.4Определим параметры газа в точке 4
- •2.1.3 Определим полезную работу l, кпд t (двумя способами)
- •3. Циклы паросиловых установок
- •3.1 Задача 1
- •4. Циклы трансформаторного тепла
- •4.1 Задача 1
- •4.1.1 Расчет удельной холодопроизводительности в цикле
- •4.2 Задача 2
- •Библиографический список
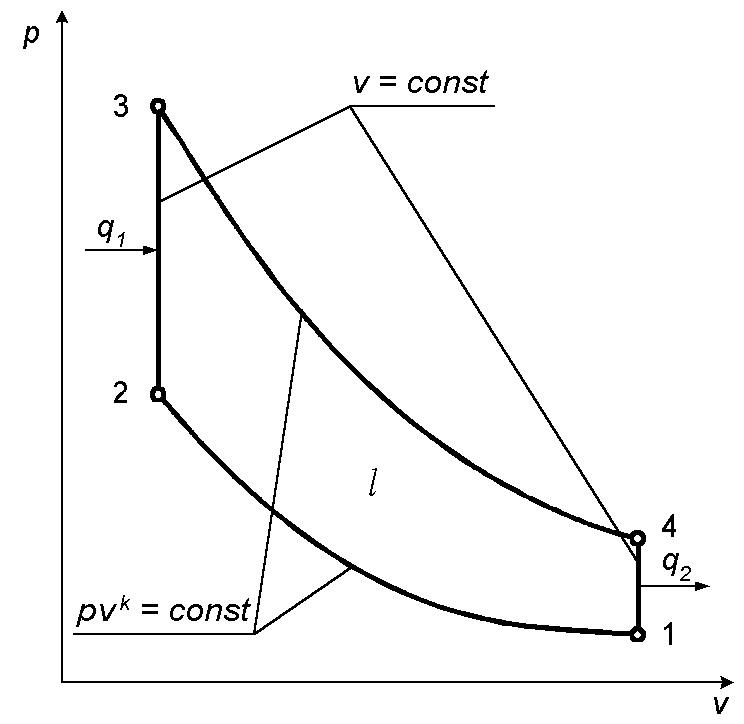
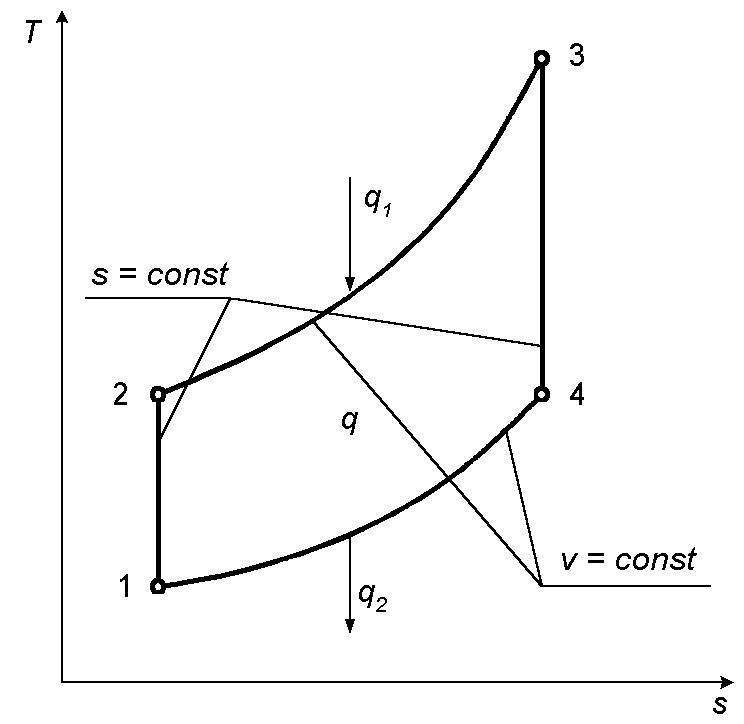
2.1 Задача 1.Расчет цикла двс
Определить:
- параметры газа в переходных точках цикла ДВС (результаты расчёта свести в табл.);
- тепло, работу и изменение параметров ∆u, ∆h, ∆s, в каждом процессе;
- полезную работу, подведённое и отведенное тепло в цикле ДВС, его КПД (двумя способами);
- построить цикл в масштабе в диаграммах p,v и T,s.
Исходные данные к расчету цикла ДВС представлены в таблице 2.1
Таблица 2.1
|
№ вариана |
Способ подво-да тепла |
Раб. тело |
р1, Мпа |
Т1, К |
|
|
ρ |
|
25 |
V=const |
О2 |
0.1 |
300 |
7.0 |
3.0 |
- |
Дано: "СИ"
г
 аз
– кислород
аз
– кислород
подвод тепла – V=const
р1
= 0.1 МПа
![]()
Т1 = 300 К
= 6.0
= 3.0

Найти:
v1, u1, h1, s1, p2, T2, v2, u2, h2, s2,
p3, T3, v3, u3, h3, s3,
p4, T4, v4, u4, h4, s4,
q1-2, l1-2, ∆u1-2, ∆h1-2, ∆s1-2, q2-z,
l2-z, ∆u2-z, ∆h2-z, ∆s2-z, qz-3, lz-3,
, q3-4, l3-4,
∆u3-4, ∆h3-4, ∆s3-4, q4-1, l4-1,
∆u4-1, ∆h4-1, ∆s4-1, l, q1, q2, t.
|
|
|
Рисунок 4 – Изображение цикла ДВС, v=const, на диаграммах
p, v (a) и T,s (б)
Решение:
Для расчетов неизвестных параметров необходимо рассчитать газовую постоянную. Газовая постоянная является индивидуальной для каждого газа, то есть зависит от молекулярной массы газа и рассчитывается по формуле:
![]()
![]()
где см - это кажущаяся молекулярная масса, она зависит от пропорции компонентов, из которых состоит смесь газа.
![]()
Для кислорода газовая постоянная будет равна:
![]()
Так же понадобится для расчетов изобарная (ср) и изохорная (сv) теплоемкости, показатель адиабаты и объем при нормальных условиях. Так как данный газ кислород – двухатомный, следовательно, изобарная теплоемкость равна:
![]()
а изохорная теплоемкость равна:
![]()
Показатель адиабаты равен:
![]()
![]()
Объем при нормальных условиях будет равен:
![]()
2.1.1 Определим параметры газа в переходных точках цикла
2.1.1.1 Определим параметры газа в точке 1
Найдем объем v1 из уравнения Клапейрона:
![]() (2.1)
(2.1)
Для данной точки объем будет равен:
![]() (2.2)
(2.2)
где R – газовая постоянная, кДж/кг*К;
Т1 – температура в точке 1, К;
р1 – давление в точке 1, Па.
![]()
Найдем внутреннюю энергию u1.
Величина внутренней энергии газа зависит, как от скорости движения молекул и атомов, так и от расстояния между ними. Скорость движения микрочастиц вещества зависит от температуры тела, а силы взаимодействия между ними - от удельного объема. Поэтому внутреннюю энергию можно представить в виде:
![]() (2.3)
(2.3)
где сv – изохорная теплоемкость газа, кДж/кгК.
![]()
Найдем энтальпию h1.
Энтальпия газа так же, как и внутренняя энергия, зависит только от температуры. Следовательно, энтальпия h1 рассчитывается по формуле:
![]() (2.4)
(2.4)
где ср – изобарная теплоемкость газа, кДж/кг·К.
![]()
Найдем энтропию s1.
В уравнении первого закона термодинамики dq = du + pdv только du является полным дифференциалом внутренней энергии u. Введением множителя 1/Т можно привести это уравнение к уравнению в полных дифференциалах:
![]() (2.5)
(2.5)
где ds – полный дифференциал параметра s, то есть энтропии.
Для идеальных газов pv = RT, du = cvdT, поэтому
![]() (2.6)
(2.6)
После интегрирования (3.6) получаем расчетную формулу для определения энтропии:
![]() (2.7)
(2.7)
где v1 – объем точки 1, м3/кг;
vн – объем при нормальных условиях, м3/кг.
![]()
2.1.1.2 Определим параметры газа в точке 2
Найдем
объем v2
с помощью степени сжатия .![]()
![]() ,
(2.8)
,
(2.8)
Отсюда выразим v2:
![]() (2.9)
(2.9)
![]()
Найдем температуру Т2 по формуле:
![]() (2.10)
(2.10)
![]()
Найдем из уравнения Клапейрона pv = RT давление p2:
![]() (2.11)
(2.11)
где Т2 – температура в точке 2, К;
v2 – объем в точке 2, м3/кг.
![]()
Найдем внутреннюю энергию u2 аналогично u1:
![]() (2.12)
(2.12)
![]()
Найдем энтальпию h2 аналогично h1:
![]() (2.13)
(2.13)
![]()
Найдем энтропию s2 аналогично s1:
![]() (2.14)
(2.14)
![]()
2.1.1.3Определим параметры газа в точке 3
Найдем температуру Т3 через степень повышения давления из соотношения:
![]() (2.15)
(2.15)
отсюда выразим Т3:
![]() (2.16)
(2.16)
![]()
Найдем давление р3 через степень повышения давления из соотношения:
![]() (2.17)
(2.17)
отсюда выразим р2:
![]() (2.18)
(2.18)
где р2 – давление в точке 2; МПа.
![]() .
.
Найдем из уравнения Клапейрона: pv = RT объем v3:
![]() (2.19)
(2.19)
где Т3 – температура в точке 3; К,
р3 – давление в точке 3; МПа.
![]()
Найдем внутреннюю энергию u3 аналогично u1:
![]() (2.20)
(2.20)
![]()
Найдем энтальпию h3 аналогично h1:
![]() (2.21)
(2.21)
![]()
Найдем энтропию s3 аналогично s1:
![]() (2.22)
(2.22)![]()
![]()