
- •49 01 01 “Технология хранения и переработки растительного сырья”
- •49 01 02 “Технология хранения и переработки животного сырья”
- •91 0101 “Производство продуктов и организация общественного
- •Содержание
- •Общие указания к методике выполнения и защиты лабораторных работ
- •Цветные реакции на белки
- •Биуретовая реакция
- •Нингидриновая реакция
- •Ксантопротеиновая реакция
- •Реакция Адамкевича
- •Реакция Фоля
- •Физико-химические свойства белков
- •Определение изоэлектрической точки белков
- •Высаливание белков сульфатом аммония
- •Необратимое осаждение белков
- •Осаждение белков органическими веществами
- •Денатурация белков при нагревании
- •Осаждение белков концентрированными минеральными кислотами
- •Осаждение белков органическими кислотами
- •Осаждение белков солями тяжелых металлов
- •Разделение и очистка белков методом диализа
- •Методы определения азота в биологических объектах
- •Количественное определение общего азота по методу Кьельдаля
- •Определение различных форм азота в молоке и сыре
- •Метод определения общего количества азота в сыре
- •Метод определения общего количества растворимого азота
- •Метод определения азотосодержащих небелковых соединений
- •Метод определения аминного азота (пептиды, аминокислоты, амиды, аммиак)
- •Определение белка в молоке по Лоури
- •Определение влажности весовым методом
- •Метод высушивания до постоянной массы
- •Определение влажности ускоренным методом высушивания
- •Определение влажности экспрессным методом высушивания
- •Нуклеопротеиды
- •Гидролиз нуклепротеидов дрожжей
- •Список используемых источников
- •Приложение а
- •Значение рК для ионизируемых групп в аминокислотах
- •Приложение б
- •Методики приготовления реактивов
Биуретовая реакция
Принцип метода.В щелочной среде в присутствии солей меди растворы белка приобретают фиолетовый цвет с красным или синим оттенком, зависящим от количества пептидных связей в молекуле. Продукты неполного гидролиза белка, содержащие не менее двух пептидных связей, дают биуретовую реакцию с красным оттенком. Реакция обусловлена наличием пептидных групп, которые в щелочной среде образуют с ионами двухвалентной меди окрашенные комплексы.
В щелочной среде пептидная группа присутствует в своей таутомерной енольной форме:
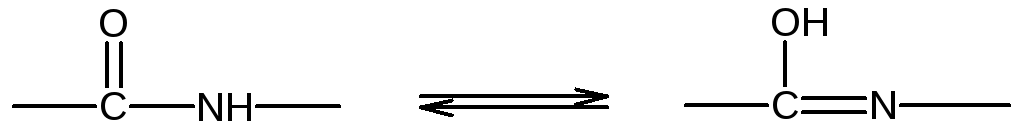
Ион меди взаимодействует с отрицательным зарядом диссоциированной в этих условиях ОН-группой – возникает солеобразная связь; кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их неподеленных электронных пар. Комплексное соединение меди с енолизованными пептидными группами при участии четырех атомов азота можно представить следующим образом:
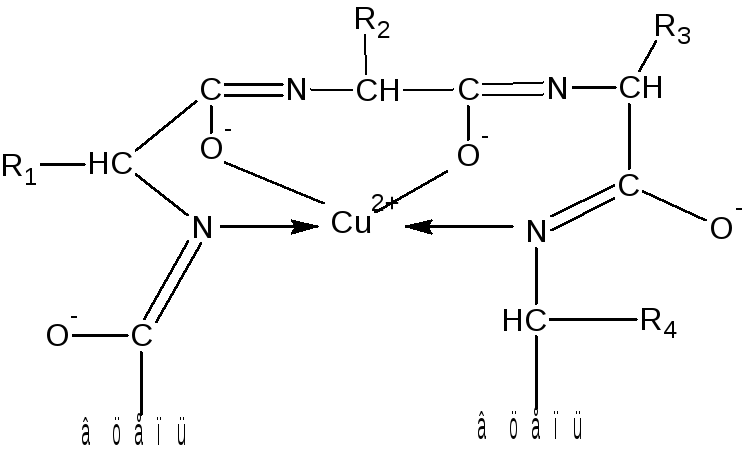
Ход работы. В одну пробирку наливают 5 капель разбавленного раствора яичного альбумина, во вторую – 5 капель 1%-ного раствора желатина, в третью – 5 капель 1%-ного раствора растительного альбумина. В каждую пробирку добавляют по 10 капель 10%-ного раствора NаОН и по одной капле 1%-ного раствора сульфата меди. Содержимое пробирок тщательно перемешивают. Развивается фиолетовое окрашивание с соответствующим оттенком.
Нингидриновая реакция
Принцип метода.Белки, полипептиды, как и свободные-аминокислоты, дают синее или фиолетовое окрашивание с нингидрином (гидрат трикетогидриндена). Реакция характерна для-аминогрупп аминокислот.
На Iстадии реакции
образуется восстановленный нингидрин
за счет окислительного дезаминирования
(образованиеNН3) и
декарбоксилирования (образование СО2)-аминокислот: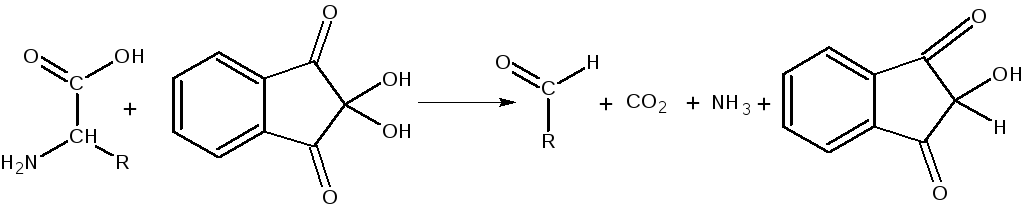
Окисленный Восстановленный
нингидрин нингидрин
На IIстадии образовавшийся аммиак реагирует с эквимолярными количествами окисленного и восстановленного нингидрина, образуя сине-фиолетовый продукт, интенсивность окраски которого (при 570нм) пропорциональна количеству аминокислоты:
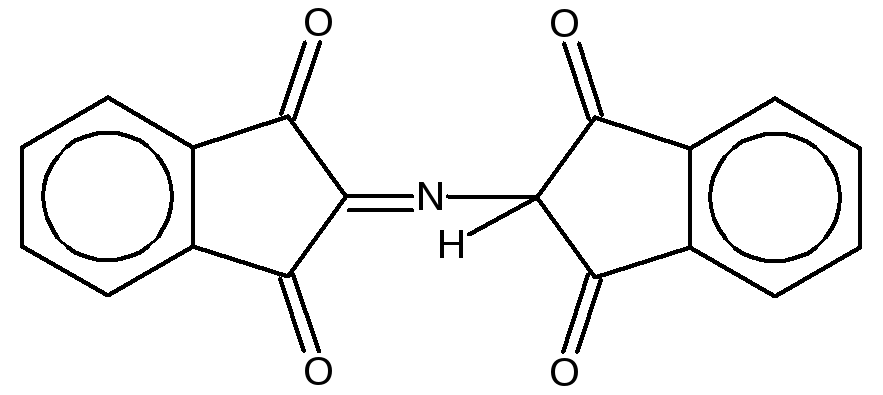
Ход работы. В одну пробирку наливают 5 капель разбавленного раствора яичного альбумина, во вторую – 5 капель 1%-ного раствора желатина, в третью – 5 капель 1%-ного раствора растительного альбумина. В каждую пробирку добавляют по 3 капли 0,5%-ного раствора нингидрина и нагревают до кипения. Через 2–3 минуты в пробирках появляется розовое, красное, а затем сине-фиолетовое окрашивание.
Ксантопротеиновая реакция
Принцип метода. При добавлении к раствору белка концентрированной азотной кислоты белок выпадает в осадок, который при нагревании растворяется и жидкость окрашивается в желтый цвет. Эта реакция характерна для ароматических аминокислот (фенилаланина, тирозина и триптофона), которые подвергаются нитрованию:
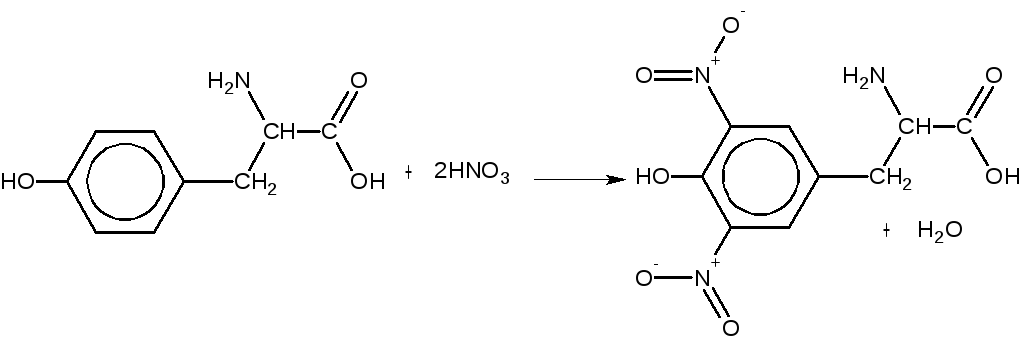
Нитропроизводное аминокислот в щелочной среде образуют соли хиноидной структуры, окрашенные в оранжевый цвет. Например:
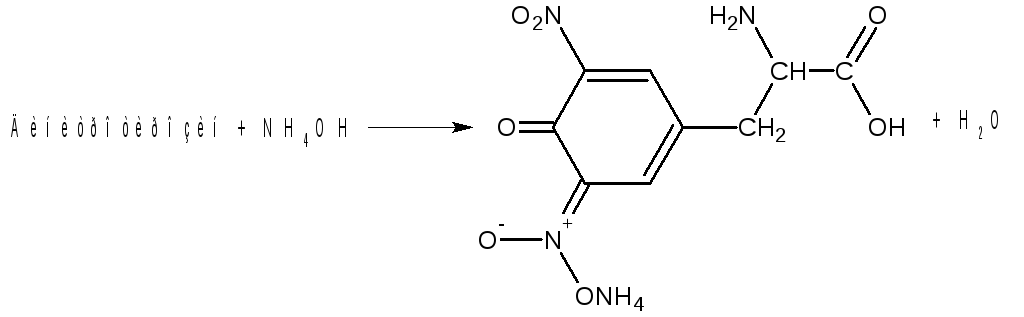
Ход работы. В одну пробирку наливают 5 капель разбавленного раствора яичного альбумина, во вторую – 5 капель 1%-ного раствора желатина, в третью – 5 капель 1%-ного раствора растительного альбумина. Затем в пробирки добавляют по 3 капли концентрированной азотной кислоты и нагревают (осторожно!). При нагревании раствор и выпавший белый осадок или муть от свернувшегося белка окрашиваются в ярко-желтый цвет при наличии ароматических аминокислот: в пробирке с желатином появляется едва заметное бледно-желтое окрашивание (обусловленное незначительной примесью других белков). Пробирки охлаждают, после этого в них осторожно добавляют по 10 капель 30%-ного раствора гидроксида натрия. Выпавший в начале осадок белка растворяется, и жидкость окрашивается в ярко-оранжевый цвет.
