
LABORATORNAYa_RABOTA_11_novaya
.pdf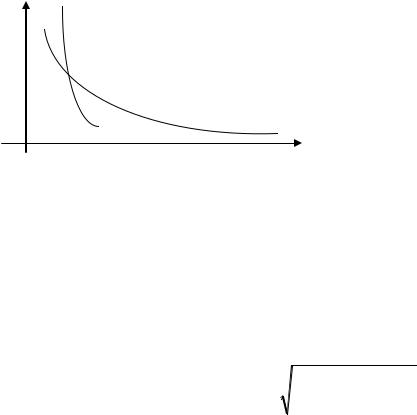
lnT ( 1)lnV const1 .
После потенцирования получим уравнение адиабаты в переменных Т и V:
TV 1 const2 . |
(26) |
Получим аналогичное уравнение в переменных Р и V. |
|
Подставим в (26) Т из уравнения Менделеeва-Клапейрона (16): |
|
PV V 1 const2 . |
|
mR |
|
Перенеся константы в правую часть, получим |
|
PV const3 . |
(27) |
Уравнение адиабатического процесса в переменных Р и V (27) носит |
|
название уравнения Пуассона. |
|
Из сопоставления уравнения Пуассона с уравнением |
изотермического |
процесса (РV = const) видно, что график адиабаты идет круче, чем изотермы
(рис.3).
P
адиабата (PV =const)
изотерма (PV=const)
V
Рисунок 3 Сравнительный вид адиабаты и изотермы
Адиабатические процессы и их приложения
1.Истечение газов из сопла ракеты
Поскольку истечение газов происходит гораздо быстрее, нежели теплообмен корпуса ракеты с окружающей средой, то можно считать процесс адиабатическим. Тогда формула критической скорости истечения газов имеет вид:
V |
|
2 |
|
R(T T ) |
1 |
|
1 |
|
|
||||
k |
1 2 |
|
||||
где Vk – критическая скорость; R – универсальная газовая постоянная; T
– абсолютная температура; μ – молярная масса.
2.Циклы тепловых машин
Адиабатические процессы лежат в основе циклов ряда тепловых машин, например, бензинового двигателя (цикл Отто) и двигателя внутреннего сгорания (цикл Дизеля). Показатель адиабаты входит в расчетные формулы коэффициентов полезного действия обоих циклов, например для цикла Отто:
11

1 V11 1 ,V2
где η – коэффициент полезного действия; V1 , V2 – объѐм.
3. Зависимость температуры атмосферного воздуха от высоты над поверхностью Земли
Нагретый у поверхности Земли воздух, поднимаясь в верхние слои атмосферы, где давление понижено, расширяется. Воздух плохой проводник тепла, изменение давление поднявшегося воздуха происходит практически адиабатически и поэтому сопровождается понижением температуры. Изменение
температуры воздуха с высотой определяется соотношением:
dT 1 g , dh R
которое также содержит показатель адиабаты.
Здесь g – ускорение свободного падения; h – высота атмосферного столба.
4. Ударная волна
Для оценки степени сжатия газов в ударной волне, которое с большой степенью точности можно считать адиабатическим, используется соотношение:
|
P |
|
|
1 |
|
|
|
1 |
|
|
, |
||
P2 |
1 |
|||||
|
|
|
|
где Р1 , Р2 – давление.
5. Распространение акустических волн
Процесс распространения акустических волн, представляющий собой периодическое сжатие и расширение газа при прохождении звуковых колебаний, можно также считать адиабатическим и проходящим со скоростью:
V |
|
P |
|
|
|
, |
(28) |
||||
|
|
||||
где ρ – плотность воздуха.
12
ВЫВОД РАБОЧЕЙ ФОРМУЛЫ
В баллоне имеется атмосферный воздух с температурой окружающей среды Т1 и давлением Р0.
Из стеклянного баллона быстро (адиабатически) откачивается часть воздуха до давления Р1 < Р0 , что ведет, согласно (1),к некоторому охлаждению газа. После установления термодинамического равновесия (через несколько минут) температура газа вновь сравняется с температурой Т1 .
Открывая кратковременно клапан, в баллон возвращается откачанная часть воздуха и снова устанавливается внешнее давление Р0.
Так как впуск воздуха произошѐл быстро, то теплообменом газа в баллоне с окружающей средой можно пренебречь.
Адиабатический процесс. Такое сжатие газа сопровождается нагреванием
(Т2>Т1). Действительно, согласно уравнению Пуассона |
(уравнение адиабаты), |
|||||||
записанному в переменных Р и Т , |
|
|
|
|
|
|
||
|
P |
1 |
|
Т |
1 |
|
|
|
|
1 |
|
|
|
, |
(1) |
||
P2 |
Т2 |
|||||||
|
|
|
|
|
||||
возрастание в баллоне давления (Р2 > Р1) должно приводить газ к повышению
температуры (Т2>Т1).
После закрытия клапана воздух в баллоне нагретый до температуры Т2 , со временем охладится до температуры окружающей среды Т1 .
Согласно закону Шарля (V=const), при изохорическом охлаждении уменьшится давление газа до значения Р3, отсюда имеем;
|
|
|
P |
|
|
|
Т |
|
|
|
|
|
|
|
|
|
|
|
|||
|
3 |
|
|
|
|
1 |
|
. |
|
|
|
|
|
|
|
|
|
(2) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
P2 |
|
Т2 |
|
|
|
|
|
|
|
|
|
|
|
|||||
Заменим в правой части (1) отношение температур Т1/Т2 согласно (2) на |
|||||||||||||||||||||
отношение давлений Р3/Р2, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
1 |
|
|
|
Р |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
1 |
|
|
|
|
|
3 |
|
, |
|
|
|
|
|
|
(3) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
P2 |
|
|
|
Р2 |
|
|
|
|
|
|
|
|
|
|||||
Р1=Р0 – ∆Р1 и Р3=Р0 – ∆Р2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Так как Р1 и Р3 меньше атмосферного Р0 |
, |
то следовательно, из |
(3) |
||||||||||||||||||
получается; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P P |
1 |
|
|
Р P |
|
|
||||||||||||
|
|
0 |
|
|
1 |
|
|
|
|
0 |
|
|
2 |
|
. |
(4) |
|||||
|
|
|
|
P0 |
|
|
|
|
Р0 |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Так как выражение в скобках мало отличаются от единицы, то при их |
|||||||||||||||||||||
разложении в ряд Тейлора можно ограничиться первыми членами ряда: |
|
||||||||||||||||||||
|
|
|
1 ( 1) |
P |
1 |
Р |
|
||||||||||||||
|
|
|
|
1 |
|
|
|
2 |
|
|
|||||||||||
|
|
|
P0 |
|
Р0 |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Р1 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
Р Р . |
|
|
|
|
|
(5) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
|
|
|
13

Используемый в работе жидкостный U – образный манометр позволяет измерять разности давлений в баллоне и атмосфере ( Р1, Р2 ), которые определяются по формуле гидростатического давления:
Р1 |
gh1 |
(6) |
|
Р2 |
gh2 |
||
|
где ρ – плотности жидкости в манометре; g – ускорение свободного падения; h – разности между уровнями столбов жидкости в манометре сразу после откачивания воздуха и через несколько секунд после закрытия клапана.
После подстановки (6) в (5) получим расчѐтную формулу в виде
|
|
h1 |
(7) |
|
h1 |
h2 |
|||
|
|
Атмосферный воздух представляет собой смесь газов и паров. Ориентировочное представление о составе воздуха можно получить из следующей таблицы, в которой представлены наиболее распространенные компоненты. Из еѐ анализа ясно, что основу составляет двухатомные газы – азот и кислород.
Таблица 2 Состав атмосферного воздуха
Содержание, %
Газ |
|
|
|
объѐмное |
массовое |
||
|
|||
Азот |
78,1 |
75,5 |
|
Кислород |
21 |
23,1 |
|
Водяной пар |
1,6 |
1 |
|
Аргон |
0,93 |
1,28 |
|
Двуокись углерода |
0,033 |
0,05 |
|
Водород |
0,011 |
0,00076 |
|
Неон |
0,0018 |
0,0012 |
Эти данные соответствуют условиям на уровне моря и до высоты порядка 100км меняются незначительно. Показатели водяного пара приведены для температуры 298 К и влажности 50%.
Однако в производственных и жилых помещениях, особенно расположенных вблизи неблагополучных в экологическом отношении предприятий, часто обнаруживается повышенное содержание трех- и более атомных газов. Количество водяных паров в закрытых помещениях также непостоянно и зависит от места, времени и влажности атмосферного воздуха.
14
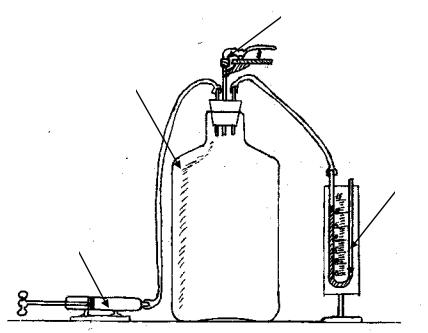
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Предлагаемый метод основан на измерении давления воздуха в сосуде при последовательном изменении состоянии газа, и называется методом Клемана – Дезорма.
4
1
3
2
Рисунок 3 – Установка для измерения показателя адиабаты: 1 – сосуд, 2 – насос, 3 – манометр, 4 – клапан
1Выкачать из бутыли воздух, закрыть клапан и выждать, пока температура воздуха не станет равной температуре окружающей среды. После этого отсчитать показания манометра L1 и L2.
2Открыть клапан и одновременно включить секундомер. Выдержать клапан открытым 5 с. и быстро его закрыть. Подождав 3–4 мин., пока температура в бутыли не станет равной температуре окружающей среды, отсчитать показание манометра L1 и L2.
3Повторять опыт, выдерживая клапан открытым 10, 15, 20, 25, 30 с. До открывания клапана уровень жидкости в одном из колен манометра во всех опытах должен быть на том же делении, что и в первом опыте.
ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
1Данные измерений записывают в приводимую ниже таблицу 3. L, l, h – измеряются в миллиметрах ∆h1=∆h2=2, ∆l= 1мм.
2Вычисляют величины h1, h2 и lg h2.
3Строится график : lg h2 = f(τ).
15
Таблица 3 –
N |
L1 |
L2 |
h1=L1+L2 |
∆h |
t |
l1 |
l2 |
h2 |
lg h2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4Из графика находится величина lg h2. соответствующая τ=0 и h2.
5Вычисляется по формуле (7) величина γ.
6Оцениваются погрешности γ по формуле:
КОНТРОЛЬНЫЕ ВОПРОСЫ
1Степени свободы.
2Закон равнораспределения.
3Идеальный газ.
4Внутренняя энергия идеального газа.
5Работа газа при изменении объема.
6Первое начало термодинамики.
7Теплоемкость. Удельная и молярная теплоемкости. Единицы измерения.
8Теплоемкость при постоянном объеме.
9Теплоемкость при постоянном давлении.
10Уравнение Менделеева - Клапейрона.
11 |
Уравнение |
Майера. Физический смысл универсальной газовой |
|
постоянной. |
|
12 |
Адиабатические процессы в природе и технике. |
|
13 |
Уравнение Пуассона с выводом. |
|
14 |
Показатель адиабаты. Его выражение через число степеней свободы. |
|
15Расчет показателя адиабаты для одно-, двух- и трехатомного газа.
16Состав атмосферного воздуха.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1 Общие требования и правила оформления учебных текстовых документов: СТП СМК 4.2.3-01-2011. -Введ. 07.04.2011. - Могилев: Могилевский государственный университет продовольствия, 2011. – 40 с.
2Савельев И. В. Курс общей физики. В 3т., Т. 2. - СПб.: Лань, 2007.- 336 c.
3Савельев И. В. Курс общей физики. Кн. 1. - М. АСТ Астрель, 2006. - 336 с.
4Трофимова Т.И. Курс физики. – М.: Высшая школа, 2007. -558c.
16
17

С О Д Е Р Ж А Н И Е
ПРЕДИСЛОВИЕ…………………………………………………………………...3
ЦЕЛЬ РАБОТЫ. ПРИБОРЫ И ПРИНАДЛЕЖНОСТИ……………………...4
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Степени свободы. Закон равнораспределения…………………………………….4 Идеальный газ. Внутренняя энергия идеального газа…………………………….6 Первое начало термодинамики……………………………………………………..7 Работа газа при изменении объема…………………………………………………7
Виды теплоемкостей………………………………………………………………...8
Теплоемкость в изопроцессах………………………………………………………8 Адиабатические процессы. Показатель адиабаты……………………………..10
Уравнение адиабаты……………………………………………………………….10
Адиабатические процессы и их приложения…………………………………….12
ВЫВОД РАБОЧЕЙ ФОРМУЛЫ…………………………………………….....22 КОНТРОЛЬНЫЕ ВОПРОСЫ………....………………………………………..21
18
Учебное издание
ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ АТМОСФЕРНОГО ВОЗДУХА
Методические указания
Составитель Малышев Владимир Львович
Редактор А.А. Щербакова Технический редактор Т.В Багуцкая
Подписано в печать Формат 60х84 1/16 |
Бумага офсетная. |
|
Гарнитура Таймс. Ризография. |
Усл. печ. л. |
Уч.-изд. л. |
Тираж __ экз. |
Заказ ___ |
|
Учреждение образования «Могилѐвский государственный университет продовольствия».
ЛИ №02330/0131913 от 08.02.2007. пр-т Шмидта, 3, 212027, Могилѐв.
Отпечатано в учреждении образования «Могилѐвский государственный университет продовольствия».
пр-т Шмидта, 3, 212027, Могилѐв.
19
