
Белорусский государственный университет Химический факультет
КОЛЛОИДНАЯ ХИМИЯ Опорный конспект лекций для студентов
специальности «Химия» G 1-31 05 1
Составители:
доцент, к.х.н. Савицкая Т.А. асс., к.х.н. Котиков Д.А.
Минск, 2006
1
Данный вариант конспекта в сжатой форме содержит основные положения курса лекций по дисциплине “Коллоидная химия” и указания на литературные источники, чтение которых в сочетании с посещением лекций позволит Вам получить полное представление о физико-химических основах науки о поверхностных явленияхидисперсныхсистемах.
Курс состоит из 12 основных разделов, которые приведены ниже, ирассчитанна14 лекций.
1.Введениевколлоиднуюхимию
2.Молекулярные взаимодействия и особые свойства поверхности разделафаз
3.Образованиедисперсныхсистем
4.Молекулярно-кинетическиесвойствадисперсныхсистем
5.Адсорбциянаповерхностиразделафаз
6.Электрическиесвойствадисперсныхсистем
7.Оптическиесвойстваколлоидныхсистем
8.Устойчивостьдисперсныхсистем
9.Лиофильныеколлоидныесистемы
10.Строениеисвойствааэрозолей, пен, эмульсий
11.Основы физико-химическоймеханики
12.Коллоидно-химическиеосновыохраныокружающейсреды.
Разделы 7 и 10 Вам предстоит изучить полностью самостоятельно, руководствуясь Программой дисциплины. Разделы 9, 11, 12 разбираютсянасеминарскихзанятиях.
Желаем Вам успехов в изучении коллоидной химии!
Обратите внимание на то, что в тексте есть гиперссылки, выделенные цветом и подчеркиванием, для особо любознательных студентов.
Рекомендуемая литература:
Основная:
1.Воюцкий С. С. Курс коллоидной химии. М., 1976. 512 с.
2.Фридрихсберг Д. А. Курс коллоидной химии. Л.: Химия, 1995. 400 с. Фридрихсберг Д. А. Курс коллоидной химии. Л.: Химия, 1984. 368 с.
3.Фролов Ю. Г. Курс коллоидной химии. М: Химия, 1988. 464 с. Фролов Ю. Г. Курс коллоидной химии. М: Химия, 1982. 400 с.
4.Щукин Е. Д., Перцов А. В., Амелина Е. А. Коллоидная химия. М.: Изд-во Моск. ун-та, 2004. 445 с.
Щукин Е. Д., Перцов А. В., Амелина Е. А. Коллоидная химия. М.: Изд-во Моск. ун-та, 1982. 348 с.
2

Дополнительная:
1.Захарченко В. Н. Коллоидная химия. М.: Высшая школа, 1989.
238 с.
2.Зимон А. Д., Лещенко Н. Ф. Коллоидная химия. М.: Химия, 1995.
335 с.
3.Адамсон А. Физическая химия поверхностей. М.: Мир, 1979. 568 с.
4.Ребиндер П. А. Поверхностные явления в дисперсных системах: Коллоидная химия. М.: Наука, 1979, 368 с.
4.Ребиндер П. А. Поверхностные явления в дисперсных системах: Физико-химическая механика. М.: Наука, 1979. 381 с.
5.Шелудко А. Коллоидная химия, 2-е изд., перераб. и доп./Под ред. Б. В. Дерягина и Е. Д. Щукина. М.: Мир, 1984. 319 с.
6.Яминский В. В. и др. Коагуляционные контакты в дисперсных системах. М: Химия, 1982. 185 с.
7.Сумм Б. Д., Горюнов Ю. В. Физико-химические основы смачивания
ирастекания. М.: Химия, 1976. 230 с.
8.Измайлова В. Н., Ямпольская Г. П., Сумм Б. Д. Поверхностные явления в белковых системах. М.: Химия, 1988. 238 с.
9.Фелленберг Г. Загрязнение природной среды. М.: Мир, 1997. 198 с.
10.Сумм Б. Д. Вестник МГУ. Сер. 2. Химия 34, 59 (1993).
11.Сумм Б. Д. Вестник МГУ. Сер. 2. Химия 40, 400 (1999).
количество литературы ограничено!!!
Диаграмма наличия основной рекомендованной литературы в библиотеке химического корпуса БГУ
120
100
кол-во 80 экземпля- 60 ров 40
20
0
|
|
109 |
|
62 |
46 |
|
|
|
|
|
|
|
|
|
43 |
1 |
2 |
3 |
4 |
|
учебник |
|
|
3

ЛЕКЦИЯ 1
Практическое использование дисперсных материалов и связанных с ними процессов и поверхностных явлений, было известно в первоначальной ремесленной химии еще во времена глубокой древности, отстоящие от нас на тысячелетия и относящиеся к древней культуре Индии, Китая, Египта, Греции и других стран (краски и окрашивание тканей, керамика и глазури, цветное стекло, изго-
товление мыл и др.).
Однако свою историю коллоидная химия отсчитывает с 1861 года, с открытия Т.Грэмом коллоидных растворов. Коллоидами Грэм назвал вещества, которые образуют водные растворы с клееподобными свойствами и не проходят через полупроницаемые перегородки – мембраны.
По гречески колла (æωλλα) означает клей, эидос (ei∆oσ) означа-
ет вид.
В коллоидных растворах мельчайшие частицы вещества образуют одну фазу, а среда, в которой они находятся,– другую. Вещества, дающие молекулярные или ионные растворы, Грэм назвал кристаллоидами. Эти вещества, как писал Грэм в своей работе
«Диффузия жидкостей в применении к анализу», не задерживаются
мембраной.
 Т.Грэм “Диффузия жидкостей в применении к анализу”
Т.Грэм “Диффузия жидкостей в применении к анализу”
Далее следовал “химический” период развития коллоидной химии, и до конца ХIХ в. усилия исследователей были направлены на синтез различных коллоидов – неорганических, органических, белковых. Уже к 1910 году было известно несколько методов получения хлорида натрия – типичного «кристаллоида» в коллоидном состоянии в органических средах. Позднее П. Веймарн получил
4

более 200 золей из типичных кристаллоидов. Таким образом, стала понятна условность названия «коллоиды» и пришло понимание того, что большинство веществ могут быть получены в коллоидном, т.е. дисперсном состоянии, которое обеспечивает появление спе-
цифических свойств. Все это позволило говорить о коллоидном состоянии вещества как о всеобщем состоянии материи, промежуточном между молекулярным (атомы, ионы, молекулы) и фазовым
(макротела). Важно понимать, что свойства вещества в коллоидном состоянии определяет не их природа, а размер частиц.
Исследования зависимости свойств систем от размера частиц составили содержание следующего этапа в развитии представлений об объектах коллоидной химии. Главным результатом этого этапа явился вывод о том, что к признакам объектов коллоидной химии относится не только дисперсность, но и гетерогенность (многофазность).
В начале ХХ в. в коллоидную химию вошли идеи и методы физики и физической химии. Они быстро привели к фундаментальным открытиям: установлена гетерогенная природа коллоидных растворов; открыто седиментационно-диффузионное равновесие в суспензиях и эмульсиях; разработан метод измерения размера высокодисперсных частиц и макромолекул с помощью ультрацентрифуг; создана кинетическая теория адсорбции и строения адсорбционных слоев поверхностно-активных веществ. В сочетании с термодинамикой поверхностных явлений Гиббса эти работы составили теоретический фундамент коллоидной химии.
Современная коллоидная химия – своеобразная пограничная об-
ласть знания. Тесные контакты с другими науками способствовали созданию экспериментальной базы, объединяющей собственные, исторически сложившиеся, и современные методы исследования, заимствованные из других наук.
5

Классические коллоидно-химические методы исследования:
Определение поверхностного натяжения, в частности, методом наибольшего давления пузырьков, определение поверхностного давления, ультрамикроскопия, диализ, ультрафильтрация, дисперсионный анализ, порометрия, рассеяние света и др.
Методы исследования, заимствованные из других наук:
Рентгенофазовый анализ, всевозможные спектральные методы (ЯМР, ЭПР, оптическая, УФ- и ИК-спектроскопии, гашение люминисценции, эллипсометрия), все виды электронной микроскопии (просвечивающая, сканирующая), атомносиловая микроскопия, флуоресцентная микроскопия и др. Перспективны современные физические методы исследования поверхности с использованием медленных электронов, масс-спектрометрия вторичных ионов и т.п.
Тенденция развития коллоидной химии на современном этапе: химические процессы в коллоидных системах (химические реакции в микроэмульсиях, тонких пленках, адсорбционных слоях, пенах, гелях; мицеллярный катализ и т. п.).
Современная коллоидная химия – крупная область химической нау-
ки, изучающая свойства веществ в дисперсном состоянии и поверхностные явления в дисперсных системах.
Поверхностные явления (ПЯ) – процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое, и возникающие в результате взаимодействия сопряженных фаз, имеющих различный состав и строение.
Понятие “поверхность” в коллоидной химии отлично от геометрического.
В геометрии |
|
В коллоидной химии |
|
|
|
Поверхность имеет площадь, но не Поверхность раздела фаз – это граимеет толщины. Это общая часть ничная область между фазами, кодвух смежных областей пространстнечный по толщине слой, в котором ва. происходит изменение свойств от значений, характерных для одной фазы, до значений, характерных для другой.
Ас и Аd – значение свойства соответственно в фазах с и d.
6
Итак, поверхность раздела фаз – это не просто граница, не имеющая толщины. На границе раздела фаз формируется поверхностный слой (межфазная поверхность) толщиной в один или несколько молекулярных размеров (диаметров). Гиббс рассматривал поверхностный слой как отдельную фазу. Теория Гиббса рассматривает поверхностный слой вещества как самостоятельную фазу, термодинамические параметры которой отличаются от аналогичных параметров объемной фазы того же вещества. Например, структура поверхности жидкости будет отличаться от структуры жидкости во внутреннем объеме.
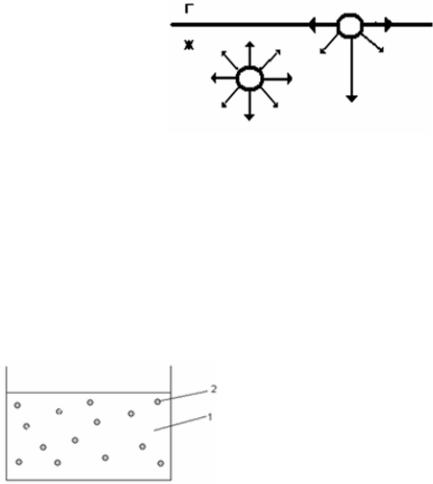
В чем же причина поверхностных явлений? Пусть из двух соседних фаз в первой межмолекулярные взаимодействия сильнее, чем во второй. Тогда в этой фазе важнейшее свойство поверхностного слоя состоит в том, что находящиеся в нем молекулы обладают избыточной энергией Гиббса (по сравнению с молекулами внутренней части той же фазы).
Для внутренних молекул равнодействующая всех межмолекулярных взаимодействий равна нулю, а для поверхностных молекул она направлена перпендикулярно поверхности внутрь фазы. Догадались почему?
Следовательно, для выведения молекул из объема на поверхность надо преодолеть эту силу, т. е. совершить работу и сообщить молекулам определенную энергию. Увеличение площади поверхности приводит к увеличению числа поверхностных молекул и поверхностная энергия возрастает. Следо-
вательно, молекулы, находящиеся в поверхностном слое, являются «особыми» с точки зрения энергетического состояния. Доля особых молекул возрастает с уменьшением размера частиц.
Поверхностные явления присущи всем системам, имеющим поверхность раздела фаз, но сильнее всего они проявляются в дисперсных системах, которые являются гетерогенными и имеют высокоразвитую поверхность.
Схематическое изображение дисперсной системы 1-дисперсионная среда ДС (сплошная фаза) 2-дисперсная фаза ДФ (раздробленная фаза)
Дисперсные системы – такие многофазные системы (например, двухфазные), где по крайней мере одна из фаз является раздробленной (т. е. представлена более или менее крупными частицами) и распределена во второй (непрерывной) фазе. Необходимым условием существования дисперсных систем является нерастворимость ДФ в ДС.
7

Реальный окружающий нас мир, как и мы сами, состоит из дисперсных систем:
Частицы какого размера следует рассматривать как коллоидные? Колло-
идные частицы занимают промежуточное положение между атомами и реальными объектами:
Если представить себе обычную молекулу величиной с маленькую крупинку сахара, то коллоидные частицы средних размеров оказались бы величиной с яблоко!
Термин “коллоид” относится к любому веществу независимо от его химического состава, структуры, геометрической формы, агрегатного состояния, если по крайней мере один из его размеров менее 1 мкм, но более
1 нм. M.G.Hill. Enciclopedia of Science and Technology. 1987, Vol. 4, P. 162.
Это определение дано в традиционном понимании «коллоиднодисперсных» систем, для которых характерно активное участие частиц в броуновском движении с вытекающими отсюда молекулярнокинетическими явлениями (диффузия, осмос). Рассматриваемый современной коллоидной химией диапазон размеров шире: от больших, чем простые молекулы, до видимых невооруженным глазом, т. е. от 10-9 до 10-4 м.
8

Форма частиц дисперсной фазы может быть различной:
Электронные микрофотографии коллоидных частиц сульфидов цинка ZnS (а) и свинца PbS (b), фосфата магния Mg3(PO4)2 (с), карбоната кадмия CdCO3 (d),
вируса табачной мозаики (е) и сажи (f).
Помимо частиц в качестве дисперсной фазы могут быть нити, волокна, а также пленки. Нити (а), например, имеют два размера, определяющих дисперсность, пленки (б) – один.
Если размер, определяющий дисперсность, у всех частиц одинаков, то подобную систему называют монодисперсной, например, пыльца некото-
рых растений, полученные синтетическим путем полимерные микросферы и т. п. Если в системе присутствуют частицы различных размеров, то такая система называется полидисперсной.
Чем интересны монодисперсные коллоидные системы? Что такое коллоидные кристаллы? Если Вы не можете ответить сразу на эти вопросы, обратитесь к литературным источникам:
-Савицкая Т. А. Коллоидные кристаллы. Хiмiя. Праблемы выкладання. 1999, №4. – С. 3-13.
-Darragh P., Gasrin A., Sanders. Opals. Sci. Am. 1976. Vol. 234, №4. Р. 84-95.
|
|
Литература: |
1. |
С. 9-20 |
|
2. |
С. 7-12; |
6-11 |
3. |
С. 9-12, 15-19; 10-14, 17-21 |
|
4. |
С. 5-14; |
8-15 |
9
