1. Биохимия
.docx
Биохимия – наука о жизни на молекулярном уровне.
Она изучает химические компоненты живых организмов, а также реакции и процессы (совокупность реакций), протекающие в них.
Все земные живые организмы обладают наследственной информацией и выполняют работу направленную на самоподдержание и размножение с использованием энергии полученной из внешней среды.
Минимальная единица жизни, способная к самовоспроизведению – клетка.
Упрощенная схема клетки
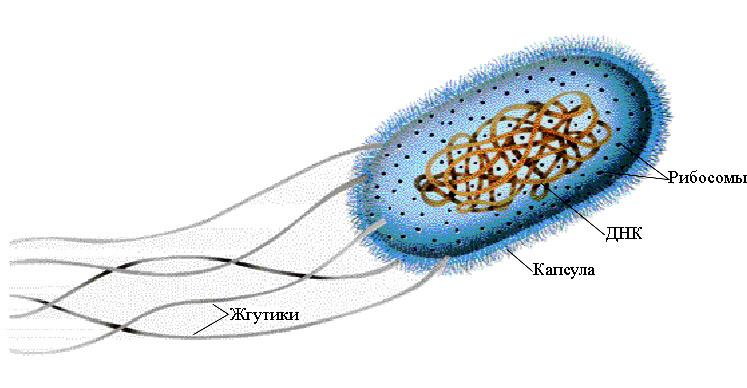
Прокариотическая клетка микроорганизмов
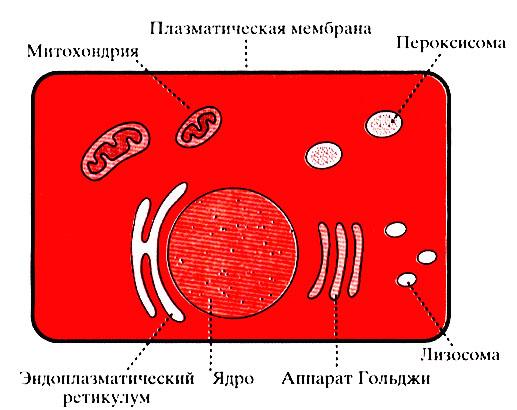
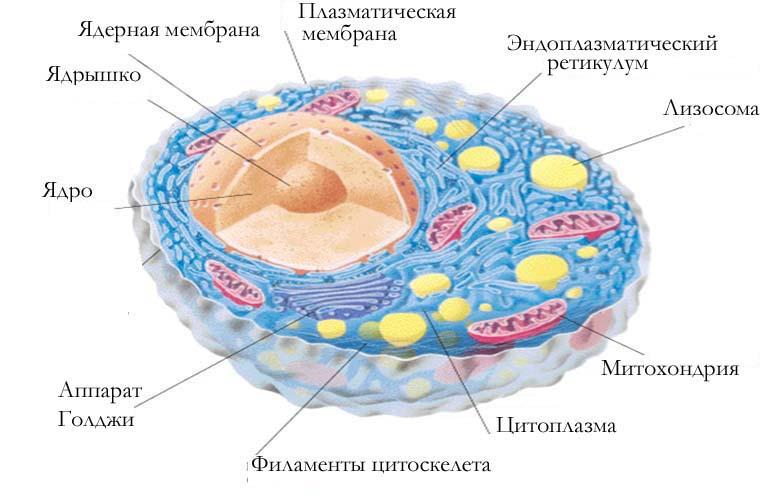
Эукариотическая клетка животных организмов
Эукариотическая клетка растительных организмов

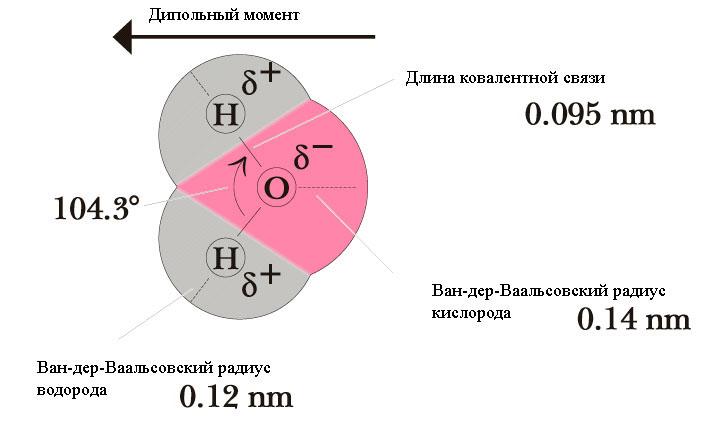
Вода
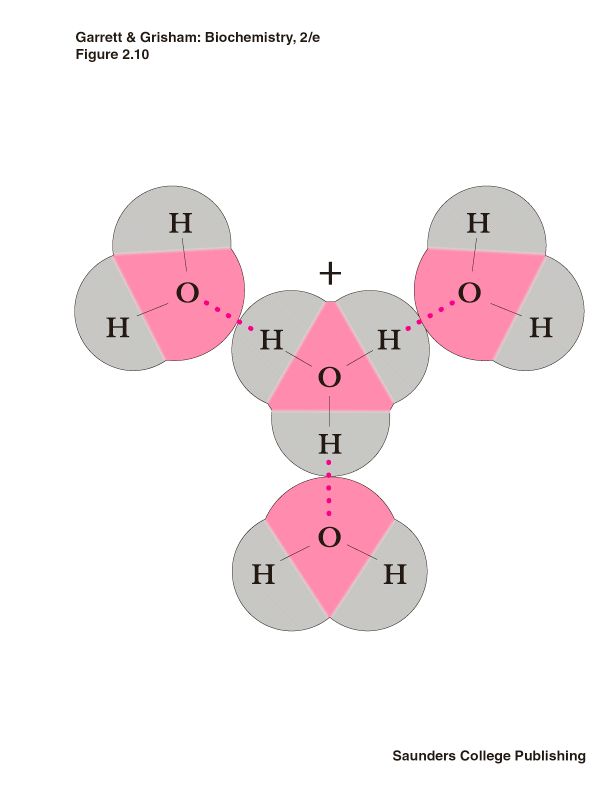
Кластер из 4х молекул воды
Основные классы биомолекул
Белки Proteins
Углеводы Carbohydrates
Липиды Lipids
Нуклеиновые кислоты Nucleic Acids
Большинство биомолекул – соединения углерода с водородом, кислородом, азотом, фосфором или серой
Макроэлементы: С, H, O, N, P, S
Микроэлементы: Fe, Cu, Ca, K, Na, Mg, Se, Co …
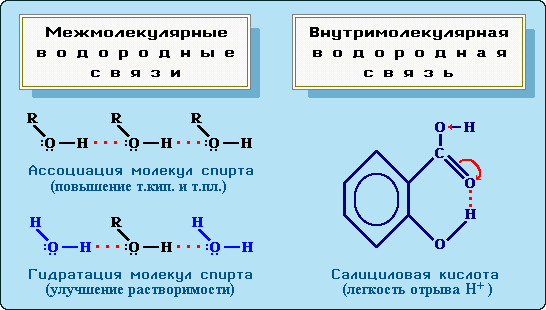
Водородные связи (Н-связи)
Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), испытывает недостаток электронов и поэтому способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома этой же или другой молекулы. В результате возникает водородная связь, которая графически обозначается тремя точками:
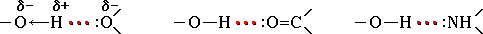
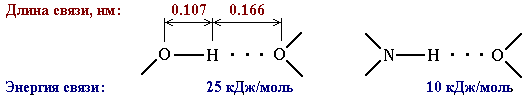
Эта связь значительно слабее других химических связей (энергия ее образования 10-40 кДж/моль) и в основном определяется электростатическим и донорно-акцепторным взаимодействиями.
Пример образования водородной связи
В молекуле
спирта R-O-H химическая связь между атомом
водорода и более электроотрицательным
атомом кислорода весьма полярна. Водород
имеет частичный положительный заряд
(d+), а кислород - частичный отрицательный
(d-):
![]()
Следовательно, возможно образование водородных связей между молекулами спирта:
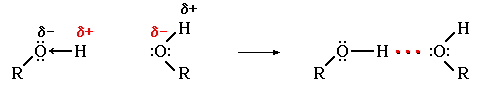
Наиболее часто встречаются следующие водородные связи:
-O-H…O-
-O-H…N-
-N-H…O-
-N-H…N-
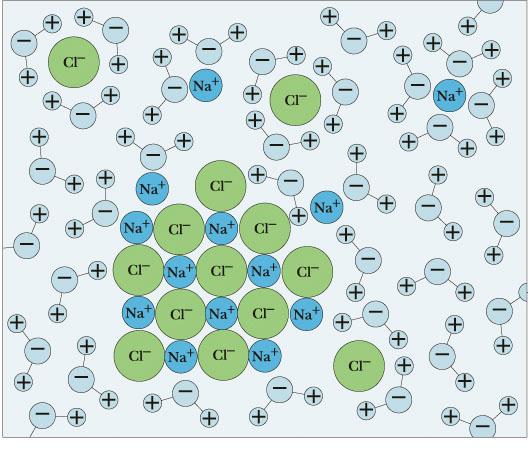
Ионная связь
Химическая связь, основанная на электростатическом притяжении ионов, называется ионной связью.
Пример: Na+ Cl – Δχ = 3,0(Cl) - 0,9(Na) = 2,1
Атом Na (1 электрон на внешнем уровне) и атом Cl (7 внешних электронов) превращаются в ионы Na+ и Cl- с завершенными внешними электронными оболочками (по 8 электронов), между которыми возникает электростатическое притяжение, т.е. ионная связь.
Растворение соли в воде
Ван-дер-ваальсовы силы
Ван-дер-ваальсовы силы (Van-der-Vaalse force) – это силы притяжения, возни-кающие между электричес-ки нейтральными атомами и молекулами.
Они обусловлены движе-нием электронов в атомах, и в 10.. .20 раз слабее, чем силы притяжения между ионами.
Гидрофобные взаимодействия
Гидрофобная связь – это, по существу говоря, не связь, а «невольное» объединение молекул, отторгнутых молекулами воды.
Гидрофобные молекулы «не любят» воду – растворяются в ней очень плохо.
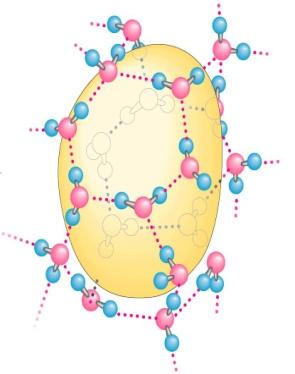 Капля
масла в воде
Капля
масла в воде
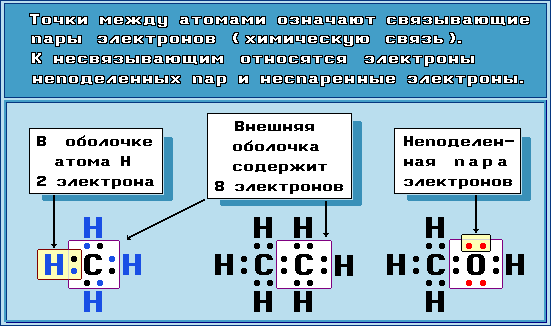
Ковалентная связь
Связь, образованная путем обобществления пары электронов связываемых атомов, называется ковалентной
![]()
Ковалентная связь и, соответственно, молекула могут быть неполярными, когда оба связанных атома имеют одинаковое сродство к электрону, например Н : Н. Такая связь обладает максимальной прочностью. Она может быть полярной, когда электронная пара вследствие большего сродства к электрону одного из атомов оттянута в его сторону: H-Cl