
- •Министерство образования российской федерации
- •Лабораторная работа № 1
- •1.1. Определение титруемой кислотности и щелочности
- •1.2. Определение теоретической натуральной щелочности сока I сатурации
- •1.3. Определение оптимальной щелочности сока I сатурации
- •1.4. Определение скорости отстаивания сока I сатурации
- •1.5. Определение оптимальной щелочности сока II сатурации
- •1.5.1. Прямой метод
- •1.5.2. Экспресс-метод Введение
- •Приборы и материалы: - баллон с диоксидом углерода;
- •- Бюретка со штативом и стеклянный стакан. Ход определения
- •Контрольные вопросы
- •1.6. Определение содержания солей кальция в соках сахарного производства
- •1.6.1. Комплексометрическое определение кальция и магния обратным титрованием
- •1.6.2. Комплексометрическое определение кальция
- •Введение
- •Приборы и материалы:
- •Ход определения
- •Общее содержание сернистой кислоты в процентах so2определяют по формуле
- •Лабораторная работа № 3 Определение содержания редуцирующих веществ в свекле и продуктах сахарного производства классическим методом Введение
- •3.1. Определение содержания редуцирующих веществ в свекле классическим методом
- •3.2. Определение содержания редуцирующих веществ в диффузионном соке
- •4.1. Определение содержания редуцирующих веществ в сахаре-песке
- •Ход определения
- •4.2. Определение кондуктометрической золы сахара-песка
- •Ход определения
- •4.3. Определение цветности сахара-песка Введение
- •Расчеты:
- •5.1. Определение влияния св сахарных растворов на кинетику адсорбции красящих веществ на активном порошкообразном угле
- •5.2.Определение влияния св сахарных растворов на характер изотермы адсорбции их красящих веществ
- •Ход определения
- •Ход определения
- •6.1. Определение полной обменной емкости катионита Введение
- •Ход определения
- •Расчеты:
- •6.2. Определение полной обменной емкости анионита Введение
- •Ход определения
- •Ход определения
- •7.1. Определение окисляемости
- •Введение
- •Реактивы: - 0,4 н. Раствор серно-хромовой смеси: 20 г тонко измельченного бихромата калия растворяют в 500 см3дистиллированной воды. Затем к этому раствору прибавляют 500 см3концентрированнойH2so4;
- •7.1.2. Перманганатный метод
- •Реактивы:
- •Введение
- •8.1. Определение влажности
- •8.2. Определение обесцвечивающей способности
- •8.3. Определение водорастворимых веществ
- •8.4. Определение золы
- •8.5. Определение рН водяной вытяжки активного угля
- •8.6. Определение коллоидных веществ
- •Список использованной литературы
- •Жигалов м.С., Славянский а.А. Лабораторный практикум по технологии сахара. - м.: мтипп, 1990. - 88 с.
- •Содержание
6.1. Определение полной обменной емкости катионита Введение
Полная (общая) обменная емкость катионита определяется при нейтрализации раствором NaOH или КОН в статических или динамических условиях и выражается в эквивалентах на 1 г сухого или 1 дм3 набухшего катионита.
Реакции обмена катионов (К- катионит) имеют вид:
![]()
Вещества, не диссоциирующие в растворах, адсорбируются ионитами, как на активном угле, по законам молекулярной адсорбции.
Полная обменная емкость различных марок сильнокислотных катионитов, применяемых в сахарной промышленности, колеблется от 4 до 6 мг-экв/г. Например, отечественный катионит КУ-2-8/Н, Na ионная форма/ имеет полную обменную емкость 5,1 /Н/мг-экв/г.
Цель анализа - оценить качество и пригодность катионита для очистки сахарных растворов.
Принцип
метода анализа
основан на титровании образовавшейся
в результате реакции ионного обмена
кислоты
![]() 0,1 н. раствором
NaOH
в присутствии метилоранжа как индикатора.
0,1 н. раствором
NaOH
в присутствии метилоранжа как индикатора.
Реактивы:
- 5%-ный раствор NaCl;
- 0,1 н. раствор NaOH;
Индикатор - метилоранж.
Приборы и материалы:
- стеклянная колонка диаметром 18 мм, высотой 250см с оттянутым концом;
- капельная воронка;
- мерная колба вместимостью 200 см3;
- мерный цилиндр вместимостью 100 см3;
- бюретка для титрования;
- химический стакан;
- катионообменная смола.
Ход определения
5 г приготовленного для анализа катионита в Н-форме переводят в стеклянную колонку диаметром 18 мм с помощью дистиллированной воды, избыток воды спускают через резиновую трубку с зажимом, одетую на оттянутый конец нижней части колонки. Для предотвращения уноса катионита на стеклянную решетку колонки помещают тампон из стеклянной ваты.
После этого из капельной воронки, установленной над колонкой с катионом, в течение 30 мин равномерно пропускают 100 см3 5%-ного раствора химически чистого NaCl, поддерживая уровень раствора над слоем катионита равным 1 см. Затем катионит промывают двойным по его объему количеством воды. Фильтрат и промывные воды собирают в мерную колбу, где доводят их объем до 200 см3. Из этого объема отбирают 50 см3 в отдельный стакан и титруют 0,1н. раствором NaОН в присутствии метилоранжа как индикатора.
Расчеты:
1. Для получения сравнимых результатов обменную емкость катионита выражают через миллиграмм-эквивалент ионов / или число активных групп/, приходящихся на 1 г сухого ионита. Поэтому, если расход 0,1н. раствора NaOH для нейтрализации кислоты, выделенной 1 г абсолютно сухого катионита, можно выразить формулой
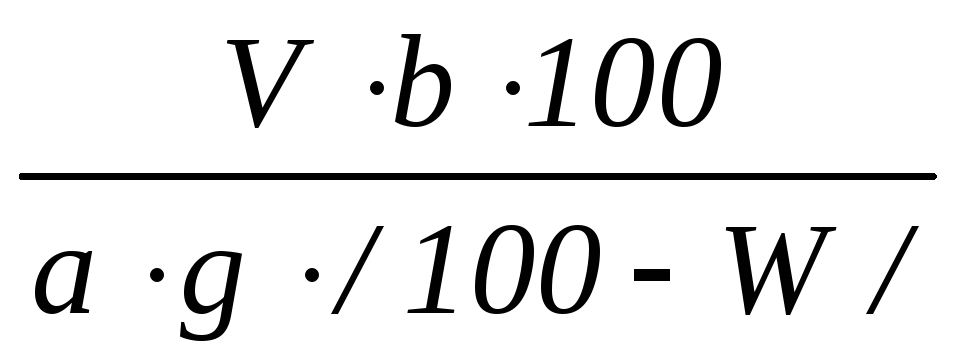 ,
,
а в 1 см3 1 н. раствора NaОН содержится 0,1 мг-экв, то полная обменная емкость катионита может быть рассчитана из формулы
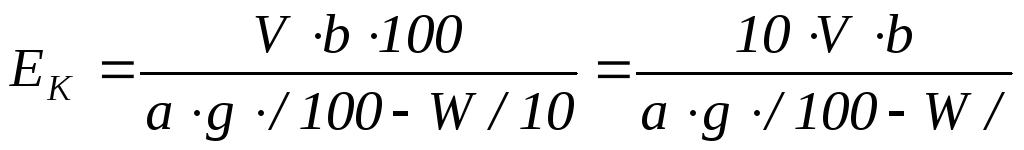 ,
,
где Ек - полная обменная емкость, в мг-экв/г абсолютно сухого катионита;
b - общее количество фильтрата, см3;
V - количество 0,1 н. раствора NaOH, пошедшее на титрование фильтрата, см3;
a – количество фильтрата, отобранного для титрования, см3;
g – количество сухогого катионита, взятого для определения его полной обменной емкости, г;
W – влажность катионита, %. Определяют методом высушивания в течение 3-х часов при температуре 95-100ºС.
2. Обменную емкость катионита можно выразить также по натрию. В этом случае расчет ведется по формуле
 или,
так как 1 см3
0,1 н. раствора NaОН
содержит 0,0023 г натрия, то
или,
так как 1 см3
0,1 н. раствора NaОН
содержит 0,0023 г натрия, то
 .
.
