
- •I. Химическое равновесие
- •1.1. Основные понятия
- •1.2. Расчет константы химического равновесия
- •1.3. Расчет равновесных концентраций с использованием константы равновесия
- •II. Смещение химического равновесия. Принцип ле-шателье
- •2.1. Общие понятия
- •2.2. Влияние изменения концентраций на направление смещения равновесия
- •2.3. Влияние изменения давления в системе на смещение равновесия
- •2.4. Влияние изменения объема системы на смещение равновесия
- •2.5. Влияние изменения температуры на смещение равновесия
- •2.6. Расчет новых равновесных концентраций
2.3. Влияние изменения давления в системе на смещение равновесия
Изменение давления в системе смещает равновесие только в реакциях с участием газообразных веществ. При ее протекании может изменяться число молей газообразных веществ. Тогда:
при повышении давления система стремится понизить его, и равновесие смещается по направлению реакции, идущей с уменьшением числа молей газообразных веществ;
при понижении давления она стремиться повысить его, и равновесие смещается по направлению реакции, идущей с увеличением числа молей газообразных веществ;
давление не влияет на равновесие в системе, если число молей газообразных веществ в ходе реакции не изменяется.
Пример 6. В каком направлении сместится равновесие:
2NO(г) + Cl2(г) 2NOCl(г),
если давление в системе увеличить в 2 раза. Ответ подтвердите расчетом.
Решение.
1. Так как число молей газов в ходе реакции уменьшается (реагентов – 3 моль, продуктов – 2 моль), то согласно принципу Ле-Шателье, при увеличении давления равновесие сдвигается по направлению прямой реакции, т. е. вправо «→».
2. Учитывая, что при увеличении давления в 2 раза концентрации газообразных веществ увеличиваются в такое же число раз, т.е. в 2 раза, находим отношения скоростей прямой и обратной реакций до и после изменения давления:
Таблица 5
|
|
Прямая |
Обратная |
|
1) При равновесии |
|
|
|
2) При измененных концентрациях |
|
|
|
3) Отношение |
|
|
Отсюда
видно, что при увеличении давления в
системе в 2 раза скорость прямой реакции
увеличивается в 8 раз, а обратной – в 4
раза, т.е. выполняется условие
![]() ;
и равновесие смещается вправо ( →).
;
и равновесие смещается вправо ( →).
2.4. Влияние изменения объема системы на смещение равновесия
Поскольку молярная концентрация вещества
![]() ,
моль/л,
,
моль/л,
обратно пропорциональна объему системы (V), то увеличение (уменьшение) объема системы в x раз приводит соответственно к уменьшению (увеличению) молярных концентраций газообразных или растворенных веществ в x раз.
Отсюда следует, что о смещении равновесия можно судить по изменению скоростей реакций (см. пример 5).
Пример 7. В каком направлении сместится равновесие реакции
CS2(г) + 2Cl2(г) CCl4(г) + 2S(тв),
если объем системы уменьшить в 2 раза. Ответ подтвердите расчетом.
Решение.
Уменьшение объема системы в 2 раза приводит к увеличению концентрации газообразных веществ в 2 раза. Используя прием, описанный в примере (6), находим отношения:
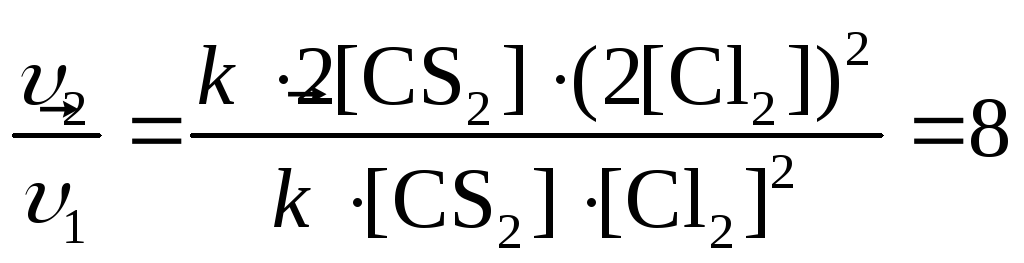 ,
,![]() .
.
При
уменьшении объема в 2 раза скорость
прямой реакции увеличилась в 8 раз, а
обратной – в 2 раза, т.е. выполняется
условие
![]() и равновесие смещается вправо (→).
и равновесие смещается вправо (→).
Ответ: равновесие в системе смещается вправо.
2.5. Влияние изменения температуры на смещение равновесия
Направление смещения равновесия при изменении температуры можно определить, по крайней мере, двумя способами.
I способ. Известен или может быть рассчитан тепловой эффект реакции (ΔHr):
-
при повышении
![]() система по принципу Ле-Шателье старается
ее понизить, и тогда равновесие сдвигается
по направлению реакции, идущей с
поглощением тепла, т.е. реакции
эндотермической (
система по принципу Ле-Шателье старается
ее понизить, и тогда равновесие сдвигается
по направлению реакции, идущей с
поглощением тепла, т.е. реакции
эндотермической (![]() );
);
-
при понижении
![]() система по принципу Ле-Шателье старается
ее повысить, и тогда равновесие сдвигается
по направлению реакции, идущей с
выделением тепла, т.е. реакции
экзотермической (
система по принципу Ле-Шателье старается
ее повысить, и тогда равновесие сдвигается
по направлению реакции, идущей с
выделением тепла, т.е. реакции
экзотермической (![]() ).
).
При прогнозировании смещения равновесия необходимо помнить:
![]() ,
,
что означает: если прямая реакция экзотермическая, то обратная является эндотермической, и наоборот.
Пример 8. Как будет влиять увеличение температуры на состояние равновесия в реакции:
|
| ||||
|
|
-393,0 |
0 |
-110,5 |
|
Решение. Рассчитаем тепловой эффект реакции, используя табличные данные стандартных теплот образования веществ:
![]()
![]() кДж.
кДж.
![]() ,
значит, прямая реакция эндотермическая,
т. е. идет с поглощением тепла. Нагревание
реакционной смеси способствует протеканию
прямой реакции, и равновесие сместится
по направлению прямой реакции, т.е.
образования продуктов реакции (→).
,
значит, прямая реакция эндотермическая,
т. е. идет с поглощением тепла. Нагревание
реакционной смеси способствует протеканию
прямой реакции, и равновесие сместится
по направлению прямой реакции, т.е.
образования продуктов реакции (→).
Ответ: равновесие сместится вправо.
II
способ.
Известны температурные коэффициенты
(![]() )
прямой и обратной реакций. В этом случае
определить направление смещения
равновесия при изменении температуры
можно используя правило Вант-Гоффа:
)
прямой и обратной реакций. В этом случае
определить направление смещения
равновесия при изменении температуры
можно используя правило Вант-Гоффа:
![]() ,
(9)
,
(9)
где
![]() -
скорости реакции при температурахt1
и t2,
соответственно. Температура может быть
выражена и в градусах Цельсия, и Кельвина.
- температурный коэффициент скорости
реакции.
-
скорости реакции при температурахt1
и t2,
соответственно. Температура может быть
выражена и в градусах Цельсия, и Кельвина.
- температурный коэффициент скорости
реакции.
Пример 9. Определите, в каком направлении сместится равновесие реакции:
2MgCl2(тв) + O2(г) 2MgO(тв) + 2Cl2(г)
при
повышении температуры на 100 °С, если
![]() ,
а
,
а![]() ?
Ответ подтвердите расчетом.
?
Ответ подтвердите расчетом.
Решение.
Используя
правило Вант-Гоффа (9) и учитывая, что t2
– t1
= Δt
= 100, рассчитаем, во сколько раз изменятся
скорости прямой и обратной реакций,
т.е. отношение
![]() .
.
|
Прямая реакция |
Обратная реакция |
|
|
|
В
нашем случае скорость прямой реакции
увеличится в
![]() раз, для обратной реакции увеличение
скорости составит
раз, для обратной реакции увеличение
скорости составит![]() раз, выполняется условие
раз, выполняется условие![]() и
равновесие сдвигается по направлению
прямой реакции, т.е. вправо ().
и
равновесие сдвигается по направлению
прямой реакции, т.е. вправо ().
Ответ: Равновесие в системе смещается вправо.
Используя принцип Ле-Шателье для обратимых процессов, можно предсказать, как надо изменить условия, чтобы повысить выход продуктов реакции, или наоборот, прекратить их образование.



