
Химический состав растительной клетки
Вещества
Неорганические: вода – до 85%, минеральные вещества – 1,5%.
Органические: белки – 10%, углеводы – 40%, липиды – 2%, нуклеиновые к-ты (ДНК,
РНК) – 1—1,5%, витамины, вещества вторичного происхождения
(алкалоиды, гликозиды, эфирные масла и др.).
Белки: строение, свойства, функции
Белки – высокомолекулярные природные полимеры, построенные из остатков аминокислот, соединенных амидной (пептидной) связью —СО—NH—. Каждый белок характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией). В состав природных белков входят 20 аминокислот и два амида (аспарагин и глутамин).
Классификация аминокислот основана на природе специфического радикала R:
Алифатические: глицин, аланин, валин, лейцин, изолейцин. R - углеводородной природы придает гидрофобность,
Оксиаминокислоты (серин, треонин). Наличие группы -ОН обусловливает гидрофильность,
Серосодержащие (цистеин, метионин) – участвуют в стабилизации третичной структуры белков. Метионин является источником метильных групп.
Дикарбоновые: глутаминовая, аспарагиновая. Вторая -СООН-группа - придает им высокую химическую активность, гидрофильность, дополнительный отрицательный заряд. При аминировании этих аминокислот образуются амиды глутамин (глн) и аспарагин (асн).
Двухосновные: лизин, аргинин - содержат по 2 аминогруппы, имеют щелочные свойства, положительный заряд;
Ароматические: фенилаланин, тирозин – имеют ароматическую группу, придающую свойство гидрофобности,
Гетероциклические: триптофан (предшественник витамина РР, фитогормона ИУК), гистидин – имеет щелочные свойства;
Иминокислоты (пролин, оксипролин) - обладают высокой гидрофильностью, синтезируются в большом количестве при стрессе («стрессовые» аминокислоты).
Организм человека и животных, в отличие от растений и микроорганизмов не способен синтезировать ряд аминокислот (вал, лей, иле, тре, мет лиз, три, фен, гис, который– необходим для детей), поэтому данные аминокислоты называютнезаменимыми. Высокую биологическую ценность имеют белки семян бобовых культур, особенно фасоли, сои.Биологическая ценность пищевых белковзависит в основном от содержания и соотношения входящих в их состав незаменимых аминокислот. Белки животного происхождения (мяса, рыбы, яиц, молочных продуктов), имеют высокую биологическую ценность. Растительные белки лимитированы по ряду незаменимых аминокислот и прежде всего — по лизину, триптофану, треонину. Много биологически ценного белка содержится в семенах бобовых культур (соя, горох, фасоль и др.).
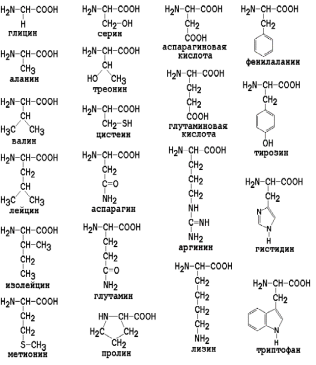
Формулы протеиногенных аминокислот
Уровни структурной организации белков
Первичной структурой белков называется линейная полипептидная цепь из аминокислот, соединенных между собой пептидными связями.
Вторичная структура представляет собой способ укладки полипептидной цепи в упорядоченную структуру благодаря образованию водородных связей между пептидными группами одной цепи или смежными полипептидными цепями. По конфигурации вторичные структуры делятся на спиральные (α-спираль) и слоисто-складчатые.
Третичная - способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные.
Четвертичная (надмолекулярная): Некоторые белки построены из нескольких полипептидных цепей, каждая из которых имеет третичную структуру. Например, гемоглобин (из 4х субъединиц) фермент РБФ-карбоксилаза из 8 субъединиц.
