
1. Количество протомеров в структуре
олигомерных белков
В состав олигомерных белков может входить от двух до нескольких десятков протомеров, хотя наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей (димерные, тетрамерные белки).
Так, фермент гексокиназа содержит в своём составе 2 протомера; белок эритроцитов гемоглобин и фермент лактатдегидрогеназа - 4 протомера; фермент внутренней мембраны митохондрий цитохромоксидаза - 13 протомеров, а глутаминсинтетаза - 12 протомеров (рис. 1-20). Имеются также крупные многофункциональные комплексы, содержащие в своём составе несколько десятков полипептидных цепей, например пируватдегидрогеназный комплекс состоит из 312 протомеров.
Некоторые олигомерные белки содержат идентичные протомеры (например, гексокиназа), другие состоят из разных протомеров. Так, в составе гемоглобина присутствуют 2 ?- и 2 ?-протомера, а в составе лактатдегидроге-назы, имеющей 4 протомера, 2 типа мономеров (Н и М) в разных тканях могут находиться в разных сочетаниях (например, 4Н либо 3Н+1М и т.д.).
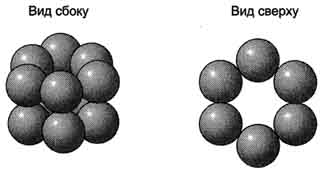
Субъединичная структура глутаминсинтетазы.
В настоящее время еще не разработана стройная система номенклатуры и классификации белков. Традиционная классификация белков по группам, основанная, скорее, на случайных показателях (физико-химические свойства, форма молекул, локализация и происхождение, аминокислотный состав), уже не отвечает полностью возросшему уровню знаний о их структуре и функциях. Из огромного количества природных белков структура и функции расшифрованы для относительно небольшого числа (не более нескольких сотен), и поэтому структура и функции белков пока не могут служить основой для их рациональной классификации. Пожалуй, только для одной группы белков, обладающих способностью катализировать химические реакции, т.е. ферментов, разработана стройная система номенклатуры и классификации, в основу которой положены типы катализируемых химических реакций и химическая природа реагирующих веществ. Однако полностью идентифицированные до сих пор ферменты также составляют незначительную долю белков (ферментов описано более 3000). Тем не менее функциональный принцип, рекомендуемый некоторыми авторами, хотя и не может служить универсальной основой для классификации всех белков, представляет определенный интерес. В соответствии с функциональным принципом различают 12 главных классов белков: 1) каталитически активные белки (ферменты); 2) белки-гормоны (хотя есть и стероидные гормоны); 3) белки-регуляторы активности генома; 4) защитные белки (антитела, белки свертывающей и антисвертывающей систем крови); 5) токсические белки; 6) транспортные белки; 7) мембранные белки; 8) сократительные белки; 9) рецепторные белки; 10) белки-ингибиторы ферментов; 11) белки вирусной оболочки; 12) белки с иными функциями.
Были предприняты также попытки классифицировать белки, исходя из особенностей вторичной и третичной структуры. В соответствии с этим различают α-, β-, α+β- и α/β-белки. α-Белки содержат только α-спирали (не менее 60%), β-белки – только β-структуры (не менее двух антипараллельных цепей), α+β-белки – те и другие структуры в пределах одной полипептидной цепи (пример – молекулы лизоцима), а класс α/β-белков содержит множество α- и β-структур, чередующихся вдоль полипептидной цепи или домена (см. рис. 1.19). Домены создаются объединением и чередованием α-спиралей и β-слоев, между которыми открываются более рыхлые структуры.
Учитывая необходимость для студента-медика основательного знакомства с отдельными группами белков, которые могут служить предметом изучения в его будущей профессиональной деятельности (например, белки крови), приводим старую классификацию белков с краткой характеристикой новых данных о структуре, составе и свойствах отдельных представителей. Согласно этой классификации, обширный класс белковых веществ в зависимости от химического состава делят на простые и сложные белки.
Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты.
Сложные белки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого про-стетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада.
Простые белки в свою очередь делятся на основании некоторых условно выбранных критериев на ряд подгрупп: протамины, гистоны, альбумины, глобулины, проламины, глютелины и др. Классификация сложных белков (см. главу 2) основана на химической природе входящего в их состав небелкового компонента. В соответствии с этим различают фосфопротеины (содержат фосфорную кислоту), хромопротеины (в состав их входят пигменты), нуклеопротеины (содержат нуклеиновые кислоты), гликопротеины (содержат углеводы), липопротеины (содержат липиды) и металлопротеины (содержат металлы).
Протеины (от греч. protos — первый, главный), простые белки, белки, построенные только из a-аминокислот, соединённых пептидной связью. По растворимости в воде и солевых растворах различают 7 групп белков, относящихся к П.: альбумины, глобулины, глутелины, гистоны, проламины, протамины, склеропротеины. К П. относятся и протеолитические ферменты: пепсин, трипсин, химотрипсин, папаин и др.
Протеиды, сложные белки; состоят из простого белка — протеина и компонента небелковой природы, называется простетической группой. В зависимости от характера простетической группы П. подразделяют на гликопротеиды, липопротеиды, нуклеопротеиды, хромопротеиды, фосфопротеиды. К П. относятся многие белки-ферменты. Простетическая группа присоединена к молекуле простого белка ковалентными или нековалентными связями; отрыв простетической группы приводит к снижению устойчивости (лабилизации) белкового компонента, иногда к его денатурации. П. играют важную роль в жизнедеятельности организма: они участвуют во многих узловых реакциях процесса обмена веществ и энергии, являются структурными компонентами клеток и тканей.
В6
Нуклеи́новые кисло́ты (от лат. nucleus — ядро) — высокомолекулярные органические соединения, биополимеры (полинуклеотиды), образованные остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации.
ДНК и РНК
В зависимости от того, какой моносахарид содержится в структурном звене полинуклеотида - рибоза или 2-дезоксирибоза, различают
рибонуклеиновые кислоты (РНК) и
дезоксирибонуклеиновые кислоты (ДНК).
В главную (сахарофосфатную) цепь РНК входят остатки рибозы, а в ДНК – 2-дезоксирибозы.
Нуклеотидные звенья макромолекул ДНК могут содержать аденин, гуанин, цитозин и тимин. Состав РНК отличается тем, что вместо тимина присутствует урацил.
Молекулярная масса ДНК достигает десятков миллионов а.е.м. Это самые длинные из известных макромолекул. Значительно меньше молекулярная масса РНК (от нескольких сотен до десятков тысяч). ДНК содержатся в основном в ядрах клеток, РНК – в рибосомах и протоплазме клеток.
При описании строения нуклеиновых кислот учитывают различные уровни организации макромолекул: первичную и вторичную структуру.
Первичная структура нуклеиновых кислот – это нуклеотидный состав и определенная последовательность нуклеотидных звеньев в полимерной цепи.
Под вторичной структурой нуклеиновых кислот понимают пространственно упорядоченные формы полинуклеотидных цепей.
Вторичная структура ДНК представляет собой две параллельные неразветвленные полинуклеотидные цепи, закрученные вокруг общей оси в двойную спираль.
Такая пространственная структура удерживается множеством водородных связей, образуемых азотистыми основаниями, направленными внутрь спирали.
Водородные связи возникают между пуриновым основанием одной цепи и пиримидиновым основанием другой цепи. Эти основания составляют комплементарные пары (от лат. complementum - дополнение).
Образование водородных связей между комплементарными парами оснований обусловлено их пространственным соответствием. Пиримидиновое основание комплементарно пуриновому основанию:

Водородные связи между другими парами оснований не позволяют им разместиться в структуре двойной спирали. Таким образом,
ТИМИН (Т) комплементарен АДЕНИНУ (А),
ЦИТОЗИН (Ц) комплементарен ГУАНИНУ (Г).
Комплементарность оснований определяет комплементарность цепей в молекулах ДНК.
Комплементарность полинуклеотидных цепей служит химической основой главной функции ДНК – хранения и передачи наследственных признаков.
Способность ДНК не только хранить, но и использовать генетическую информацию определяется следующими ее свойствами:
молекулы ДНК способны к репликации (удвоению), т.е. могут обеспечить возможность синтеза других молекул ДНК, идентичных исходным, поскольку последовательность оснований в одной из цепей двойной спирали контролирует их расположение в другой цепи (см. рисунок [113 Кб] или flash-иллюстрацию [101 Кб]).
молекулы ДНК могут направлять совершенно точным и определенным образом синтез белков, специфичных для организмов данного вида.
Вторичная структура РНК. В отличие от ДНК, молекулы РНК состоят из одной полинуклеотидной цепи и не имеют строго определенной пространственной формы (вторичная структура РНК зависит от их биологических функций).
Основная роль РНК – непосредственное участие в биосинтезе белка. Известны три вида клеточных РНК, которые отличаются по местоположению в клетке, составу, размерам и свойствам, определяющим их специфическую роль в образовании белковых макромолекул:
информационные (матричные) РНК передают закодированную в ДНК информацию о структуре белка от ядра клетки к рибосомам, где и осуществляется синтез белка;
транспортные РНК собирают аминокислоты в цитоплазме клетки и переносят их в рибосому; молекулы РНК этого типа "узнают" по соответствующим участкам цепи информационной РНК, какие аминокислоты должны участвовать в синтезе белка;
рибосомные РНК обеспечивают синтез белка определенного строения, считывая информацию с информационной (матричной) РНК.
Двойная спираль
В зависимости от концентрации ионов и нуклеотидного состава молекулы, двойная спираль ДНК в живых организмах существует в разных формах. На рисунке представлены формы A, B и Z (слева направо)
Полимер ДНК обладает довольно сложной структурой. Нуклеотиды соединены между собой ковалентно в длинные полинуклеотидные цепи. Эти цепи в подавляющем большинстве случаев (кроме некоторых вирусов, обладающих одноцепочечными ДНК-геномами) попарно объединяются при помощи водородных связей в структуру, получившую название двойной спирали[3][7]. Остов каждой из цепей состоит из чередующихся фосфатов и сахаров[11]. Фосфатные группы формируют фосфодиэфирные связи между третьим и пятым атомами углерода соседних молекул дезоксирибозы в результате взаимодействия между 3'-гидроксильной (3'—ОН) группой одной молекулы дезоксирибозы и 5'-фосфатной группой (5'—РО3) другой. Асимметричные концы цепи ДНК называются 3' (три прим) и 5' (пять прим). Полярность цепи играет важную роль при синтезе ДНК (удлинение цепи возможно только путём присоединения новых нуклеотидов к свободному 3'-концу).
Как уже было сказано выше, у подавляющего большинства живых организмов ДНК состоит не из одной, а из двух полинуклеотидных цепей. Эти две длинные цепи закручены одна вокруг другой в виде двойной спирали, стабилизированной водородными связями, образующимися между обращёнными друг к другу азотистыми основаниями входящих в неё цепей. В природе эта спираль, чаще всего, правозакрученная. Направления от 3'-конца к 5'-концу в двух цепях, из которых состоит молекула ДНК, противоположны (цепи «антипараллельны» друг другу).
Ширина двойной спирали составляет от 22 до 24 Å, или 2,2 — 2,4 нм, длина каждого нуклеотида 3,3 Å (0,33 нм)[12]. Подобно тому, как в винтовой лестнице сбоку можно увидеть ступеньки, на двойной спирали ДНК в промежутках между фосфатным остовом молекулы можно видеть рёбра оснований, кольца которых расположены в плоскости, перпендикулярной по отношению к продольной оси макромолекулы.
В двойной спирали различают малую (12 Å) и большую (22 Å) бороздки[13]. Белки, например, факторы транскрипции, которые присоединяются к определённым последовательностям в двухцепочечной ДНК, обычно взаимодействуют с краями оснований в большой бороздке, где те более доступны
Функции ДНК
В молекуле ДНК с помощью биологического кода зашифрована последовательность аминокислот в пептидах. Каждая аминокислота кодируется сочетанием трех нуклеотидов, в этом случае образуется 64 триплета, из которых 61 кодируют аминокислоты, а 3 являются бессмысленными и выполняют функцию знаков препинания (АТТ, АЦТ, АТЦ). Шифрование одной аминокислоты несколькими триплетами получило название как вырожденность триплетного кода. Важными свойствами генетического кода является его специфичность (каждый триплет способен кодировать только одну аминокислоту), универсальность (свидетельствует о единстве происхождения всего живого на Земле) и неперекрываемость кодонов при считывании.
ДНК выполняет следующие функции:
ü хранение наследственной информации происходит с помощью гистонов. Молекула ДНК сворачивается, образуя вначале нуклеосому, а после гетерохроматин, из которого состоят хромосомы;
ü передача наследственного материала происходит путем репликации ДНК;
ü реализация наследственной информации в процессе синтеза белка.
В7
Ферме́нты или энзи́мы (от лат. fermentum, греч. ζύμη, ἔνζυμον — закваска) — обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу). Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы — повышают, ингибиторы — понижают). Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
В природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. Если константа диссоциации сложного фермента настолько мала, что в растворе все полипептидные цепи оказываются связанными со своими кофакторами и не разделяются при выделении и очистке, то такой фермент получает название холофермента (холоэнзим), а кофактор – простетической группы, рассматривающейся как интегральная часть молекулы фермента. Полипептидную часть фермента принято называть апоферментом.
В литературе до сих пор употребляются и другие наименования компонентов сложных ферментов, в частности «фермент-протеид», «белковый компонент» (апофермент), «кофермент» (коэнзим) и «простетическая группа». Под коферментом часто подразумевают дополнительную группу, легко отделяемую от апофермента при диссоциации. Предполагают, что простетическая группа может быть связана с белком ковалентными и неко-валентными связями. Так, в молекуле ацетилкоэнзим-А-карбоксилазы кофактор биотин ковалентно связан с апоферментом посредством амидной связи (см. главу 7). С другой стороны, химические связи между кофакторами и пептидными цепями могут быть относительно слабыми (например, водородные связи, электростатические взаимодействия и др.). В таких случаях при выделении ферментов наблюдается полная диссоциация обеих частей, и изолированый белковый компонент оказывается лишенным ферментативной активности, пока не будет добавлен извне недостающий кофактор. Именно к подобным изолированным низкомолекулярным органическим веществам применим термин «кофермент», типичными представителями которых являются витамины В1, В2, В6, РР, содержащие кофер-менты. Известно также, что и простетические группы, и коферменты активно включаются в химические реакции, выполняя функции промежу-тоных переносчиков электронов, атомов водорода или различных функциональных групп (например, аминных, ацетильных, карбоксильных). В подобных случаях кофермент рассматривают в качестве второго субстрата, или косубстрата.
Роль кофермента (Ко) в качестве переносчика, например, атомов водорода может быть представлена в виде схемы, где SH – субстрат, КоЕ – хо-лофермент, А – акцептор протона:

Субстрат подвергается окислению, отдавая электроны и протоны, а КоЕ – восстановлению, принимая электроны и протоны. В следующей полуреакции восстановленный КоЕН может отдавать электроны и протоны на какой-либо другой промежуточный переносчик электронов и протонов или на конечный акцептор (см. главу 9).
Коэнзим, кофактор, простетическая группа – двусмысленный биохимический жаргон. До сих пор продолжается терминологический спор, поскольку часто определения «коэнзим», «кофактор» и «простетическая группа» рассматриваются через призму их роли в реакциях энзиматического (ферментативного) катализа. Следует, однако, считаться с тем неоспоримым фактом, что во многих случаях небелковые органические молекулы, как и ионы металлов, абсолютно необходимы белковому компоненту при выполнении определенной биологической функции, не имеющей отношения к биокатализу. Несомненно, имеют значение также тип и характер связи небелкового компонента с молекулой белка. Поэтому очевидно, что кофактором может служить любой фактор, абсолютно необходимый для выполнения белком его каталитической или любой другой биологической роли. С другой стороны, коферментом может быть любой небелковый фактор, который непосредственно вовлечен в реакцию энзиматического катализа. Кофактор, который непосредственно не участвует в акте катализа, не является коэнзимом. В то же время простетическую группу (ковалентно связанный небелковый компонент, необходимый для определенной функции) можно назвать коферментом, если она непосредственно участвует в энзиматической реакции. Простетическая группа, которая не вовлечена в акт катализа, но функционально является существенным как для фермента, так и для некаталитического белка, может быть названа кофактором. И наконец, кофактор и кофермент, непрочно связанные (или слабо связанные) с ферментом или белком, тем не менее не классифицируются в качестве простетических групп.
Многие двухвалентные металлы (Mg2+, Мn2+, Са2+), как будет показано далее, также выполняют роль кофакторов, хотя они не относятся ни к коферментам, ни к простетическим группам. Известны примеры, когда ионы металлов прочно связаны с белковой молекулой, выполняя функции простетической группы. В частности, очищенный фермент, катализирующий окисление аскорбиновой кислоты (витамин С) в дезоксиаскорбиновую кислоту, содержит 8 атомов меди на одну молекулу; все они настолько прочно связаны с белковой молекулой, что даже не обмениваются с ионообменными смолами и не отделяются методом диализа. Более того, с помощью метода электронного парамагнитного резонанса показано участие ионов меди в промежуточном переносе электронов. Интересно отметить, что свободные ионы меди также наделены каталитической активностью при окислении аскорбиновой кислоты, однако эта активность повышается во многие тысячи раз, если ионы меди соединяются с апофер-ментом в единый комплекс – холофермент.
Данные о важнейших коферментах и простетических группах ферментов, включая их наименования и структуру, химическую природу витамина, входящего в их состав, и характер выполняемой биохимической функции в метаболизме, детально рассмотрены в главах 7 и 9–13.
Получены доказательства кофакторной функции в ферментативных реакциях и ряда других биологически активных соединений, не относящихся к витаминам: HS-глутатиона, АТФ, липоевой кислоты, производных ну-клеозидов (уридинфосфат, цитидинфосфат, фосфоаденозинфосфосульфат), порфиринсодержащих веществ и др. Сюда же могут быть отнесены тРНК, которые в составе ферментов аминоацил-тРНК-синтетаз принимают активное участие в транспорте аминокислот в рибосоме, где осуществляется синтез белка (см. главу 14).
Следует отметить одну отличительную особенность двухкомпонентных ферментов: ни кофактор отдельно (включая большинство коферментов), ни сам по себе апофермент каталитической активностью не наделены, и только их объединение в одно целое, протекающее не хаотично, а в соответствии с программой их структурной организации, обеспечивает быстрое протекание химической реакции.
По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Классификация была предложена Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3.4.23.1. Первое число грубо описывает механизм реакции, катализируемой ферментом:
КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа
КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ.
КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза
КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов.
КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата.
КФ 6: Лигазы (Синтазы, Синтетазы), катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза
Будучи катализаторами, ферменты ускоряют как прямую, так и обратную реакции, поэтому, например, лиазы способны катализировать и обратную реакцию — присоединение по двойным связям.
В8
Витамины - это группа низкомолекулярных веществ различной химической природы, обладающих выраженной биологической активностью и необходимых для роста, развития и размножения организма.
Жирорастворимые витамины
А (ретинол) антиксерофтальмический
D (кальциферолы) антирахитический
E (токоферолы) антистерильный
К (нафтохинолы) антигеморрагический
Водорастворимые витамины
B1 (тиамин) антиневритный
B2 (рибофлавин) антидерматитный
B3 (пантотеновая кислота) антидерматитный
B6 (пиридоксин, пиридоксаль, пиридоксамин) антидерматитный
B9 (фолиевая кислота; фолацин) антианемический
B12 (цианкобаламин) антианемический
PP (никотиновая кислота; ниацин) антипеллагрический
C (аскорбиновая кислота) антицинготный
H (биотин) антидерматитный
ВитаминыВитамин Суточная потребность Препараты Источники Биохимические функции Авитаминоз, гиповитаминоз Гипервитаминоз, побочные эффекты, острые отравления
Водорастворимые витамины
В1 1,5 - 2 мг, для с/силовых нагрузок - 5,0 мг, на выносливость - 10,0 мг тиамина бромид, тиамина хлорид, фосфотиамин, кокарбоксилаза отруби семян, хлебных злаков, риса, горох, дрожжи Тиаминпирофосфат (ТПФ) - кофермент декарбоксилаз, транскетолазы. Участвует в окислительном декарбоксилировании пировиноградной кислоты, ?-кетоглутаровой. Снижает содержание сахара в крови, ликвидирует метаболический ацидоз, активирует инсулин. Увеличивает синтез АТФ, НАДФН, белков, липидов;
Кокарбоксилаза - оказывает кардиотоническое действие, увеличивает просвет коронаров, усиливает сократимость миокарда, восстанавливает функции нервов (снижение накопления продуктов углеводного обмена), улучшает проведение в нервно-мышечном синапсе, нормализует функции ЦНС, в т.ч. памяти, оказывает наркотический эффект, усиливает секрецию и моторику желудочно-кишечного тракта. нарушение углеводного, а потом и др. обменов, накопление пировиноградной и молочной кислоты. Накопление метаболита - оксикетоглутарата, обладающего кардиотоксическим действием, приводит к смерти у детей;
поражение нервной системы (полиневриты, мышечная слабость, нарушение чувствительности, нарушение памяти, восприятия). Развитие заболевания Бери-бери, энцефалопатии, пеллагры;
нарушение деятельности сердечно-сосудистой системы (сердечная недостаточность с тахикардией, дилятацией сердца, отеками, нарушением ритма);
нарушение функционирования желудочно-кишечного тракта (ЖКТ) (диспепсия, атония кишечника, потеря аппетита). иногда аллергические реакции (зуд, крапивница, ангионевротический отек);
при быстром внутривенном введении возможно угнетение ЦНС, мышечная слабость, артериальная гипотония;
нельзя сочетать с пенициллином, аскорбиновой кислотой, АТФ, В6, В12.
В2 2 - 4 мг, для с/силовых нагрузок - 2,5 мг, на выносливость - 5,0 мг рибофлавин, рибофлавина мононуклеотид, флавинат печень, почки, яйца, молочные продукты, дрожжи, зерновые злаки, рыба усиливает синтез АТФ, белка, эритропоэтина в почках, гемоглобина, сохраняет восстановленные формы фолиевой кислоты;
участвует в окислительно-восстановительных реакциях;
повышает неспецифическую резистентность организма;
обеспечивает нормальное функционирование светопреломляющих сред глаза, темновую адаптацию, регенерацию эпителия;
увеличивает количество желудочного сока, желчи;
повышает возбудимость ЦНС;
нормализует гомеостаз всех видов обмена, в том числе железа и порфирина, жизнедеятельность кишечной палочки задержка физического развития у детей, поражение ЦНС (депрессия, ипохондрия, истерия, гипоманиакальное состояние);
снижение секреции желудочного сока, подавление ферментов кишечника;
дисфункция капилляров (расширение, нарушение кровотока), жжение подошв, анемия;
глоссит ("кардинальский" язык), поражение кожи у носа и ушей
светобоязнь, слезотечение. нет
В3 10 - 12 мг кальция пантотенат, пантенол, .дексопантенол дрожжи, печень, яйца, икра рыб, зерновые, молоко, мясо, синтезируется микрофлорой кишечника входит в состав коэнзима А - акцептора и переносчика ацильных остатков, участвует в окислении и биосинтезе жирных кислот;
участвует в окислительном декарбоксилировании кетокислот (пировиноградной и α- кетоглутаровой);
участвует в цикле трикарбоновых кислот, синтезе кортикостероидов, ацетилхолина,нуклеиновых кислот, белков, АТФ, триглицеридов, фосфолипидов, мукополисахаридов, ацетилглюкозаминов. возникает при искусственном вскармливании, применении сульфаниламидов, антибиотиков, химиотерапии, рахите, ревматизме, ревматических пороках сердца;
сопровождается утомляемостью, нарушениями сна, диспепсией, мышечными болями. диспепсия (рвота, тошнота, изжога);
нарушение всасывания калия, глюкозы, витамина Е.
В6 2 - 3 мг, для с/силовых - 25,0 мг, на выносливость - 2,5 мг пиридоксина хлорид, пиридоксальфосфат. дрожжи, зерна злаков, бобовые культуры, бананы, мясо, рыба, печень, почки. пиридоксальфосфат принимает участие в азотистом обмене (трансаминировании, дезаминировании, декарбоксилировании, превращениях триптофана, серусодержащих и оксиаминокислот);
увеличивает транспорт аминокислот через плазматическую мембрану (в т.ч. при всасывании из кишечника);
участвует в образовании в печени ацетилкоэнзима А, пуринов, пиримидинов, гема;
стимулирует обезвреживающую функцию печени. у детей возникают судороги, дерматит;
искусственно вызванный - себорейный дерматит на лице, глоссит, стоматит, судороги. иногда аллергические реакции (кожный зуд);
увеличение кислотности желудочно сока.
В9 (Вс) 0,1 - 0,2 мг, для спортсменов - 4,0 мг кислота фолиевая свежие овощи (салат, шпинат, помидоры, морковь), печень, сыр, яйца, почки. Синтезируется микрофлорой кишечника. является кофактором ферментов, участвующих в синтезе пуринов, пиримидинов (опосредованно), превращении некоторых аминокислот (трансметилирование гистидина, метионина), т.е. в синтезе нуклеиновых кислот и белков;
совместно с витамином В12 принимает участие в сборке гемоглобина. макроцитарная анемия (синтез незрелых эритроцитов, снижение эритропоэза), лейкопения, тромбоцитопения;
глоссит, стоматит, язвенный гастрит, энтерит. нет
В12 0,002 - 0,005 мг, для с/силовых нагрузок - 0,01мг, на выносливость - 0,05 мг цианкобаламин, кобамид говяжья печень и почки, синтезируется микрофлорой кишечника. коферментные формы 5-дезоксиаденозилкобаламин, метилкобаламин переносят метильные группы и водород (синтез метионина, ацетата, дезоксирибонуклеотидов), т.е. оказывают влияние на обмен белков и нуклеиновых кислот;
оказывает положительное влияние на жировой обмен (липотропный эффект). анемия Адиссона-Бирмера, яркокрасный, гладкий, высокочувствительный язык;
атрофия слизистой желудка;
нарушение походки. ]иногда повышение свертываемости крови
РР 15 - 20 мг, для спортсменов - 25,0 мг никотиновая кислота, никотинамид. мясные продукты, печень; в молоке и яйцах не содержится, но там содержится триптофан, который в организме под влиянием микроорганизмов частично превращается в витамин РР является кофакторами НАД и ФАД- дегидрогеназ, участвующих в окислително-восстановительных реакциях;
участвует в синтезе белков, жиров, углеводов, АТФ, активирует микросомальное окисление;
снижает содержание холестерина и жирных кислот в крови;
стимулирует эритропоэз, фибринолитическую систему крови, препятствует агрегации тромбоцитов;
оказывает спазмолитическое действие на желудочно-кишечный тракт, выделительную систему;
стимулирует тормозные процессы (уменьшает истерию, неврозы, психозы) пеллагра, дерматит, глоссит;
белковая дистрофия;
гастрит. никотиновая кислота вызывает сосудистые реакции (покраснение кожи, кожные сыпи, зуд, головокружение, снижение АД);
при длительном применении возможна жировая дистрофия печени.
С 100 - 200 мг, для с/силовых нагрузок - 250,0 мг, на выносливость - 300,0 мг кислота аскорбиновая, галаскорбин, аскорутин, сироп из плодов шиповника овощи, хвоя, шиповник, черная смородина, цитрусовые, киви, мясо морских животных участвует в окислительно-восстановительных реакциях (аскорбиновая кислота - дегидроаскорбиновая кислота - о.- в. система);
изменяет валентность железа и меди (участвует в синтезе гема);
стимулирует синтез гиалуроновой кислоты и хондроитинсульфата, коллагена;
участвует в образовании кортикостероидов и др. стероидных гормонов, синтезе и сохранении от окисления катехоламинов (адреналина);
активирует синтез антител, интерферона, простагландинов, иммуноглобулина Е, фагоцитоз, барьерную функцию слизистых;
препятствует высвобождению гистамина, снижает проницаемость сосудов;
усиливает синтетическую и детоксикационную функцию печени, участвует в синтезе глюкуроновой кислоты;
участвует в метаболизме глюкозы и пировиноградной кислоты в цикле трикарбоновых кислот, стимулирует цитохром 450, цитохром С редуктазу. ломкость сосудов;
авитаминоз (цинга) - утомляемость, сухость кожи, геморрагические высыпания на коже, гингивит с кровотечением из десен, расшатывание и выпадение зубов;
кровоизлияния в мышцы, боли в конечностях;
геморрагический энтероколит, плеврит, гипотония, поражения сердца и печени;
снижение сопротивляемости к инфекциям. повышение возбудимости ЦНС, нарушение сна;
нарушение обмена глюкозы (конкуренция с глюкозой);
длительно и в больших дозах - повреждение островкого аппарата поджелудочной железы и опосредованно (повышение образования кортикостероидов) почек, эакисление мочи, повышение образования оксалатов;
повышение АД, снижение проницаемости сосудов - уменьшение питания тканей, повышение протромбина, уменьшение времени свертывания крови, анемия, лейкоцитоз с лимфопенией;
диспепсия;
прерывание беременности (повышение эстрогенного фона);
усиление аллергических реакций.
Жирорастворимые витамины
А1 - ретинол, А2 - дигидроретинол 1,5 - 2 мг (5 - 6 тыс.МЕ), для спортсменов до 3,0 мг ретинола ацетат (пальмитат), концентрат витамина А, препараты рыбьего жира, масло облепиховое рыбий жир, коровье масло, желток, печень, молоко и молочные продукты, каротиноиды α,β, γ (особенно β) в желтых продуктах нормализует биосинтез кортикостероидов, эстрогенов, гонадотропинов, регулирует активность ферментов;
участвует в о.-в. реакциях, синтезе ферментов, образующих ФАФС, необходимый для синтеза кислых мукополисахаридов для нормального развития хрящевой и костной тканей, сульфоцереброзидов, гепарина, таурина (связывание Са, К, медиаторов для нормального функционирования ЦНС, инактивации эндо- и экзогенных веществ в печени);
регуляция синтеза белков (антител, интерферона, лизоцима и др.), регенерация и дифференцировка клеток кожи и слизистых, предупреждение ороговения;
регуляция синтеза липидов, является природным антиоксидантом;
фоторецепция (входит в состав родопсина палочек, отвечает за цветное зрение)
регулирует деятельность вкусовых, обонятельных, вестибулярных рецепторов, предотвращает тугоухость на фоне невралгических заболеваний и нарушении самого органа слуха;
стимулирует фагоцитоз (повышает проницаемость мембран лизосом лимфоцитов). поражение слизистых (превращение эпителия в многослойный плоский, усиление процессов ороговения)
сухость кожи, папулезная сыпь, шелушение;
снижение секреции слюнных желез;
ксерофтальмия (сухость роговицы глаза);
поражение желудочно-кишечного тракта;
снижение устойчивости к инфекциям, замедление заживления ран. поражение кожи (сухость, пигментация);
выпадение волос, ломкость ногтей, боли в области костей, суставов, остеопороз, гиперкальциемия;
увеличение печени (+накопление липидов), селезенки, почечная недостаточность, обострение желудочно-кишечных заболеваний, панкреатита, диспепсия, нарушение развития плода;
уменьшение свертываемости крови (за счет увеличения количества гепарина) - геморрагии;
острое отравление (более 300 тыс.МЕ ежедневно) - головная боль ( за счет повышения продукции ликвора с повышением внутричерепного давления), сонливость, тошнота, рвота;
явления менингизма - светобоязнь (повышение внутриглазного давления, сдавление сосочка зрительного нерва), у детей - судороги.
Е (α,β,γ,δ - токоферолы) 20 - 30 мг токоферола ацетат, концентрат витамина Е растительные масла регуляция окислительных процессов;
антиоксидант (тормозит окисление полиненасыщенных жирных кислот);
тормозит агрегацию тромбоцитов, предупреждает атеросклероз;
усиливает синтез гема, входящего в состав гемоглобина, миоглобина, каталаз, пероксидаз, цитохромов;
активирует эритропоэз, улучшает клеточное дыхание;
увеличивает синтез белка (коллагена, сократительных белков, белков слизистых, плаценты, ферментов, гормонов, антител, интерферона);
синергист сердечных гликозидов, предупреждает их токсичное действие;
стимулирует синтез гонадотропинов, развитие плаценты, образование хорионического гонадотропина. выраженная дистрофия скелетных мышц и миокарда, изменение щитовидной железы, печени, ЦНС. в терапевтических дозах больше пяти дней - нарушение функции печени
D2 - эргокальциферол, D3 - холекальциферол 2,5 мкг (500 - 1000 МЕ) эргокальциферол, кальцитриол, кальцидевит, дигидротахистерол, рыбий жир, масляный раствор 2500 МЕ в 1 мл, 1 капля - 500 МЕ печень тунца, палтуса, трески, китов, коровье молоко, масло, яйца, икра рыб; D3 синтезируется в коже под влиянием УФО из 7-дегидроХС. повышает проницаемость эпителия кишечника для кальция и фосфора, усиливает синтез щелочной фосфатазы (минерализация в эпифизах), коллагена, регулирует образование белковой стромы, рассасывание костной ткани в диафизах - нормализация минерализации, повышает реабсорбцию кальция, фосфора, натрия, цитратов, аминокислот в проксимальных канальцах почек, снижает синтез паратгормона;
кальцидиол, кальцитриол увеличивают синтез и секрецию ТТГ, регулируют иммунные процессы (тормозят синтез интерлейкина- 2 Т-лимфоцитами, биосинтез гаммаглобулинов, увеличивают синтез интерлейкина-1 моноцитами, фагоцитарную активность);
снижают пролиферацию, усиливают дифференцировку клеток. рахит (нарушение обизвествления костей, деформация позвоночника, грудной клетки, конечностей, задержка появления зубов, гипотония мышц, отставание в общем развитии);
гипертрофия хряща, остеоида, остеомаляция, остеопороз. 1 стадия без токсикоза (угнетение аппетита, раздражительность, потливость, выделение кальция с мочой;
2 стадия- умеренный токсикоз (гиперкальциемия, гиперфосфатемия, гиперцитремия);
3 стадия - тяжелый токсикоз ( упорная рвота, снижение массы тела, пневмония, пиелонефрит, миокардит, панкреатит), патологическая деминерализация костей, отложение кальция в мышцах, почках, сосудах, сердце, легких, кишечнике, их недостаточность, сердечные аритмии.
К1 - филохиноны, нафтохиноны 0,2 - 0,3мг, для спортсменов до 1,0 мг викасол шпинат, капуста, тыква, печень, синтезируется микрофлорой кишечника стимулирует синтез факторов свертывания крови - протромбина, проконвертина и др. в печени
благоприятствует синтезу АТФ, креатинфосфата, ряда ферментов
В 9
Гормо́ны (греч. Ορμόνη) (греч. hormao — возбуждаю, побуждаю) — биологически активные сигнальные химические вещества, выделяемые эндокринными железами непосредственно в организме и оказывающие дистанционное сложное и многогранное воздействие на организм в целом либо на определённые органы и ткани-мишени. Гормоны служат гуморальными (переносимыми с кровью) регуляторами определённых процессов в различных органах и системах.
Гормоны белковой природы
1. Щитовидная железа выделяет гормон тироксин.
2. Крошечные паращитовидные железки, прилегающие с обеих сторон к щитовидной железе, выделяют паратироидный гормон.
3. Поджелудочная железа выделяет инсулин и глюкагон.
4. Надпочечники продуцируют адреналин, а наружные Отделы (корковый слой)— целый набор гормонов — альдостерон, кортикостерон и т. д.
5. Семенники и яичники продуцируют половые гормоны — тестостерон и эстроген.
6. Гипофиз — один из самых маленьких органов человеческого тела, размером с горошину, продуцирует до 25 различных гормонов. Гормоны гипофиза выполняют чрезвычайно важную функцию, регулируя выход из желез и поступление в организм фактически всех других гормонов. Гипофиз является главным регулятором эндокринной системы.
Другой широко распространенный способ классификации гормонов — это группировка не в зависимости от химической природы.
1. Гормоны белковой либо пептидной природы — инсулин, глюкагон и гормоны гипофиза.
2. Стероиды со сложной циклической структурой — гормоны надпочечников.
3. Амины, содержащие бензональные циклы,— тироксин и адреналин.
Гормоны щитовидной железы являются регуляторами энергетического обмена в организме. Если щитовидная железа перестает синтезировать в нормальных количествах гормоны тироксин и трииодтиронин, то это приводит к снижению процессов, связанных с потреблением кислорода п общему замедлению метаболизма. Гормоны щитовидной железы представляют собой содержащую иод аминокислоту, производную тирозина. Тироксин и трииодтиронин отличаются содержанием иода в бензольных кольцах
В 10
Обмен веществ
Обмен веществ, или метаболизм, — лежащий в основе жизни закономерный порядок превращения веществ и энергии в живых системах, направленный на их сохранение и самовоспроизведение; совокупность всех химических реакций, протекающих в организме. Ф. Энгельс, определяя жизнь, указывал, что её важнейшим свойством является постоянный О. в. с окружающей внешней природой, с прекращением которого прекращается и жизнь. Т. о., О. в. — существеннейший и непременный признак жизни.
Все без исключения органы и ткани организмов находятся в состоянии непрерывного химического взаимодействия с др. органами и тканями, а также с окружающей организм внешней средой. С помощью метода изотопных индикаторов установлено, что интенсивный О. в. происходит в любой живой клетке.
С пищей в организм поступают из внешней среды разнообразные вещества. В организме эти вещества подвергаются изменениям (метаболизируются), в результате чего они частично превращаются в вещества самого организма. В этом состоит процесс ассимиляции. В тесном взаимодействии с ассимиляцией протекает обратный процесс — диссимиляция. Вещества живого организма не остаются неизменными, а более или менее быстро расщепляются с выделением энергии; их замещают вновь ассимилированные соединения, а возникшие при разложении продукты распада выводятся из организма. Химические процессы, протекающие в живых клетках, характеризуются высокой степенью упорядоченности: реакции распада и синтеза определённым образом организованы во времени и пространстве, согласованы между собой и образуют целостную, тончайше отрегулированную систему, сложившуюся в результате длительной эволюции. Теснейшая взаимосвязь между процессами ассимиляции и диссимиляции проявляется в том, что последняя является не только источником энергии в организмах, но также источником исходных продуктов для синтетических реакций.
В основе характерного для О. в. порядка явлений лежит согласованность скоростей отдельных химических реакций, которая зависит от каталитического действия специфических белков — ферментов. Почти любое вещество, для того чтобы участвовать в О. в., должно вступить во взаимодействие с ферментом. При этом оно будет изменяться с большой скоростью в совершенно определённом направлении. Каждая ферментативная реакция является отдельным звеном в цепи тех превращений (метаболических путей), которые в совокупности составляют О. в. Каталитическая активность ферментов изменяется в очень широких пределах и находится под контролем сложной и тонкой системы регуляций, обеспечивающих организму оптимальные условия жизнедеятельности при меняющихся условиях внешней среды. Т. о., закономерный порядок химических превращений зависит от состава и активности ферментного аппарата, настраивающегося в зависимости от потребностей организма. Для познания О. в. существенно изучение как порядка отдельных химических превращений, так и тех непосредственных причин, которые определяют этот порядок. О. в. складывался при самом возникновении жизни на Земле, поэтому в его основе лежит единый для всех организмов нашей планеты биохимический план. Однако в процессе развития живой материи изменения и совершенствование О. в. шли неодинаковыми путями у разных представителей животного и растительного мира. Поэтому организмы, принадлежащие к различным систематическим группам и стоящие на разных ступенях исторического развития, наряду с принципиальным сходством в основном порядке химических превращений, имеют существенные и характерные отличия. Эволюция живой природы сопровождалась изменениями структур и свойств биополимеров, а также энергетических механизмов, систем регуляции и координации О. в.
