
В1. Введение в биохимию
Биохимия – это наука, изучающая химический состав живых организмов и химические процессы в них. Это относительно молодая наука, возникшая во второй половине XIX века. Открытия в области энзимологии, молекулярной генетики, биоэнергетики выдвинули биохимию в ряд фундаментальных дисциплин и сделали мощным оружием в решении многих проблем биологии, медицины, животноводства и растениеводства. Биохимия объединяет все науки о живом, помогает познать как протекают в живых организмах физические и химические процессы, как действуют лекарственные препараты. Зная состав различных органов и тканей и их количественное изменение, можно поставить диагноз, знать правильно ли назначено лечение, следить за проводимой терапией, поставить прогноз заболеванию. Т.о., биохимия дает врачу сведения, длагодаря которым можно сознательно разбираться в химизме процессов, протекающих в больном и здоровом организме. Она позволяет управлять этими процессами, рационально использовать химиотерапию.
От биохимии отпочковались другие науки – молекулярная генетика, генная хирургия и инженерия, молекулярная биология и т.д.
В основе биохимической методологии лежит фракционирование, анализ, изучение структуры и свойств отдельных компонентов живого вещества
Предмет и задачи биохимии. Место биохимии среди других биологических дисциплин. Объекты биохимического исследования. Важнейшие характерные черты живой материи: обмен веществом, энергией и информацией с окружающей средой; способность к самовоспроизводству; специализация и интеграция функций отдельных частей живого организма; саморегуляция процессов; приспособляемость к изменению условий существования. Базисная роль физико-химических процессов на молекулярном уровне организации для существования живой материи. Разделы биологической химии: статическая биохимия, динамическая биохимия, функциональная биохимия. Общее понятие о видах биологических функций природных соединений.
Исторический очерк возникновения и развития биохимии. Химия природных соединений и физиологическая химия. Принципы редукционизма, холизма и интегратизма в биохимических исследованиях. Вычленение из биохимии новых дисциплин: молекулярной биологии, биоорганической и бионеорганической химии, биотехнологии и генетической инженерии и др. Возникновение комплекса дисциплин физико-химической биологии. Биохимия и современная медицина. Молекулярная медицина.
Методы, используемые в биологической химии. Аналитические методы. Особенности применения методов аналитической химии в биохимических исследованиях. Иммунохимия. Методы выделения и очистки биомолекул. Методы изучения физико-химических свойств биомолекул. Методы установления химического и пространственного строения биомолекул (структурная биохимия).
Основные разделы биохимии
Все эти вопросы взаимосвязаны, но для ответа на каждый из них требуются особые подходы и методы. В соответствии с этим биохимию делят на несколько разделов.
Раздел, изучающий химический состав живых организмов и свойства химических соединений, выделенных из живых тканей, называется статической биохимией.
Все многообразие химических реакций в организме, их взаимосвязь и регуляция, а также сопряженные с ними превращения энергии в процессах жизнедеятельности изучаются динамической биохимией.
Биохимические процессы, лежащие в основе жизнедеятельности отдельных тканей и органов и проявления их специфической функции, рассматриваются различными разделами функциональной биохимии.
Специальным разделом функциональной биохимии является биохимия спорта, которая подробно изучает химический состав и процессы обмена веществ в мышечной ткани, а также ряд специальных вопросов биохимические основы построения спортивной тренировки, обеспечение энергией мышечной работы различной мощности и продолжительности, особенности протекания биохимических процессов при занятиях физическими упражнениями у людей разного возраста и т. п. Биохимический контроль в спорте позволяет выявить влияние на организм человека и отдельных тренировочных упражнений, и всей системы тренировки в целом. Он дает возможность оценить по объективным показателям уровень тренированности спортсменов, скорость восстановительных процессов после работы, выбрать в соответствии с решаемой спортивно-педагогической задачей наилучшую продолжительность тренировочной работы и отдыха. Зная закономерности протекания биохимических процессов в организме, можно регулировать его функциональное состояние с помощью специально подобранной диеты, ускорять процессы восстановления после выполнения напряженной работы, подбирать в ходе тренировки такие упражнения, которые приводят к усилению конкретных биохимических процессов, лежащих в основе проявления различных двигательных качеств спортсменов: быстроты, выносливости, силы и т. п.
Химический состав живых организмов
Химический состав живых организмов отличается большим разнообразием. Изучая его, нужно учитывать несколько важных особенностей живых организмов. Общее количество живого вещества на планете оценивается цифрами 1013 -1014 тонн. В состав живых организмов входит 60 химических элементов. По концентрации их можно разделить на макроэлементы (содержатся в количествах более 0,001%): С, Н, О, N, S, К, Р, Са, Мg, С1, Nа, Fе, микроэлементы (составляют 0,001 -0,000001%): Zп, Си, В, Мо, Мп, Со и др. и ультрамикроэлементы (менее 0,000001%)- Нg, Аи, Аg и др. Если сравнить химический состав живых и неживых тел, можно заметить, что основу живых организмов составляет небольшое количество легких элементов, тогда как в неживой природе преобладают тяжелые Легкие элементы оказались более пригодными для построения живых тел, так как они образуют газообразные, жидкие или твердые, но хорошо растворимые в воде соединения, что очень важно для организма, так как обеспечивает высокую скорость химических реакций в нем. Атомы легких элементов невелики по размерам, их соединения образуют компактные, достаточно устойчивые к внешним воздействиям, легко проходящие через клеточные мембраны молекулы. Свойства этих атомов настолько многообразны, что из них можно построить почти все необходимые клетке вещества. Лишь когда возникает потребность в молекулах с какими-нибудь уникальными свойствами, используются атомы тяжелых элементов.
В 2
Под свойствами воды понимают совокупность биохимических, органолептических, физико-химических, физических, химических и других свойств воды. Многие свойства воды аномальны, это вызвано особенностями строения молекулы воды. Молекула воды обладает угловым строением, ядра которого образуют равнобедренный треугольник. В основании этого треугольника находятся два протона, а вершиной является ядро атома кислорода.
Вода (Н2О) – это окись водорода, она является наиболее важным и распространенным веществом, в природе не существует чистой воды, в ней обязательно содержатся какие-либо примеси, чистая вода не имеет вкуса и запаха, прозрачна, ее получают в процессе перегонки, после этого она называется дистиллированной.
При переходе воды из твердого состояния в жидкое ее плотность не уменьшается, а возрастает, также плотность воды увеличивается при ее нагреве от 0 до +4°С, максимальную плотность вода имеет при +4°С, и только при последующем ее нагревании плотность уменьшается.
При +4°С градусах плотность воды превышает плотность льда, благодаря чему охлаждаясь сверху вода опускается на дно лишь до тех пор, пока ее температура не достигнет +4°С, вследствие чего лед остается на поверхности водоемов, что делает возможным жизнь под слоем льда водной флоры и фауны.
Данные свойства воды связаны с существующими в ней водородными связями, связывающими между собой молекулы, как в жидком, так и в твердом состоянии.
Еще одним свойством воды является то, что она обладает высокой теплоемкостью (4,1868 кДж/кг), это объясняет, почему в ночное время и при переходе от лета к зиме вода остывает медленно, а днем или во время перехода от зимы к лету также медленно нагревается. Благодаря этому свойству вода является регулятором температуры на Земле.
Вода обладает большой удельной теплоемкостью и является хорошим теплоносителем.
Среди всех жидкостей вода имеет самое высокое поверхностное натяжение, исключение составляет только ртуть. Дистиллированная вода не проводит электрический ток, так как она слабый электролит и диссоциирует в малой степени.
Однако вода способна стать хорошим проводником при условии растворения в ней даже малого количества ионных веществ.
По массе в состав воды входит 88,81% кислорода и 11,19% водорода, вода кипит при температуре +100°С, а замерзает при 0°С, она плохой проводник для электричества и теплоты, но хороший растворитель.
Вода является растворителем необходимым для протекания биохимических реакций, она хорошо растворяет ионные и многие ковалентные соединения. Своими способностями к растворению многих веществ вода обязана полярности своих молекул (при растворении ионных веществ молекулы воды ориентируются вокруг ионов).
Тяжелой водой (D2О) называется та вода, в состав которой входит изотоп водорода дейтерий, химические реакции с такой водой протекают медленнее, чем с обычной.
Физические свойства Н2О D2О
Температура кипения (°С) 100 101,4
Температура кристаллизации (°С) 0 3,8
Плотность при 20°С (г/см3) 0,9982 1,1050
Молекулярная масса 18 20
Физические свойства воды аномальны, вода является единственным веществом на Земле, существующим в жидком, твердом и газообразном состояниях.
ДИСПЕРСНЫЕ СИСТЕМЫ, гетерог. системы из двух или большего числа фаз с сильно развитой пов-стъю раздела между ними. Обычно одна из фаз образует непрерывную дисперсионную среду, в объеме к-рой распределена дисперсная фаза (или неск. дисперсных фаз) в виде мелких кристаллов, твердых аморфных частиц, капель или пузырьков. Д. с. могут иметь и более сложное строение, напр., представлять собой двухфазное образование, каждая из фаз к-рого, будучи непрерывной, проникает в объем др. фазы. К таким системам относятся твердые тела, пронизанные разветвленной системой каналов-пор, заполненных газом или жидкостью, нек-рые микрогетерогенные полимерные композиции и др. Нередки случаи, когда дисперсионная среда "вырождается" до тончайших слоев (пленок), разделяющих частицы дисперсной фазы.
Основные типы дисперсных систем. По дисперсности, т. е. размеру частиц дисперсной фазы или отношению общей площади межфазной пов-сти к объему (или массе) дисперсной фазы (уд. поверхности), Д. с. условно делят на грубодисперсные и тонко(высоко)дисперсные. Последние, по традиции, наз. коллоидно-дисперсными или просто коллоидными системами. В грубодисперсных системах частицы имеют размеры от 1 мкм и выше (уд. пов-сть не более 1 м2/г), в коллоидных - от 1 нм до 1 мкм (уд. пов-сть достигает сотен м2/г). Дисперсность оценивают по усредненному показателю (среднему размеру частиц, уд. пов-сти) или дисперсному составу (см. Дисперсионный анализ). Тонкопористые тела характеризуют пористостью -понятием, аналогичным дисперсности. В свободнодисперсных системах сцепление между частицами дисперсной фазы отсутствует, каждая частица кинетически независима и при достаточно малых размерах участвует в интенсивном броуновском движении. Для структурированных (связнодисперсных) систем характерно наличие неупорядоченной пространств. сетки (каркаса), образованной частицами дисперсной фазы (см. Структурообразование в дисперсных системах). Особую группу составляют высококонцентрированные Д. с., в к-рых частицы находятся в "стесненных" условиях как, напр., в периодич. коллоидных структурах. Мех. св-ва свободнодисперсных систем определяются гл. обр. св-вами дисперсионной среды, а связнодисперсных систем - также св-вами и числом контактов между частицами дисперсной фазы (см. Реология). По агрегатному состоянию дисперсионной среды и дисперсной фазы выделяют след. осн. виды Д. с.: 1) аэродисперсные (газодисперсные) системы с газовой дисперсионной средой: аэрозоли (дымы, пыли, туманы), порошки, волокнистые материалы типа войлока. 2) Системы с жидкой дисперсионной средой; дисперсная фаза м. б. твердой (грубодисперсные суспензии и пасты, высокодисперсные золи и гели), жидкой (грубодисперсные эмульсии, высокодисперсные микроэмульсии и латексы) или газовой (грубодисперсные газовые эмульсии и пены). 3) Системы с твердой дисперсионной средой: стеклообразные или кристаллич. тела с включениями мелких твердых частиц, капель жидкости или пузырьков газа, напр., рубиновые стекла, минералы типа опала, разнообразные микропористые материалы. Отдельные группы Д. с. составляют мн. металлич. сплавы, горные породы, сложные композиционные и др. многофазные системы. Лиофильные и лиофобные Д. с. с жидкой дисперсионной средой различаются в зависимости от того, насколько близки или различны по своим св-вам дисперсная фаза и дисперсионная среда (см. Лиофильность и лиофобность). В лиофильных Д. с. межмолекулярные взаимод. по обе стороны разделяющей фазы пов-сти различаются незначительно, поэтому уд. своб. поверхностная энергия (для жидкости - поверхностное натяжение) чрезвычайно мала (обычно сотые доли мДж/м2), межфазная граница (поверхностный слой) м. б. размыта и по толщине нередко соизмерима с размером частиц дисперсной фазы. Лиофильные Д. с. термодинамически равновесны, они всегда высокодисперсны, образуются самопроизвольно и при сохранении условий их возникновения могут существовать сколь угодно долго. Типичные лиофильные Д. с. - микроэмульсии, нек-рые полимер-полимерные смеси, мицеллярные системы ПАВ, Д. с. с жидкокристаллич. дисперсными фазами. К лиофильным Д. с. часто относят также набухающие и самопроизвольно диспергирующиеся в водной среде минералы группы монтмориллонита, напр., бентонитовые глины. Следует отметить, что в прошлом "лиофильными коллоидами" наз. р-ры полимеров, т. е. принципиально гомог. системы. Однако в совр. терминологии понятие "коллоид" относится только к микрогетерогенным системам; по отношению к гомогенным (однофазным) системам его не употребляют. В лиофобных Д. с. межмолекулярное взаимод. в дисперсионной среде и в дисперсной фазе существенно различно; уд. своб. поверхностная энергия (поверхностное натяжение) велика - от неск. единиц до неск. сотен (и тысяч) мДж/м2; граница фаз выражена достаточно четко. Лиофобные Д. с. термодинамически неравновесны; большой избыток своб. поверхностной энергии обусловливает протекание в них процессов перехода в более энергетически выгодное состояние. В изотермич. условиях возможна коагуляция -сближение и объединение частиц, сохраняющих первоначальные форму и размеры, в плотные агрегаты, а также укрупнение первичных частиц вследствие коалесценции -слияния капель или пузырьков газа, собирательной рекристаллизации (в случае кристаллич. дисперсной фазы) или изотермич. перегонки (мол. переноса) в-ва дисперсной фазы от мелких частиц к крупным (в случае Д. с. с жидкой дисперсионной средой - последний процесс наз. переконденсацией). Нестабилизованные и, следовательно, неустойчивые лиофобные Д. с. непрерывно изменяют свой дисперсный состав в сторону укрупнения частиц вплоть до полного расслоения на макрофазы. Однако стабилизованные лиофобные Д. с. могут сохранять дисперсность в течение длит. времени.
Образование дисперсных систем. Возможно двумя путями: диспергационным и конденсационным. Диспергирование макрофаз с образованием лиофильных Д. с. происходит самопроизвольно - для этого достаточно энергии теплового движения. Такой процесс осуществляется при значениях поверхностного натяжения s ниже нек-рого критич. значения sкр = bkТ/d2, где d - размер частиц дисперсной фазы, Т - абс. т-ра, k - постоянная Больцмана, b - безразмерный коэф., принимающий значения примерно 10-30. Образование лиофобных Д. с. путем диспергирования стабильной макрофазы требует значительных энергетич. затрат, определяемых суммарной площадью пов-сти частиц дисперсной фазы. В реальных условиях на образование пов-сти при измельчении твердых тел или при распылении и эмульгировании жидкостей приходится лишь небольшая часть (доли процента) подводимой к системе энергии; остальное расходуется на побочные процессы и рассеивается в окружающем пространстве (см. Диспергирование). Конденсационный путь образования Д. с. связан с зарождением новой фазы (или новых фаз) в пересыщенной метастабильной исходной фазе - будущей дисперсионной среде. Для возникновения высокодисперсной системы необходимо, чтобы число зародышей новой фазы было достаточно большим, а скорость их роста не слишком велика. Кроме того, требуется наличие факторов, ограничивающих возможности чрезмерного разрастания и сцепления частиц дисперсной фазы. Переход первоначально стабильной гомог. системы в метастабилъное состояние может произойти в результате изменения термодинамич. параметров состояния (давления, т-ры, состава). Так образуются, напр., природные и искусственные аэрозоли (туман - из переохлажденных водяных паров, дымы - из парогазовых смесей, выделяемых при неполном сгорании топлива), нек-рые полимерные системы - из р-ров при ухудшении "термодинамич. качества" р-рителя, органозоли металлов путем конденсации паров металла совместно с парами орг. жидкости или при пропускании первых через слой орг. жидкости, коллоидно-дисперсные поликристаллич. тела (металлич. сплавы, нек-рые виды горных пород и искусств. неорг. материалов). Возможно также образование Д. с. в результате хим. р-ции в гомог. среде, если продукт р-ции при данных условиях находится в агрегатном состоянии, отличном от "материнской" фазы, или практически не растворяется в ней. Примерами подобных систем могут служить аэрозоли с твердыми частицами NH4Cl (образуются при взаимод. газообразных NH3 и НСl), аэрозоли с капелъно-жидкими частицами H2SO4 (при взаимод. SO3 и водяного пара). В природе и технол. процессах часто образуются гидрозоли разного состава при гидролизе солей и др. соед., неустойчивых к действию воды. Окислит.-восстановит. р-ции используют для получения золей Аu и Ag, разложение Na2S2O3 разб. серной или соляной к-той - для получения гидрозоля элементарной серы. Хим. или термохим. разложения карбонатов, орг. порофоров (порообразователей, вспенивающих агентов) и др. соед. с выделением газообразных в-в в первоначально жидких средах лежит в основе пром. произ-ва мн. пеноматериалов.
Устойчивость дисперсных систем характеризуется постоянством дисперсности (распределения частиц по размерам) и концентрации дисперсной фазы (числом частиц в единице объема). Наиб. сложна в теоретич. аспекте и важна в практич. отношении проблема устойчивости аэрозолей и жидких лиофобных Д. с. Различают седиментационную устойчивость и устойчивость к коагуляции (агрегативную устойчивость). Седиментационно устойчивы коллоидные системы с газовой и жидкой дисперсионной средой, в к-рых броуновское движение частиц препятствует оседанию; грубодисперсные системы с одинаковой плотностью составляющих их фаз; системы, скоростью седиментации в к-рых можно пренебречь из-за высокой вязкости среды. В агрегативно устойчивых Д. с. непосредств. контакты между частицами не возникают, частицы сохраняют свою индивидуальность. При нарушении агрегативной устойчивости Д. с. частицы, сближаясь в процессе броуновского движения, соединяются необратимо или скорость агрегации становится значительно больше скорости дезагрегации. Между твердыми частицами возникают непосредственные точечные ("атомные") контакты, к-рые затем могут превратиться в фазовые (когезионные) контакты, а соприкосновение капель и пузырьков сопровождается их коалесценцией и быстрым сокращением суммарной площади межфазной пов-сти. Для таких систем потеря агрегативной устойчивости означает также потерю седимeнтационной устойчивости. В агрегативно устойчивых системах дисперсный состав может изменяться вследствие изотермич. перегонки - мол. переноса в-ва дисперсной фазы от мелких частиц к более крупным. Этот процесс обусловлен зависимостью давления насыщенного пара (или концентрации насыщенного р-ра) от кривизны пов-сти раздела фаз (см. Капиллярные явления). Агрегативная устойчивость и длительное существование лиофобных Д. с. с сохранением их св-в обеспечивается стабилизацией. Для высокодисперсных систем с жидкой дисперсионной средой используют введение в-в - стабилизаторов (электролитов, ПАВ, полимеров). В теории устойчивости Дерягина-Ландау-Фервея-Овербека (теории ДЛФО) осн. роль отводится ионно-электростатич. фактору стабилизации. Стабилизация обеспечивается электростатич. отталкиванием диффузных частей двойного электрич. слоя, к-рый образуется при адсорбции ионов электролита на пов-сти частиц. При нек-ром расстоянии между частицами отталкивание диффузных слоев обусловливает наличие минимума на потенц. кривой (дальний, или вторичный, минимум; см. рис.). Хотя этот минимум относительно неглубок, он может препятствовать дальнейшему сближению частиц, притягиваемых силами межмолекулярного взаимодействия. Ближний, или первичный, минимум соответствует прочному сцеплению частиц, при к-ром энергии теплового движения недостаточно для их разъединения. Сближаясь на расстояние, отвечающее этому минимуму, частицы объединяются в агрегаты, образование к-рых ведет к потере системой агрегативной устойчивости. При этом устойчивость системы к коагуляции определяется высотой энергетич. барьера.
Зависимость энергии взаимодействия Е между частицами от расстояния R: 1 и 2 - ближний и дальний минимумы соответственно.
При введении в Д. с. в качестве стабилизатора ПАВ фактором стабилизации м. б. "термодинамич. упругость" пленок среды, разделяющей частицы. Стабилизация обеспечивается тем, что при сближении частиц, напр., капель или газовых пузырей, происходит растяжение и утоньшение разделяющей их прослойки, содержащей ПАВ, и, как следствие, нарушение адсорбц. равновесия. Восстановление этого равновесия и приводит к повышению устойчивости прослойки среды, разделяющей частицы. Гидродинамич. сопротивление вытеснению жидкой дисперсионной среды из прослойки между сближающимися частицами - один из кинетич. факторов стабилизации Д. с. Он особенно эффективен в системах с высоковязкой дисперсионной средой, а при застекловывании последней делает систему неограниченно устойчивой к агрегации частиц и коалесценции. Структурно-мех. фактор стабилизации, по П. А. Ребиндеру, возникает при образовании на межфазной границе полимолекулярных защитных слоев из мицеллообразующих ПАВ, высокомолекулярных соед., а иногда и тонких сплошных или дискретных фазовых пленок. Межфазный защитный слой должен обладать способностью сопротивляться деформациям и разрушению, достаточной подвижностью для "залечивания" возникших в нем дефектов и, что особенно важно, быть лиофилизованным с внеш. стороны, обращенной в сторону дисперсионной среды. Если защитный слой недостаточно лиофилен, он, предохраняя частицы от коалесценции, не сможет предотвратить коагуляции. Структурно-мех. барьер является, по существу, комплексным фактором стабилизации, к-рый включает термодинамич., кинетич. и структурные составляющие. Он универсален и способен обеспечить высокую агрегативную устойчивость любых Д.с. с жидкой дисперсионной средой, в т. ч. высококонцентрированных, наиб. важных в практич. отношении. Осн. св-ва Д. с. определяются поверхностными явлениями: адсорбцией, образованием двойного электрического слоя и обусловленных им электрокинетических явлений, контактными взаимодействиями частиц дисперсной фазы. Размер частиц определяет оптич. (светорассеяние и др.) и молекулярно-кинетич. св-ва (диффузия, термофорез, осмос и др.). Д. с. повсеместно распространены в природе. Это - горные породы, грунты, почвы, атм. и гидросферные осадки, растит. и животные ткани. Д. с. широко используют в технол. процессах; в виде Д. с. выпускается большинство пром. продуктов и предметов бытового потребления. Высокодисперсные техн. материалы (наполненные пластики, дисперсноупрочненные композиц. материалы) отличаются чрезвычайно большой прочностью. На высокоразвитых пов-стях интенсивно протекают гетерог. и гетерог.-каталитич. хим. процессы. Учение о Д. с. и поверхностных явлениях в них составляет сущность коллоидной химии. Самостоят. раздел коллоидной химии - физико-химическая механика - изучаeт закономерности структурообразования и мех. св-ва структурированных Д. с. и материалов в их связи с физ.-хим. явлениями на межфазных границах.
Диссоциация воды
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде (ниже под диссоциацией подразумевается электролитическая диссоциация - распад на ионы):
H2O ↔ H+ + OH-
Примерно на 556 000 000 не диссоциированных молекул воды диссоциирует только 1 молекула, однако это 60 000 000 000 диссоциированных молекул в 1мм3. Диссоциация обратима, то есть ионы H+ и OH- могут снова образовать молекулу воды. В итоге наступает динамическое равновесие при котором количество распавшихся молекул равно количеству образовавшихся из H+ и OH- ионов. Другими словами скорости обоих процессов будут равны. Для нашего случая, уравнение скорости химической реакции можно написать так:
υ1 = κ1 • [H2O] (для диссоциации воды)
υ2 = κ2 • [H+] • [HO-] (для обратного процесса)
где υ - скорость реакции; κ - константа скорости реакции (зависящая от природы реагирующих веществ и температуры); [H2O], [H+] и [HO-] - концентрации (моль/л).
В состоянии равновесия υ1 = υ2, следовательно:
κ1 • [H2O] = κ2 • [H+] • [HO-]
Проведем нехитрые математические действия и получим:
κ1/κ2 = [H+] • [HO-]/[H2O]
κ1/κ2 = K
K - константа равновесия, а в нашем случаи константа диссоциации, которая зависит от температуры и природы веществ, и не зависящая от концентраций (также как κ1 и κ2). K для воды 1,8•10-16 при 25 °C (справочная величина).
Вследствие очень малого количества продиссоциированных молекул концентрацию [H2O] можно принять равной общей концентрации воды, а общую концентрацию воды в разбавленных растворах как величину постоянную:
[H2O]=1000(г/л)/18(г/моль)=55,6 моль/л.
Заменяя κ1/κ2 на K и используя величину [H2O], определяем чему равно произведение концентраций [H+] и [HO-], которое называется - ионное произведение воды:
K = [H+] • [HO-]/55,6 моль/л
1,8•10-16 • 55,6 моль/л = [H+] • [HO-]
10-14 = [H+] • [HO-]
Так как, при определенной температуре, величины используемые в расчете ионного произведения воды (K, [H2O]) постоянны, значение ионного произведения воды [H+] • [HO-] так же постоянно. А поскольку при диссоциации молекулы воды образуется одинаковое количество ионов [H+] и [HO-], получается что для чистой воды концентрации [H+] и [HO-] будут равны 10-7 моль/л. Из постоянства ионного произведения воды следует, что если количество ионов H+ становится больше, то количество ионов HO- становится меньше. Например, если к чистой воде добавить сильную кислоту HCl, она как сильный электролит вся продиссоциирует на H+ и Cl-, в результате концентрация ионов H+ резко увеличится, и это приведет к увеличению скорости процесса противоположного диссоциации, так как она зависит от концентраций ионов H+ и OH-:
υ2 = κ2 • [H+] • [HO-]
В ходе ускорившегося процесса противоположного диссоциации, концентрация ионов HO- уменьшится до величины соответствующей новому равновесию, при котором их будет так мало, что скорости диссоциации воды и обратного процесса снова будут равны. Если концентрация получившегося раствора HCl равна 0,1моль/л, равновесная концентрация [HO-] будет равна:
[HO-] = 10-14/0,1 = 10-13 моль/л
При добавлении сильного основания NaOH сдвиг будет в сторону уменьшения концентрации H+. pH воды
Для удобства, концентрации [H+] и [HO-] выражают в виде водородного показателя pH и гидроксильного показателя pOH. pH и pOH - это отрицательные десятичные логарифмы концентраций [H+] и [HO-] (правильнее использовать не концентрацию, а активность) соответственно:
pH = -lg[H+]
pOH = -lg[OH-]
Прологарифмируя уравнение [H+] • [HO-] = 10-14 получим:
lg[H+] + lg[OH-] = -14
-lg[H+] - lg[OH-] = 14
pH + pOH = 14
Получившаяся сумма pH и pOH, также как и произведение, которое логарифмировали, является постоянной и равна 14, так если pH=3 то pOH=11 (pH и pOH могут быть и отрицательными, и если pH=-1 тогда pOH=15).
В зависимости от pH растворы делят на нейтральные, кислые и щелочные. При pH=7 раствор нейтральный, при pH<7 - кислый, при pH>7 - щелочной.
От pH раствора очень сильно зависит протекание многих химических реакций, как на уровне процессов проводящихся в лаборатории и на производстве, так и на уровне реакций в живых организмах, поэтому химикам и биологам с водородным показателем иметь дело приходится очень часто. Все обитатели природных вод и почв адаптированы к определенному водородному показателю, и в случаи его изменения могут погибнуть. Большинство живых организмов могут существовать лишь в средах, близких к нейтральным. Отчасти это связано с тем, что под действием ионов H+ и OH- многие белки, содержащие кислотные или основные группы, изменяют свою конфигурацию и заряд. А в сильнокислой и сильнощелочной средах рвётся пептидная связь, которая соединяет отдельные аминокислотные остатки в длинные белковые цепи. Из-за этого ультраосновные (сильнощелочные) растворы вызывают щелочные ожоги кожи и разрушают шёлк и шерсть, состоящие из белка. Все живые организмы вынуждены поддерживать во внутриклеточных жидкостях определённое значение рН. От величины водородного показателя почвенного раствора зависит урожайность различных культурных растений. На кислых почвах с pH=5-5,5 не развиваются проростки ячменя, но хорошо развивается картофель.
7.7.1. Константа диссоциации
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно к нему можно применить закон действующих масс и записать константу равновесия слабого электролита, она называется константа диссоциации:
АВ = А+ + В‾
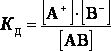
HCN = H+ + CN‾
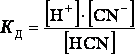
КД зависит от природы электролита и растворителя, от температуры и не зависит от концентрации раствора. Чем выше КД, тем легче электролит диссоциирует.
Многоосновные кислоты диссоциируют ступенчато:
![]() 1-я ступень диссоциации
1-я ступень диссоциации
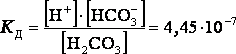
![]() 2-я ступень диссоциации
2-я ступень диссоциации
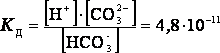
Суммарному равновесию
![]() отвечает суммарная константа диссоциации
КД
отвечает суммарная константа диссоциации
КД
![]()
Аналогично для основания Fe(OH)2
При ступенчатой диссоциации веществ распад по последующей ступени всегда происходит в меньшей степени, чем по предыдущей. Соблюдается неравенство: КД1 > КД2 > КД3…. Это объясняется тем, что энергия необходимая для отрыва иона от нейтральной молекулы меньше, чем при диссоциации по каждой следующей ступени.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксида OH− в воде или в водных растворах, константа автопротолиза воды.
Вывод значения ионного произведения воды
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−
или
H2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
![]()
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8×10−16моль/л. Уравнение (1) можно переписать как:
![]()
Обозначим произведение K·[H2O] = Kв = 1,8×10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Практическое значение ионного произведения воды
Практическое значение ионного произведения воды велико, так как оно позволяет при известной кислотности (щёлочности) любого раствора (то есть при известной концентрации [H+] или [OH−]) найти соответственно концентрации [OH−] или [H+]. Хотя в большинстве случаев для удобства представления пользуются не абсолютными значениями концентраций, а взятыми с обратными знаком их десятичными логарифмами — соответственно, водородным показателем (pH) и гидроксильным показателем (pOH).
Так как Kв — константа, при добавлении к раствору кислоты (ионов H+), концентрация гидроксид-ионов OH− будет падать и наоборот. В нейтральной среде [H+] = [OH−] = моль/л. При концентрации [H+] > 10−7 моль/л (соответственно, концентрации [OH−] < 10−7 моль/л) среда будет кислой; При концентрации [OH−] > 10−7 моль/л (соответственно, концентрации [H+] < 10−7 моль/л) — щелочной.
Буферные системы, буферные растворы, буферные смеси, системы, поддерживающие определённую концентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований.
![]()
Примером Б. с. служит смесь растворов уксусной кислоты CH3COOH и её натриевой соли CH3COONa. Эта соль как сильный электролит диссоциирует практически нацело, т. е. даёт много ионов CH3COO-. При добавлении к Б. с. сильной кислоты, дающей много ионов Н+, эти ионы связываются ионами CH3COO- и образуют слабую (то есть мало диссоциирующую) уксусную кислоту:
Наоборот, при подщелачивании Б. с., то есть при добавлении сильного основания (например, NaOH), ионы OH- связываются Н+-ионами, имеющимися в Б. с. благодаря диссоциации уксусной кислоты; при этом образуется очень слабый электролит — вода:
![]()
По мере расходования Н+-ионов на связывание ионов OH- диссоциируют всё новые и новые молекулы CH3COOH, так что равновесие (1) смещается влево. В результате, как в случае добавления Н+-ионов, так и в случае добавления ОН--ионов, эти ионы связываются и потому кислотность раствора практически не меняется.
Кислотность растворов принято выражать так называемым водородным показателем pH (для нейтральных растворов pH=7, для кислых — pH меньше, а для щелочных — больше 7). Приливание к 1 л чистой воды 100 мл 0,01 молярного раствора HCl (0,01 М) изменяет pH от 7 до 3. Приливание того же раствора к 1 л Б. с. CH3COOH + CH3COONa (0,1 М)изменит pH от 4,7 до 4,65, то есть всего на 0,05. В присутствии 100 мл 0,01 М раствора NaOH в чистой воде pH изменится от 7 до 11, а в указанной Б. с. лишь от 4,7 до 4,8. Кроме рассмотренного, имеются многочисленные другие Б. с. (примеры см. в табл.). Кислотность (и, следовательно, pH) Б. с. зависит от природы компонентов, их концентрации, а для некоторых Б. с. и от температуры. Для каждой Б. с. pH остаётся примерно постоянным лишь до определённого предела, зависящего от концентрации компонентов.
Примеры буферных систем
Компоненты
(концентрации по 0,1 г мол/л)
pH
(при
15—250C)
Уксусная кислота + ацетат натрия, CH3COOH + CH3COONa
4,7
Лимоннокислый натрий
(двузамещеный), C6H6O7Na2
5,0
Борная кислота + бура,
Н3ВО3 + Na2B4O7 10H2O
8,5
Борная кислота + едкий натр,
Н3ВО3 + NaOH.
9,2
Фосфат натрия (двузамещеный)+
+ едкий натр, Na2HPO4 + NaOH
11,5
Б. с. широко используются в аналитической практике и в химическом производстве, так как многие химические реакции идут в нужном направлении и с достаточной скоростью лишь в узких пределах pH. Б. с. имеют важнейшее значение для жизнедеятельности организмов; они определяют постоянство кислотности различных биологических жидкостей (крови, лимфы, межклеточных жидкостей). Основные Б. с. организма животных и человека: бикарбонатная (угольная кислота и её соли), фосфатная (фосфорная кислота и её соли), белки (их буферные свойства определяются наличием основных и кислотных групп). Белки крови (прежде всего гемоглобин, обусловливающий около 75% буферной способности крови) обеспечивают относительную устойчивость pH крови. У человека pH крови равен 7,35—7,47 и сохраняется в этих пределах даже при значительных изменениях питания и др. условий. Чтобы сдвинуть pH крови в щелочную сторону, необходимо добавить к ней в 40—70 раз больше щёлочи, чем к равному объёму чистой воды. Естественные Б. с. в почве играют большую роль в сохранении плодородия полей.
Истинный (молекулярный) раствор - это разновидность растворов в котором размеры частиц растворенного вещества предельно малы и сопоставимы с размером частиц растворителя.
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более составных частей.
Относительные количества компонентов раствора могут изменяться в широких пределах. Наиболее важный вид растворов в жизни человека - жидкие растворы. Такими растворами являются все жидкости организма. С жидкими растворами усваиваются в системе пищеварения питательные вещества.
Всякий раствор состоит из дисперсной фазы, или растворенных веществ и дисперсионной (непрерывной) фазы, или растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде частиц, молекул или ионов.
Растворяемые вещества, в зависимости от их способности проходить через частично проницаемую (полупроницаемую, пергаментную) мембрану, разделяют на два типа: кристаллоиды и коллоиды (1861 г., Т. Грэм, Thomas Graham, 1805 ¸ 1869, британский химик, основатель коллоидной химии).
Растворителем большинства жидких растворов организма является вода. Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор. Например, в случае водного раствора соли растворителем является вода. Если же оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Свойства любого водного раствора зависят от размера частиц растворенного вещества и от их реакции на действие силы тяжести. По этим признакам различают три типа растворов: истинные растворы, коллоидные растворы и суспензии или эмульсии.
В истинных растворах размеры частиц растворенного вещества малы. Они сравнимы с размерами молекул растворителя (воды). Истинный раствор является гомогенной (однородной) системой, практически состоящей из одной фазы. Частицы истинного раствора не разделяются под действием силы тяжести. Истинными растворами организма являются, например, растворы солей, моносахаридов.
Однородность истинных растворов делает их очень сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ тоже указывает на взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения. Непостоянство состава растворов приближает их к механическим смесям, но от последних они резко отличаются своею однородностью. Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором. Насыщенные растворы существуют и применяются сравнительно редко. В большинстве случаев существуют и пользуются ненасыщенные растворы, содержащие меньше растворенного вещества, чем его содержит при данной температуре насыщенный раствор. При этом растворы с низким содержанием растворенного вещества называются разбавленными, с высоким - концентрированными.
Состав раствора, содержание в нем растворенных веществ может выражаться как с помощью безразмерных единиц (долей или процентов), так и через размерные величины - концентрации. Наиболее употребительны следующие величины, выражающие содержание растворенного вещества в растворе: массовая доля, молярная доля, молярная концентрация, моляльная концентрация, эквивалентная, или нормальная концентрация.
Грубодисперсные системы, к которым относятся суспензии, эмульсии, пены и аэрозоли, различающиеся по фазовому составу дисперсной фазы и дисперсионной среды, рассматриваются в одном разделе курса коллоидной химии благодаря общности таких свойств, которые определяются размером частиц дисперсной фазы. Вместе с тем каждая из этих систем обладает и присущими только ей свойствами. В этой связи в данной главе свойства каждого типа систем рассматриваются самостоятельно.
В технологии текстильного производства и в процессах получения химических волокон широко распространено применение грубодисперсных систем. Так суспензии пигментов применяют для колорирования тканей и окрашивания волокон в массе, прямые эмульсии масла в присутствии поверхностно-активных веществ и растворенных полимеров используют в качестве авиваважных препаратов при получении химических волокон и в качестве замасливателей шерсти и некоторых синтетических волокон в процессе получения текстильных материалов. Пенные технологии беления и колорирования текстильных материалов в настоящее время представляются наиболее прогрессивными, так как при этом снижаются затраты энергии, экономятся материалы и резко уменьшаются водопотребление и сброс загрязненных сточных вод. Пенный способ очистки сточных вод от поверхностно-активных и текстильно-вспомогательных веществ позволяет проводить удаление загрязнений без высоких энергетических затрат. Любые вещества в аэрозольном состоянии обладают комплексом таких свойств, которые не присущи им в монолите. Например, многим аэрозолям присуща взрывоопасность. При осуществлении технологических процессов в производстве часто образуются аэрозоли, которые должны быть разрушены, иначе может произойти загрязнение воздушного бассейна.
Все изложенное выше указывает на важность изучения грубодисперсных систем в том курсе коллоидной химии, который предлагается студентам, будущая специальность которых связана с производством химических волокон и текстильных материалов.
Коллоидные растворы
Коллоидными растворами называются гетерогенные дисперсные системы, в которых частицы «растворенного» вещества обладают ультрамикроскопической (коллоидной) степенью дробления. Поперечник частиц дисперсной фазы в этих системах лежит в пределах 1 -100 нм.
Даже иммерсионные микроскопы (разрешающая способность 0,2 нм) не всегда дают возможность визуально обнаружить частицы дисперсной фазы в коллоидных растворах. В то же время поперечник частиц в золях уже настолько велик (больше 7г световой волны), что свет не может свободно проходить через них и подвергается большему или меньшему рассеянию. Благодаря светорассеянию золи характеризуются феноменом Тиндаля и всегда, особенно в отраженном свете, кажутся опалесцирующими, мутноватыми или просто мутными.
В отличие от истинных растворов золи обладают очень малым осмотическим давлением, что является следствием большой относительной массы частиц.
С фармацевтической точки зрения наиболее важным свойством коллоидных растворов является высокая степень их лабильности. Под влиянием часто ничтожных причин, например прибавления незначительного количества электролитов, нагревания, механической обработки, света, повышения температуры, а иногда самопроизвольно без каких-либо видимых причин коллоидные растворы подвергаются разрушению - коагуляции. При коагуляции частицы растворенного вещества укрупняются, золь сильно мутнеет, превращается в суспензию и спустя короткое время выделяет осадок - коагулят. Иногда при коагуляции жидкие золи застывают, превращаясь в прозрачные, более или менее прочные студни - гели. Даже при самом бережном хранении золи имеют ограниченный срок существования, с течением времени подвергаются старению и в конце концов коагулируют или желатинируются.
Как известно, устойчивость коллоидных растворов является следствием взаимодействия трех факторов: сил поверхностной энергии, заряда частиц и степени их лиофильности.
Высокая лабильность и сложность приготовления лиофобных коллоидных растворов чрезвычайно ограничивают возможности их применения в качестве лекарств. В настоящее время практическое применение находят лишь некоторые препараты защищенных коллоидов, обладающих обратимостью и спонтанностью растворения и относительной (как правило, невысокой) устойчивостью, и некоторые коллоидные электролиты.
Диффузия (от лат. diffusio — распространение, растекание), взаимное проникновение соприкасающихся веществ друг в друга вследствие теплового движения частиц вещества. Д. происходит в направлении падения концентрации вещества и ведёт к равномерному распределению вещества по всему занимаемому им объёму (к выравниванию химического потенциала вещества).
Д. имеет место в газах, жидкостях и твёрдых телах, причём диффундировать могут как находящиеся в них частицы посторонних веществ, так и собственные частицы (самодиффузия).
Д. крупных частиц, взвешенных в газе или жидкости (например, частиц дыма или суспензии), осуществляется благодаря их броуновскому движению. В дальнейшем, если специально не оговорено, имеется в виду молекулярная Д.
Наиболее быстро Д. происходит в газах, медленнее в жидкостях, ещё медленнее в твёрдых телах, что обусловлено характером теплового движения частиц в этих средах. Траектория движения каждой частицы газа представляет собой ломаную линию, т.к. при столкновениях частицы меняют направление и скорость своего движения. Неупорядоченность движения приводит к тому, что каждая частица постепенно удаляется от места, где она находилась, причём её смещение по прямой гораздо меньше пути, пройденного по ломаной линии. Поэтому диффузионное проникновение значительно медленнее свободного движения (скорость диффузионного распространения запахов, например, много меньше скорости молекул). Смещение частицы меняется со временем случайным образом, но средний квадрат его `L2 за большое число столкновений растёт пропорционально времени t. Коэффициент пропорциональности D в соотношении: `L2 ~ Dt называется коэффициентом Д. Это соотношение, полученное А. Эйнштейном, справедливо для любых процессов Д. Для простейшего случая самодиффузии в газе коэффициент Д. может быть определён из соотношения D ~`L2/t, применённого к средней длине свободного пробега молекулы `l. Для газа `l =`сt, где `с — средняя скорость движения частиц, t — среднее время между столкновениями. Т. о., D ~ `l2/t ~ `l`c (более точно D = 1/3 `l`c). Коэффициент Д. обратно пропорционален давлению p газа (т.к. `l ~ 1/p); с ростом температуры Т (при постоянном объёме) Д. увеличивается пропорционально Т1/2 (т.к. `с ~ ÖТ). С увеличением молекулярной массы коэффициент Д. уменьшается.
В жидкостях, в соответствии с характером теплового движения молекул, Д. осуществляется перескоками молекул из одного временного положения равновесия в другое. Каждый скачок происходит при сообщении молекуле энергии, достаточной для разрыва её связей с соседними молекулами и перехода в окружение др. молекул (в новое энергетически выгодное положение). В среднем скачок не превышает межмолекулярного расстояния. Диффузионное движение частиц в жидкости можно рассматривать как движение с трением, к нему применимо второе соотношение Эйнштейна: D ~ ukT. Здесь k — Больцмана постоянная, u — подвижность диффундирующих частиц, т. е. коэффициент пропорциональности между скоростью частицы с и движущей силой F при стационарном движении с трением (с = uF). Если частицы сферически симметричны, то u = 1/6phr, где h — коэффициент вязкости жидкости, r — радиус частицы (см. Стокса закон).
Коэффициент Д. в жидкости увеличивается с температурой, что обусловлено "разрыхлением" структуры жидкости при нагреве и соответствующим увеличением числа перескоков в единицу времени.
В твёрдом теле могут действовать несколько механизмов Д.: обмен местами атомов с вакансиями (незанятыми узлами кристаллической решётки), перемещение атомов по междоузлиям, одновременное циклическое перемещение нескольких атомов, прямой обмен местами двух соседних атомов и т.д. Первый механизм преобладает, например, при образовании твёрдых растворов замещения, второй — твёрдых растворов внедрения.
Коэффициент Д. в твёрдых телах крайне чувствителен к дефектам кристаллической решётки, возникшим при нагреве, напряжениях, деформациях и др. воздействиях. Увеличение числа дефектов (главном образом вакансий) облегчает перемещение атомов в твёрдом теле и приводит к росту коэффициента Д. Для коэффициента Д. в твёрдых телах характерна резкая (экспоненциальная) зависимость от температуры. Так, коэффициент Д. цинка в медь при повышении температуры от 20 до 300°С возрастает в 1014 раз.
Для большинства научных и практических задач существенно не диффузионное движение отдельных частиц, а происходящее от него выравнивание концентрации вещества в первоначально неоднородной среде. Из мест с высокой концентрацией уходит больше частиц, чем из мест с низкой концентрацией. Через единичную площадку в неоднородной среде проходит за единицу времени безвозвратный поток вещества в сторону меньшей концентрации — диффузионный поток j. Он равен разности между числами частиц, пересекающих площадку в том и др. направлениях, и потому пропорционален градиенту концентрации ÑС (уменьшению концентрации С на единицу длины). Эта зависимость выражается законом Фика (1855):
j = -DÑC.
Единицами потока j в Международной системе единиц являются 1/м2·сек или кг/м2·сек, градиента концентрации — 1/м4 или кг/м4, откуда единицей коэффициента Д. является м2/сек. Математически закон Фика аналогичен уравнению теплопроводности Фурье. В основе этих явлений лежит единый механизм молекулярного переноса: в 1-м случае переноса массы, во 2-м — энергии (см. Переноса явления).
Д. возникает не только при наличии в среде градиента концентрации (или химического потенциала). Под действием внешнего электрического поля происходит Д. заряженных частиц (электродиффузия), действие поля тяжести или давления вызывает бародиффузию, в неравномерно нагретой среде возникает термодиффузия.
Все экспериментальные методы определения коэффициента Д. содержат два основных момента: приведение в контакт диффундирующих веществ и анализ состава веществ, изменённого Д. Состав (концентрацию продиффундировавшего вещества) определяют химически, оптически (по изменению показателя преломления или поглощения света), масс-спектроскопически, методом меченых атомов и др.
Д. играет важную роль в химической кинетике и технологии. При протекании химической реакции на поверхности катализатора или одного из реагирующих веществ (например, горении угля) Д. может определять скорость подвода др. реагирующих веществ и отвода продуктов реакции, т. е. являться определяющим (лимитирующим) процессом.
Для испарения и конденсации, растворения кристаллов и кристаллизации определяющей оказывается обычно Д. Процесс Д. газов через пористые перегородки или в струю пара используется для изотопов разделения. Д. лежит в основе многочисленных технологических процессов — адсорбции, цементации и др. (см. Диффузионные процессы); широко применяются диффузионная сварка, диффузионная металлизация.
В жидких растворах Д. молекул растворителя через полупроницаемые перегородки (мембраны) приводит к возникновению осмотического давления (см. Осмос), что используется в физико-химическом методе разделения веществ — диализе.
Д. А. Франк-Каменецкий.
Д. в биологических системах. Д. играет важную роль в процессах жизнедеятельности клеток и тканей животных и растений (например, Д. кислорода из лёгких в кровь и из крови в ткани, всасывание продуктов пищеварения из кишечника, поглощение элементов минерального питания клетками корневых волосков, Д. ионов при генерировании биоэлектрических импульсов нервными и мышечными клетками). Различная скорость Д. ионов через клеточные мембраны — один из физических факторов, влияющих на избирательное накопление элементов в клетках организма. Проникновение растворённого вещества в клетку может быть выражено законом Фика, в котором значение коэффициента Д. заменено коэффициентом проницаемости мембраны, а градиент концентрации — разностью концентраций вещества по обе стороны мембраны. Диффузионное проникновение в клетку газов и воды (см. Осмос) также описывается законом Фика; при этом значения разности концентраций заменяются значениями разности давлений газов и осмотических давлений внутри и вне клетки.
Различают простую Д. — свободное перемещение молекул и ионов в направлении градиента их химического (электрохимического) потенциала (так могут перемещаться лишь вещества с малыми размерами молекул, например вода, метиловый спирт); ограниченную Д., когда мембрана клетки заряжена и ограничивает Д. заряженных частиц даже малого размера (например, слабое проникновение в клетку анионов); облегчённую Д. — перенос молекул и ионов, самостоятельно не проникающих или очень слабо проникающих через мембрану, др. молекулами ("переносчиками"); так, по-видимому, проникают в клетку сахара и аминокислоты. Через мембрану, вероятно, могут диффундировать и переносчик, и комплекс переносчика с веществом. Перенос вещества, определяемый градиентом концентрации переносчика, называется обменной Д.; такая Д. отчётливо проявляется в экспериментах с изотопными индикаторами. Различную концентрацию веществ в клетке и окружающей её среде нельзя объяснить только Д. их через мембраны за счёт имеющихся электрохимических и осмотических градиентов. На распределение ионов влияют также процессы, которые могут вызывать перераспределение веществ против их электрохимического градиента с затратой энергии, — так называемый активный транспорт ионов.
Осмос (от греч. ōsmós — толчок, давление), диффузия вещества, обычно растворителя, через полупроницаемую мембрану, разделяющую раствор и чистый растворитель или два раствора различной концентрации. Полупроницаемая мембрана — перегородка, пропускающая малые молекулы растворителя, но непроницаемая для более крупных молекул растворённого вещества. Выравнивание концентраций по обе стороны такой мембраны возможно лишь при односторонней диффузии растворителя. Поэтому всегда идёт от чистого растворителя к раствору или от разбавленного раствора к концентрированному. О., направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить О., т. е. создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению О. — обратной диффузии растворителя (см. Ультрафильтрация). В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, диффузия последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов. Впервые О. наблюдал А. Нолле в 1748, однако исследование этого явления было начато спустя столетие. О. имеет важнейшее значение в биологических процессах (см. Осморегуляция), его широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом "обратного" О. жидкостей.
В 3
В составе клеток всех живых организмов широкое распространение имеют углеводы. Углеводами называют органические соединения, состоящие из углерода, водорода и кислорода. В большинстве углеводов водород и кислород находятся, как правило, в тех же соотношениях, что и в воде (отсюда их название - углеводы). Общая формула таких углеводов Cn(H2O)m. Примером может служить один из самых распространенных углеводов - глюкоза, элементный состав которой С6Н12О6 (рис. 2).
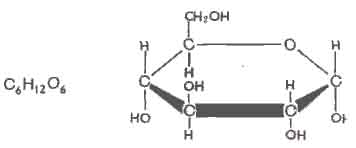
Рис. 2. Строение молекулы глюкозы.
В зависимости от сложности строения все углеводы классифицируются на три основных класса : моносахариды, олигосахариды и полисахариды.
Моносохариды
К моносахаридам относятся простые углеводы, которые при гидролизе не распадаются на более простые молекулы. В зависимости от числа атомов углерода в молекуле моносахариды делятся на триозы (С3Н6О3), тетрозы (С4Н8О4), пентозы (С5Н10О5), гексозы (С6Н12О6) и гептозы (С7Н14О7). Другие моносахариды в природе не встречаются, но могут быть получены синтетически. Моносахариды - белые, кристаллические вещества, сладкие на вкус, легко растворимые в воде.
Наиболее важную роль в организме человека выполняют представители гексоз - глюкоза и фруктоза,пентоз - рибоза и дезоксирибоза и триоз - глицериновый альдегид и диоксиацетон.
К ним относятся
Глюкоза и фруктоза
Это основные энергетические субстраты организма человека. Они имеют одинаковый молекулярный состав (С6Н12О6), но разную структуру молекул, так как различаются функциональными группами. Глюкоза содержит альдегидную группу и относится к альдегидоспиртам (альдозам), а фруктоза содержит в своем составе кетогруппу и относится к кетоспиртам (кетозам).
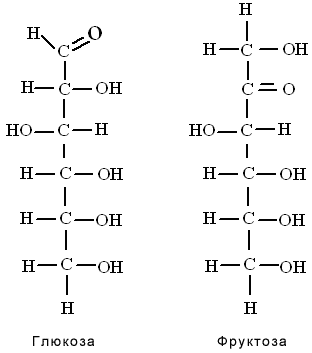
Они являются изомерами по положению карбонильной группы.
Для моносахаридов характерна также пространственная изомерия или стереоизомерия, поскольку они содержат асимметрические атомы углерода , которые связаны с четырьмя различными атомами или группами атомов. Выделяют D - форму и L -форму изомеров моносахаридов. Принадлежность к D - или L - ряду определяется ориентацией Н и ОН - групп при атоме углерода, соседнем с концевым углеродом, содержащим спиртовую (гидроксильную ) группу. Если ОН- группа расположена справа - сахар принадлежит к D - ряду, если ОН- группа слева , то сахар принадлежит к L - ряду.
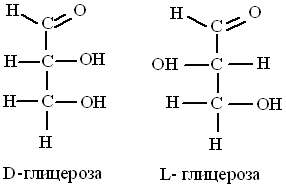
Большинство моносахаридов у млекопитающих имеет D - конфигурацию - именно к ней специфичны ферменты, ответственные за их метаболизм и поэтому, организм человека может усваивать только D-форму моносахаридов.
Циклическая форма фруктозы и глюкозы
В водной среде глюкоза и фруктоза находятся в основном в циклической форме. Циклизация молекулы происходит за счет внутримолекулярного взаимодействия альдегидной группы в молекуле глюкозы и кетогруппы в молекуле фруктозы с одной гидроксильной группой этого же моносахарида.
Рассмотрим в качестве примера образование циклической формы молекулы фруктозы:
На первом этапе происходит разрыв двойной связи между углеродом и кислородом в
карбонильной (кето-)группе, в результате чего у второго атома углерода ( С2) и у атома кислорода появляется по одному неспаренному электрону.
На втором этапе атом водорода со своим электроном отщепляется от гидроксильной группы, принадлежащей пятому атому углерода (С5) начинает взаимодействовать с неспаренным электроном кислорода в карбонильной группе с образованием гидроксильной (спиртовой) группы -ОН.
На третьем этапе происходит образование связи между свободным электроном второго атома углерода (С2) и свободным электроном атома кислорода, связанного с пятым атомом углерода (С5). В результате чего образуется полуацетальная (кольцевая) структура фруктозы за счет взаимодействия карбонильной и спиртовой групп.
Для более удобного изображения циклической формы фруктозы используем правило Хеуорза: атомы водорода и гидроксильные группы, которые располагаются справа от цепочки атомов углерода, пишутся под плоскостью; атомы водорода и гидроксильные группы, которые располагаются слева от цепочки атомов углерода, пишутся над плоскостью:
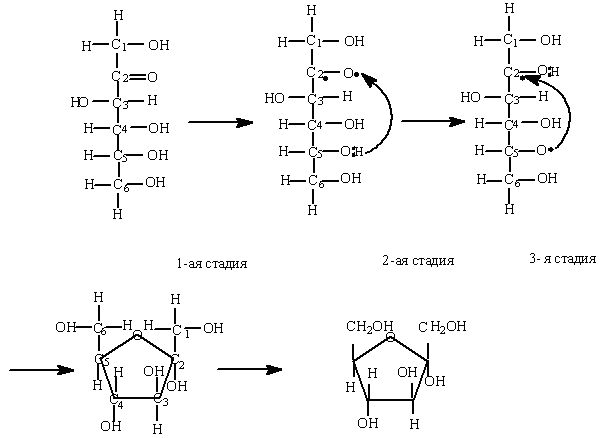
α-D- фруктофураноза
Изображение молекулы фруктозы по правилу Хеуорза.
Аналогично происходит образование циклической формы молекулы глюкозы :
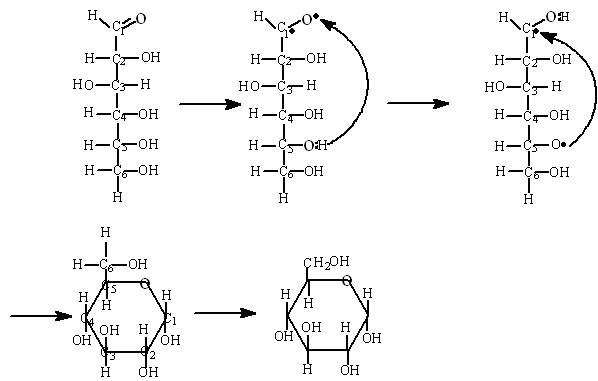
α-D – глюкопираноза
Изображение молекулы глюкозы по правилу Хеуорза.
Кольцевая структура глюкозы является полуацетальной, так как образована в результате взаимодействия альдегидной и спиртовой групп.
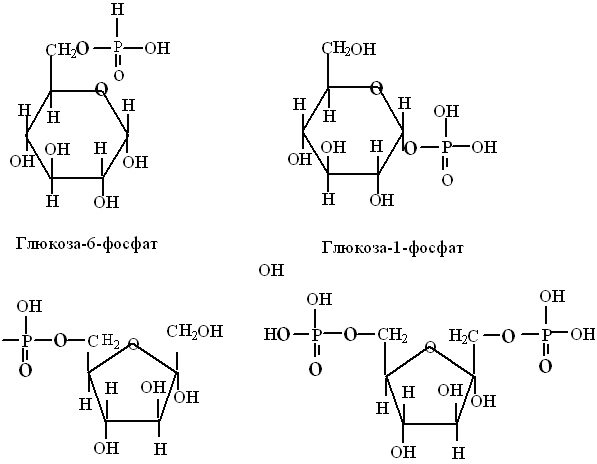
Таким образом, циклические формы моносахаридов приобретают биологически реактивную гидроксильную группу при С1 или С2 атоме углерода, которая называется гликозидным гидроксилом. Она играет важную роль в химических превращениях этих моносахаридов, в частности, участвует в образовании ди- и полисахаридов, фосфорных эфиров, например:
Аминосахара
Из моносахаридов при замещении гидроксильных групп на аминогруппу (-NH2) образуются аминосахара. В организме человека наиболее важными аминосахарами являются глюкозамин и галактозамин:
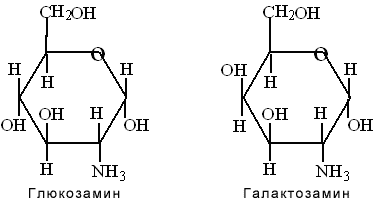
Они входят в состав сложных углеводов мукополисахаридов, которые выполняют защитную и специфическую функции, характерные для слизей, стекловидного тела глаза, синовиальной жидкости суставов, системы свертывания крови и др.
Из глюкозы в процессе ее окисления или восстановления образуются многие функционально важные вещества: аскорбиновая кислота, спирт сорбит, глюконовая, глюкуроновая, сиаловые и другие кислоты.
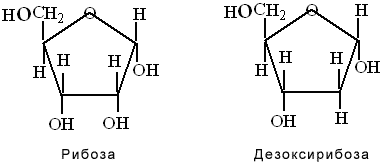
Рибоза и дезоксирибоза
Эти углеводы в свободном виде встречаются редко. Чаще они входят в состав сложных веществ, т.е. используются в организме в пластических процессах. Так, рибоза входит в состав нуклеотидов (АТФ,АДФ,АМФ) и РНК, а также многих коферментов (НАДФ,НАД,ФАД,ФМН,КоА). Дезоксирибоза входит в состав ДНК. В организме рибоза и дезоксирибоза (как и другие пентозы) находятся в циклической форме.
Глицериновый альдегид и диоксиацетон
Они образуются в тканях организма в процессе метаболизма глюкозы и фруктозы. Являясь изомерами, эти триозы способны к взаимопревращению:
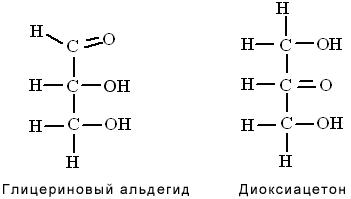
В тканях организма в процессе метаболизма углеводов и жиров образуются фосфорные эфиры глицеринового альдегида и фосфодиоксиацетона. Фосфоглицериновый альдегид является высокоэнергетическим субстратом биологического окисления. В процессе его окисления образуется АТФ, пировиноградная кислота (ПВК) и молочная кислота (лактат).
Моносахариды легко вступают в химические взаимодействия, поэтому редко встречаются в живых организмах в свободном состоянии. Особенно важными для организма производными моносахаридов являются олигосахариды.
Олигосахариды
Это сложные углеводы, построенные из небольшого количества (от 2 до 10) остатков моносахаридов. Если два остатка моносахаридов соединены между собой 1,4 или 1,2-гликозидными связями, то образуются дисахариды. Основными дисахаридами являются сахароза, мальтоза и лактоза.Их молекулярная формула С12Н22О12.
Сахароза - (тростниковый или свекловичный сахар) состоит из остатка глюкозы и фруктозы, соединенных между собой 1,2-гликозидной связью, которая образуется при взаимодействии гидроксильной группы первого атома углерода глюкозы и гидроксильной группы второго атома углерода фруктозы
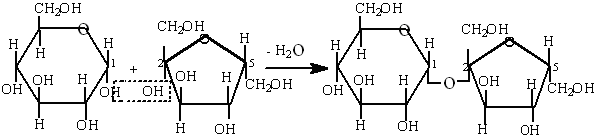
Сахароза является основным компонентом пищевого сахара. В процессе пищеварения под влиянием фермента сахаразы расщепляется на глюкозу и фруктозу.
Мальтоза - (фруктовый сахар) состоит из двух молекул глюкозы, соединенных 1,4-гликозидной связью:

Много мальтозы содержится в солодовых экстрактах злаков, проросших зернах. Она образуется в желудочно-кишечном тракте в процессе гидролиза крахмала или гликогена. При пищеварении распадается на две молекулы глюкозы под воздействием фермента мальтазы.
Лактоза - (молочный сахар) состоит из молекулы глюкозы и галактозы, которые соединены между собой 1,4-гликозидной связью:
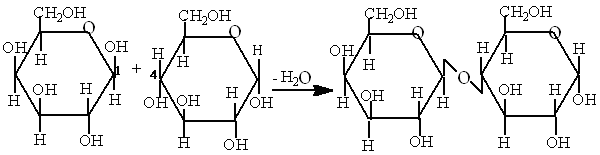
Лактоза синтезируется в молочных железах в период лактации. В системе пищеварения человека лактоза расщепляется под воздействием лактазы на глюкозу и галактозу. Поступление лактозы в организм с пищей способствует развитию молочнокислых бактерий, подавляющих развитие гнилостных процессов. Однако, у людей, имеющих низкую активность фермента лактазы (у большинства взрослого населения Европы, Востока, арабских стран, Индии), развивается интолерантность к молоку.
Рассмотренные дисахариды имеют сладкий вкус Если сладость сахарозы принять за 100, то сладость лактозы составит 16, мальтозы -30, глюкозы -70, фруктозы -170. Кроме того, они обладают и высокой питательной ценностью. Поэтому они не рекомендуются для питания людей, страдающих ожирением и диабетом. Их заменяют искусственными веществами, например сахарином, которые имеют сладкий вкус (сладость сахарина -40000), но не усваиваются организмом.
Большинство углеводов в природе находятся в виде полисахаридов и делятся на две большие группы - гомо- и гетерополисахариды.
Полисахариды
Это углеводы, в которых число моносахаридных остатков превышает десять и может доходить до десятков тысяч. Если сложный углевод состоит из одинаковых моносахаридных остатков, он называется гомосахаридом, если из разных - гетеросахаридом.
Гомополисахариды
Твердые, не обладают сладким вкусом. Основными представителями гомополисахаридов являются крахмал и гликоген.
Крахмал.
Состоит из амилозы и амилопектина, является резервным питательным веществом у растений (крахмальные зерна в клубнях картофеля, в зернах злаковых). Содержание амилозы в крахмале составляет 15-20%, амилопектина 75-85%.В состав амилозы входит порядка 100 - 1000, в состав амилопектина - 600 - 6000 остатков глюкозы.
Гликоген
Животный крахмал.В своем составе содержит от 6000 до 300000 остатков глюкозы. Может откладываться про запас как резервный источник энергии. Наибольшее количество гликогена запасается в клетках печени (7%), в скелетных мышцах (1-3%), в сердце (0,5%).Крахмал и гликоген расщепляются в желудочно-кишечном тракте ферментом амилазой, в клетках животных гликоген расщепляется гликогенфосфорилазой.
Клетчатка (целлюлоза).
Основная составная часть клеточной стенки растений, нерастворимая в воде, состоит из 2000-11000 остатков глюкозы, соединенных бетта-гликозидной связью.В организме играет важную роль в стимуляции перистальтики кишечника.
 Схема
строения цепей крахмала - амилозы (а),
амилопектина (б) и участка молекулы
гликогена (в).
Схема
строения цепей крахмала - амилозы (а),
амилопектина (б) и участка молекулы
гликогена (в).
Гетерополисахариды
Это сложные углеводы, состоящие из двух и более моносахаридов, чаще всего связаны с белками или липидами.
Гиалуроновая кислота.
Линейный полимер, состоит из глюкуроновой кислоты и ацетилглюкозамина. Входит в состав клеточных стенок, синовиальной жидкости, стекловидного тела, обволакивает внутренние органы, является желеобразной бактерицидной смазкой.
Хондроитинсульфаты.
Разветвленные полимеры, состоят из глюкуроновой кислоты и N-ацетилглюкозамина. Служат основными структурными компонентами хрящевой ткани, сухожилий, роговицы глаза; содержатся также в костях и коже.
Асимметрический атом — атом многовалентного элемента (напр., углерода, азота), к которому присоединены неодинаковые атомные группы или атомы других элементов.
В этих соединениях атомы углерода, помеченные звёздочкой, являются асимметрическими.
Асимметрический атом отмечают звёздочкой. Наличие асимметрического атома в молекуле обусловливает её оптическую активность.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ. «Когда молекула смотрится в зеркало» – такое необычное название было у статьи, опубликованной в июньском номере за 1996 год американского журнала, посвященного химическому образованию (Journal of Chemical Education). А на первой странице обложки этого номера был тоже необычный рисунок. На боку добродушно виляющего хвостом пса была изображена структурная формула пеницилламина. Пес смотрел в зеркало, а оттуда на него глядел страшный зверь с оскаленной клыкастой пастью и вставшей дыбом шерстью. На боку зверя была изображена та же самая структурная формула в виде зеркального отображением первой. Почему же фактически одно и то же вещество имеет столь разные обличья? Объясняется это особым свойством некоторых химических соединений, которое тесно связано с их оптической активностью.
В4
ГЛИЦЕРИДЫ (нейтральный жир) - это сложные эфиры трехатомного спирта глицерина и высших жирных кислот. В зависимости от того, сколько молекул высших жирных кислот связалось с молекулой глицерина, бывают моно-, ди-, три-глицериды. Выделяют также простые и смешанные глицериды в зависимости от того одинаковые или разные жирные кислоты присоединяются к глицерину. Это наиболее часто встречающаяся группа жиров, выполняет запасающую, энергетическую функцию. И в животных и в растительных клетках находятся в цитоплазме в виде капель. Особенно много триглицеридов содержится в специализированных клетках соединительной ткани - адипоцитах. У полярных животных триглицериды кроме запасающей функции выполняют еще теплоизоляционную функцию.
Достаточно много триглицеридов содержится в крови, особенно у спортсменов, тренирующих выносливость и покрывающих до 70% их энергозатрат.
Схема образования триглицерида представлена ниже:
Жирные кислоты
Это длинноцепочечные органические кислоты, содержащие одну полярную карбоксильную группу и углеводородный радикал, в состав которого может входить от 3 до 24 атомов углерода. За счет наличия углеводородного радикала большинство жирных кислот не растворимы в воде.
Жирные кислоты являются структурным компонентом нескольких классов липидов. В состав липидов входят насыщенные ( не содержат двойных связей) и ненасыщенные (содержат двойные связи) жирные кислоты, и те и другие состоят, как правило, из четного числа атомов углерода.
Насыщенные жирные кислоты (твердые)
Масляная
С3Н7СООН
СН3-(СН2)2-СООН
Пальмитиновая
С15Н31СООН
СН3-(СН2)14-СООН
Стеариновая
С17Н35СООН
СН3-(СН2)16-СООН
Ненасыщенные (жидкие)
Олеиновая
С17Н33СООН
СН3-(СН2)7-СН=СН-(СН2)7-СООН
Линолевая
С17Н31СООН
СН3-(СН2)4-СН=СН-СН2-СН=СН-(СН2)7-СООН
Линоленовая
С17Н29СООН
СН3-СН2-СН=СН-СН2-СН=СН-СН2-СН=СН- (СН2)7-СООН
Особое значение для организма имеют полиненасыщенные жирные кислоты: линолевая и линоленовая. В организме они не синтезируются и при их отсутствии в пище отмечается нарушение обмена холестерина, дерматит и другие патологии.
К природным жирам относятся оливковое, кукурузное, хлопковое, подсолнечное, сливочное масло, которые содержат жирные кислоты разной длины и степени насыщенности. Чем больше двойных связей в молекулах жирных кислот, тем более жидким будет природный жир (оливковое масло - триолеин), чем меньше двойных связей - тем более твердым (говяжье сало - тристеарин).
Из растительных масел (например, из кукурузного) производят растительные маргарины путем восстановления (насыщения водородом) двойных связей в молекулах жирных кислот.
При взаимодействии двойных связей с кислородом воздуха происходит прогоркание масла (появляется неприятный запах и вкус).
В основе масляных красок лежит льняное масло. Жирные кислоты, входящие в его состав на воздухе подвергаются самоокислению по двойным связям, в результате чего на поверхности картин образуется прочное смолистое покрытие.
Стеарин (фр. stearine), от греч. stear — жир) — органический продукт, получаемый из жиров. Состоит из стеариновой кислоты с примесью пальмитиновой, олеиновой и других насыщенных и ненасыщенных жирных кислот.
Свойства
Стеарин — твердая, полупрозрачная масса, жирная на ощупь, tпл 53—65 °C (в зависимости от сорта), плотность 0,92 г/см3 (20 °C).
Получение
Получают дистилляцией гидролизатов животных жиров (с последующей кристаллизацией и отжимом) или гидрированием ненасыщенных кислот растительных масел.
Применение
Применяют в мыловарении, бумажной, резиновой, текстильной промышленности, для изготовления свечей. Смесь керосина и стеарина используется как смазка при формовочных работах. Как компонент входит в состав воска, использующегося в литейной промышленности.
Липоиды (от греч. lípos — жир и éidos — вид), жироподобные вещества природного происхождения (например, фосфолипиды); термин устарел: как жиры, так и Л. принято обозначать одним термином — липиды.
Фосфолипиды
Фосфолипиды, фосфатиды, сложные липиды, отличительным признаком которых является присутствие в молекулах остатка фосфорной кислоты. В состав Ф. входят также глицерин (или аминоспирт сфингозин), жирные кислоты, альдегиды и азотистые соединения (холин, этаноламин, серин). Важнейшие представители Ф. – глицерофосфатиды [фосфатидилхолин (лецитин), фосфатидилэтаноламин (устаревшее название – кефалин), фосфатидилсерин, фосфатидилинозит, кардиолипин] и фосфосфинголипиды – сфингомиелины. Каждый класс Ф. объединяет множество однотипных молекул, содержащих различные жирные кислоты или альдегиды. При этом ненасыщенные жирные кислоты преимущественно находятся при 2-м углеродном атоме молекулы глицерина (формулы см. в ст. Липиды).
Ф. широко распространены в природе. В качестве основных структурных компонентов они входят в состав клеточных мембран животных, растений и микроорганизмов, определяя их строение и проницаемость, а также активность ряда локализованных в мембранах ферментов. С белками Ф. образуют липопротеиновые комплексы. Различным биологическим мембранам присущ определённый состав Ф. Так, кардиолипин – специфический митохондриальный Ф.; сфингомиелин присутствует в основном в плазматических мембранах. В мембранах микроорганизмов всегда содержится фосфатидилглицерин и редко лецитин (в отличие от клеток животных).
Состав Ф. некоторых органов изменяется при старении и ряде патологических состояний организма (атеросклероз, злокачественные новообразования).
Для разделения и установления строения Ф. используют различные виды хроматографии, химический и ферментативный (с помощью фосфолипаз) гидролиз, физические методы исследования (масс-спектрометрия, ИК-спектрометрия, ядерный магнитный резонанс и др.).
Помимо Ф., известны также фосфонолипиды, в которых атом фосфора связан с азотистым основанием (холином и этаноламином) ковалентной Р-С-связью. Эти соединения обнаружены у ряда моллюсков и бактерий.
Стерины, стеролы, циклические спирты, относящиеся к классу стероидов, широко распространены в живой природе. Большинство С. — оптически-активные кристаллические вещества, растворимые в органических растворителях и нерастворимые в воде. Общим предшественником С. у микроорганизмов, растений и животных служит углеводород сквален, превращающийся в циклический ланостерин (С30Н50О) или в его изомер циклоартенол, из которых затем образуются различные С., содержащие 27—29 атомов углерода. Важнейший С. животных — холестерин, самый распространённый С. грибов, в том числе дрожжей,— эргостерин, а из обширной группы С. растений (фитостеринов)наиболее распространены b-ситостерин и стигмастерин.
У высших животных С. содержатся в нервной ткани, печени, клетках спермы и т.д.: образуя с высшими жирными кислотами сложные эфиры, они служат их переносчиками в организме. В растениях С. находятся в свободном состоянии или в соединении с жирными кислотами (т. н. стериды), углеводами (т. н. фитостеролины) или с теми и другими вместе. С., поступающие с пищей, используются для синтеза гормонов насекомыми. которые не обладают ферментами, необходимыми для первых стадий биосинтеза С. К С. относят гормоны линьки насекомых (см. Экдизон) и антеридиол, индуцирующий половое размножение некоторых низших грибов. Близки к С. витанолиды (ненасыщенные лактоны) и кукурбитацины (ненасыщенные горькие вещества из тыквенных растений), а также сапогенины морских беспозвоночных и входящие в состав ланолина и восков ланостерин и др. тритерпены со стерановым углеродным скелетом (см. Стероиды). Наиболее изученные биохимич. функции С. — превращение холестерина в стероидные гормоны и эргостерина в витамины группы D под действием ультрафиолетового света. С. входят в состав биологических мембран как их структурные компоненты. Доступные С. (холестерин, эргостерин, (b-ситостерин) используются как сырьё для промышленного получения стероидных гормонов и витаминов группы D.
Цереброзиды (гликосфинголипиды) (от лат. cerebrum — мозг) — природные органические соединения из группы сложных липидов. Компоненты клеточных мембран. Впервые были обнаружены в составе мозга (отсюда название).
Цереброзиды образованы остатками аминоспирта сфингозина, жирной кислоты и углевода (галактоза, реже глюкоза). В качестве жирнокислотного компонента в состав цереброзидов чаще всего входят насыщенные, ненасыщенные и окси- кислоты с 24 атомами углерода в цепи.
Галактоцереброзиды обнаруживаются в основном в мембранах клеток мозга, в то время как глюкоцереброзиды присутствуют в мембранах различных клеток (не только нейронов)[1].
В 5
Белки́ (протеи́ны, полипепти́ды[1]) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс.
АМИНОКИСЛОТЫ, органические к-ты, содержащие одну или несколько аминогрупп. В зависимости от природы кислотной ф-ции аминокислоты подразделяют на аминокарбоновые, например H2N(CH2)5COOH, аминосульфоновые, например H2N(CH2)2SO3H, аминофосфоновые, например H2NCH[Р(О)(ОН)2]2, и аминоарсиновые, например H2NC6H4AsO3H2. Согласно правилам ИЮПАК, название аминокислоты производят от названия соответствующей к-ты; взаимное расположение в углеродной цепи карбоксильной и аминной групп обозначают обычно цифрами, в нек-рых случаях - греч. буквами. Однако, как правило, пользуются тривиальными названиями аминокислот.
Структура и физические свойства. По физ. и ряду хим. свойств аминокислоты резко отличаются от соответствующих к-т и оснований (см. табл. 1 и 2). Они лучше раств. в воде, чем в орг. р-рителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие т-ры плавления (часто разложения). Эти св-ва указывают на взаимод. аминных и кислотных групп, вследствие чего аминокислоты в твердом состоянии и в р-ре (в широком интервале рН) находятся в цвиттер-ионной форме. Напр., для глицина кислотно-основное равновесие:

Взаимное влияние групп особенно ярко проявляется у аминокислот, где обе группы находятся в непосредств. близости, а также у о- и n-аминобензойных к-т, где их взаимод. передается через систему сопряженных связей. Благодаря электроноакцепторным св-вам группы —Н3 резко усиливается кислотность карбоксильных групп, напр. рКа глицина 2,34, тогда как уксусной к-ты 4,75,аланина 3,6. Аминогруппа подвергается взаимокомпенсируемому влиянию электроноакцепторной карбонильной группы и электронодонорного отрицательно заряженного атома кислорода, в результате чего, напр., основность аминогрупп аминоуксусной и n-аминобензойной к-т мало отличается от основности соотв. этиламина и анилина. Аминогруппа аминокислот ионизирована в несколько меньшей степени, чем карбоксильная группа, и водный р-р аминокислоты имеет слабокислый характер. Значение рН, при к-ром концентрация катионов аминокислоты равна концентрации анионов, наз. изоэлектрич. точкой (рI). Все аминокислоты в изоэлектрич. точке имеют минимум р-римости (в р-рах к-т и щелочей р-римость возрастает). Вблизи рI р-ры аминокислот обладают миним. буферным действием, а вблизи рК каждой функц. группы-максимальным.
Табл. 1 .- СВОЙСТВА LАМИНОКИСЛОТ
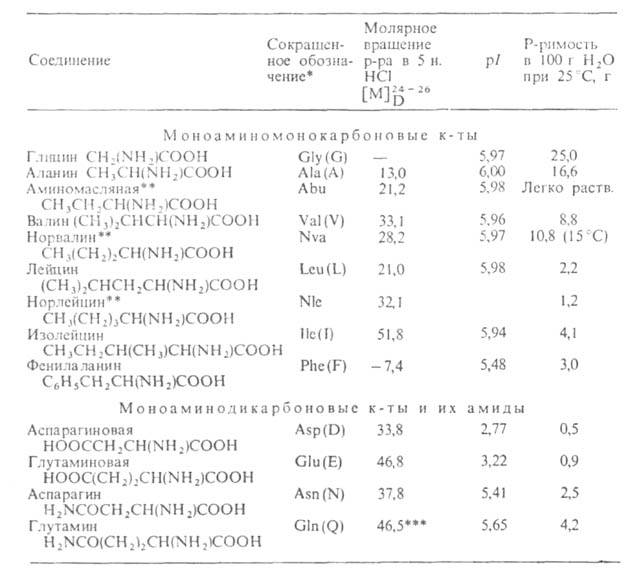
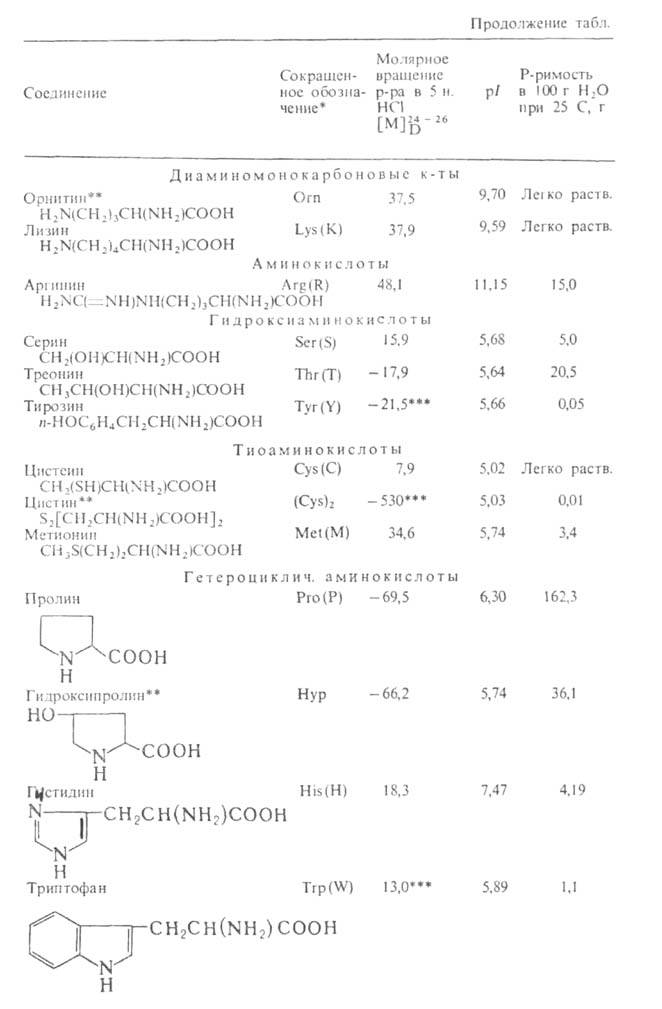
* В скобках дается однобукв. обозначение аминокислот, рекомендуемое ИЮПАК. ** Некодируемые аминокислоты: остальные кодируются генетич. кодом. *** Р-р в 1 н. НС1.
Табл. 2-СВОЙСТВА АМИНОКИСЛОТ

Цвиттер-ионная структура аминокислот подтверждается их большим дипольным моментом (не менее 50*10-30 Кл*м), а также полосой поглощения 1610-1550 см -1 в ИК-спектре твердой аминокислоты или ее р-ра.
Все., кроме аминоуксусной (глицина), имеют асимметрии,углеродный атом и существуют в виде двух энантиомеров. За редким исключением прир.. относятся к L-ряду (S-конфигурация) и имеют след. пространств. строение:
При переходе от нейтральных р-ров к кислым для аминокислот L-ряда увеличивается положит. вращение, для D-ряда-отрицательное. Гидроксипролин, треонин, изолейцин имеют два асимметрич. атома и образуют по две пары диастереомеров. Оптич. активность аминокислот сильно зависит от длины волны поляризованного света (дисперсия оптич. вращения). Как правило, аминокислоты более устойчивы к рацемизации, чем их производные. Повышенной конфигурационной стабильностью отличаются N-бензилоксикарбонильные производные аминокислот.
Расщепление рацематов аминокислот на оптич. антиподы производят затравочной кристаллизацией их солей с арилсулъфокислотами или кристаллизацией диастереомерных солей ацильных производных аминокислот с оптически активными основаниями или солей эфиров аминокислот с оптически активными к-тами. Часто используют энантиоселективный гидролиз ацилами-нокислот ацилазами или гидролиз эфиров аминокислот эстеразами, причем ферменты атакуют в первую очередь L-аминокислоты. Перспективно расщепление рацематов лигандообменной хроматографией. Хроматографию используют также для анализа энантиомерного состава аминокислот.
Химические свойства. Р-ции по карбоксильным группам аминокислот, аминогруппа к-рых защищена ацилированием или солеобразованием, протекают аналогично превращениям карбоновых к-т. Аминокислоты легко образуют соли, сложные эфиры, амиды, гидразиды, азиды, тиоэфиры, галогенангидриды, смешанные ангидриды и т.д. Эфиры аминокислот под действием натрия или магнийорг. соед. превращаются в аминоспирты. При сухой перегонке в присут. Ва(ОН)2 аминокислоты декарбоксилируются.
Р-ции аминогрупп аминокислот аналогичны
превращениям аминов. Аминокислоты
образуют соли с минер, к-тами и пикриновой
к-той, легко ацилируются хлорангидридами
к-т в водно-щелочном р-ре (р-ция Шоттена
- Баумана) и алкилируются алкилгалогенидами.
Метилиодид и диазометан превращают
аминокислоты в бетаины
![]() . С формалином аминокислоты дают
мегилольные или метиленовые производные,
а в присут. муравьиной к-ты или каталитически
активированного Н2-N,N-диметиламинокислоты.
Под действием HNO2 ароматич. аминогруппы
диазотируются, а алифатические замещаются
на гидроксил. При обработке эфиров
аминокислот изоцианатами и изотиоцианатами
образуются производные мочевины и
тиомочевины. При нагр. с содой или при
одноврем. воздействии алкоголята и СО2
аминокислоты дают соли или эфиры
N-карбоксипроизводных аминокислот, а
при использовании CS2-аналогичные
дитиокарбаматы.
. С формалином аминокислоты дают
мегилольные или метиленовые производные,
а в присут. муравьиной к-ты или каталитически
активированного Н2-N,N-диметиламинокислоты.
Под действием HNO2 ароматич. аминогруппы
диазотируются, а алифатические замещаются
на гидроксил. При обработке эфиров
аминокислот изоцианатами и изотиоцианатами
образуются производные мочевины и
тиомочевины. При нагр. с содой или при
одноврем. воздействии алкоголята и СО2
аминокислоты дают соли или эфиры
N-карбоксипроизводных аминокислот, а
при использовании CS2-аналогичные
дитиокарбаматы.
Р-ции с одноврем. участием групп NH2 и
СООН наиб. характерны для
![]() ., к-рые способны образовывать устойчивые
5-членные гетероциклы. С ионами переходных
металлов (Си, Zn, Ni, Co, Pb, Ag, Hg, Cr)
., к-рые способны образовывать устойчивые
5-членные гетероциклы. С ионами переходных
металлов (Си, Zn, Ni, Co, Pb, Ag, Hg, Cr)
![]() .
образуют прочные хелатные комплексы,
что используется в комплексонах и в
комплексообразующих ионообменных
смолах на основе аминокарбоновых и
аминофосфоновых к-т. При взаимод. с
фосгеном
.
образуют прочные хелатные комплексы,
что используется в комплексонах и в
комплексообразующих ионообменных
смолах на основе аминокарбоновых и
аминофосфоновых к-т. При взаимод. с
фосгеном![]() .
превращаются в циклич. ангидриды
N-карбоксиаминокислот (ф-ла I), а при нагр.
с уксусным ангидридом или ацетилхлоридом
- в азлактоны (II); нагревание аминокислот
с мочевиной или обработка изоцианатами
дает гидантоины (III), а при использовании
.
превращаются в циклич. ангидриды
N-карбоксиаминокислот (ф-ла I), а при нагр.
с уксусным ангидридом или ацетилхлоридом
- в азлактоны (II); нагревание аминокислот
с мочевиной или обработка изоцианатами
дает гидантоины (III), а при использовании
![]() .,
и особенно легко их эфиры, при нагр.
превращаются в 2,5-пиперазиндионы, или
дикетопиперазины (V).
.,
и особенно легко их эфиры, при нагр.
превращаются в 2,5-пиперазиндионы, или
дикетопиперазины (V).
![]() .
при нагр. дезаминируются и образуют
.
при нагр. дезаминируются и образуют
![]() - ненасыщенные к-ты
- ненасыщенные к-ты
![]() и
и
![]() .
отщепляют воду и образуют 5- и 6-членные
лактамы.
.
отщепляют воду и образуют 5- и 6-членные
лактамы.
![]() Аминокапроновая
к-та при нагр. образует в осн. полиамид
и лишь частично превращ. в капролактам,
что характерно и для аминокислот с
большим числом метиленовых звеньев
между функц. группами. Бетаины
Аминокапроновая
к-та при нагр. образует в осн. полиамид
и лишь частично превращ. в капролактам,
что характерно и для аминокислот с
большим числом метиленовых звеньев
между функц. группами. Бетаины
![]() .
при нагр. могут обратимо превращ. в эфиры
диметиламинокислот, напр.:
.
при нагр. могут обратимо превращ. в эфиры
диметиламинокислот, напр.:
![]() . При элиминировании триметиламина
оетаины
. При элиминировании триметиламина
оетаины
![]() .
превращ. в ненасыщ. к-ты,
.
превращ. в ненасыщ. к-ты,
![]() и
и
![]() -бетаины-в
циклич. лактоны. При окислении
-бетаины-в
циклич. лактоны. При окислении
![]() образуют
альдегиды с укороченной углеродной
цепочкой. Из-за положит. заряда на
четвертичном атоме N бетаины не образуют
солей со щелочами. По аналогичной причине
аминосульфоновые и аминофосфоновые
к-ты не образуют солей с
к-тами.арилизотиоцианатовтиогидантоины
(IV).
образуют
альдегиды с укороченной углеродной
цепочкой. Из-за положит. заряда на
четвертичном атоме N бетаины не образуют
солей со щелочами. По аналогичной причине
аминосульфоновые и аминофосфоновые
к-ты не образуют солей с
к-тами.арилизотиоцианатовтиогидантоины
(IV).

Анализ. Обычно анализ
![]() .
основан на взаимод. с нингидрином, в
результате к-рого аминокислота
расщепляется до альдегида, СО2 и NH3, a NH3
образует с нингидрином фиолетовый
краситель. Для количеств. определения
измеряют объем выделившегося СО2 или,
чаще, фотометрируют образующийся
краситель. Последний метод используется
в автоматич. хроматографах, позволяющих
разделять на сульфокатионитах и
количественно анализировать сложные
смеси аминокислот и пептидов. Еще более
чувствителен флуоресцентный анализ
продуктов реакции аминокислот с
о-фталевым диальдегидом. Быстро
развивается лигандообменный
хроматографический анализ аминокислот
и пептидов на силикагельных сорбентах
в присутствии ионов меди. Бумажная и
тонкослойная хроматография чаще
используются для качественного анализа.
Измерение объема N2, выделяющегося при
дезаминировании аминокислот азотистой
к-той, а также титрование аминокислот
щелочью в избытке формалина (методы Ван
Слайка и Сёренсена) сохранили лишь
историческое значение.
.
основан на взаимод. с нингидрином, в
результате к-рого аминокислота
расщепляется до альдегида, СО2 и NH3, a NH3
образует с нингидрином фиолетовый
краситель. Для количеств. определения
измеряют объем выделившегося СО2 или,
чаще, фотометрируют образующийся
краситель. Последний метод используется
в автоматич. хроматографах, позволяющих
разделять на сульфокатионитах и
количественно анализировать сложные
смеси аминокислот и пептидов. Еще более
чувствителен флуоресцентный анализ
продуктов реакции аминокислот с
о-фталевым диальдегидом. Быстро
развивается лигандообменный
хроматографический анализ аминокислот
и пептидов на силикагельных сорбентах
в присутствии ионов меди. Бумажная и
тонкослойная хроматография чаще
используются для качественного анализа.
Измерение объема N2, выделяющегося при
дезаминировании аминокислот азотистой
к-той, а также титрование аминокислот
щелочью в избытке формалина (методы Ван
Слайка и Сёренсена) сохранили лишь
историческое значение.
Получение.
![]() получают галогенированием карбоновых
к-т или эфиров в
получают галогенированием карбоновых
к-т или эфиров в
![]() --положение
с послед. заменой галогена на аминогруппу
при обработке амином, аммиаком или
фталимидом калия (по Габриелю).
--положение
с послед. заменой галогена на аминогруппу
при обработке амином, аммиаком или
фталимидом калия (по Габриелю).
По Штреккеру – Зелинскому
![]() .
получают из альдегидов:
.
получают из альдегидов:

Этот метод позволяет также получать
нитрилы и амиды соответствующих
![]() .
По сходному механизму протекает
образование-аминофосфоновых к-т по
р-ции Кабачника-Филдса, напр.:
.
По сходному механизму протекает
образование-аминофосфоновых к-т по
р-ции Кабачника-Филдса, напр.:
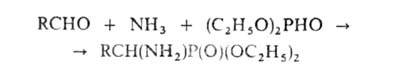
В этой р-ции вместо альдегидов м. б. использованы кетоны, а вместо диалкилфосфитов - диалкилтиофосфиты, кислые эфиры алкил(арил)фосфонистых к-т RP(OH)OR и диарилфосфиноксиды Аr2НРО. Таким путем получен широкий набор комплексонов.
Альдегиды и кетоны или их более активные
производные - кетзли служат исходными
соед. для синтеза
![]() аминокислот
с увеличением числа углеродных атомов
на две единицы. Для этого их конденсируют
с циклич. производными аминоуксусной
к-ты - азалакгонами, гидантоинами,
тиогидантоинами, 2,5-пиперазиндионами
или с ее медными или кобальтовыми
хелатами, напр.:
аминокислот
с увеличением числа углеродных атомов
на две единицы. Для этого их конденсируют
с циклич. производными аминоуксусной
к-ты - азалакгонами, гидантоинами,
тиогидантоинами, 2,5-пиперазиндионами
или с ее медными или кобальтовыми
хелатами, напр.:
Удобные предшественники![]() .-аминомалоновый
эфир и нитроуксусный эфир. К их
.-аминомалоновый
эфир и нитроуксусный эфир. К их![]() углеродным
атомам можно предварительно ввести
желаемые радикалы методами алкилирования
или конденсации.
углеродным
атомам можно предварительно ввести
желаемые радикалы методами алкилирования
или конденсации.
![]() Кетокислоты
превращ. В
Кетокислоты
превращ. В
![]() гидрированием в присут. NH3 или гидрированием
их оксимов или гидразонов.
гидрированием в присут. NH3 или гидрированием
их оксимов или гидразонов.
Нек-рые L![]() аминокислоты
ввиду сложности синтеза и разделения
оптич. изомеров получают микробиол.
способом (лизин, триптофан, треонин) или
выделяют из гидролизатов прир. белковых
продуктов (пролин, цистин, аргинин,
гистидин). Перспективны смешанные
химически-ферментативные способы
синтеза, напр.:
аминокислоты
ввиду сложности синтеза и разделения
оптич. изомеров получают микробиол.
способом (лизин, триптофан, треонин) или
выделяют из гидролизатов прир. белковых
продуктов (пролин, цистин, аргинин,
гистидин). Перспективны смешанные
химически-ферментативные способы
синтеза, напр.:
-
Аминосульфоновые к-ты получают при обработке аммиаком продуктов присоединения NaHSO3 к альдегидам:
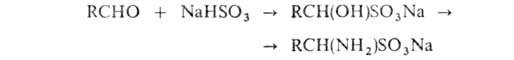
-
. синтезируют присоединением NH3 или аминов к
 ненасыщенным
к-там, а также по методу Родионова -
конденсацией альдегидов с малоновой
к-той в присут. NH3:
ненасыщенным
к-там, а также по методу Родионова -
конденсацией альдегидов с малоновой
к-той в присут. NH3:
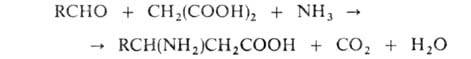
-
получают гидролизом соответствующих лактамов (напр.,
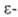 капролактама), к-рые образуются в
результате перегруппировки Бекмана
из оксимов циклич. кетонов под действием
H2SO4.
капролактама), к-рые образуются в
результате перегруппировки Бекмана
из оксимов циклич. кетонов под действием
H2SO4.
 Аминоэнантовую,
Аминоэнантовую,
 минопеларгоновую
иаминоундекановую к-ты синтезируют из
минопеларгоновую
иаминоундекановую к-ты синтезируют из
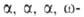 тетрахлоралканов
путем их гидролиза конц. H2SO4 до
тетрахлоралканов
путем их гидролиза конц. H2SO4 до
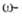 хлоралкановых
к-т с послед. аммонолизом:
хлоралкановых
к-т с послед. аммонолизом:
Исходные тетрахлоралканы получают теломеризациеи этилена с СС14.
Ароматич. аминокислоты синтезируют восстановлением нитробензойных к-т или окислением толуидинов после предварит. бензоилирования аминогруппы. Антраниловую к-ту получают из фталевого ангидрида:
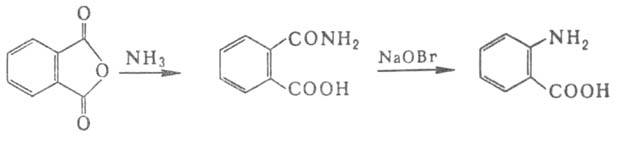
Для синтеза
![]() ., меченных изотопами 15N и 14С, обычно
пользуются методами Габриеля и Штреккера
соответственно. Меченные 3Н аминокислоты
получают из ненасыщ. предшественников.
., меченных изотопами 15N и 14С, обычно
пользуются методами Габриеля и Штреккера
соответственно. Меченные 3Н аминокислоты
получают из ненасыщ. предшественников.
Сульфаниловая к-та образуется при нагр. сульфата анилина до 180°С. Ее мета-изомер получают сульфированием нитробензола с послед. восстановлением нитрогруппы.
Применение. Наиб. интерес представляют
20 L![]() аминокислот
(аланин, аргинин, аспарагин и др.), входящих
в состав белковых молекул. Смеси
L-аминокислот., а также индивидуальные
аминокислоты (напр., метионин)применяют
в медицине для парэнтерального питания
больных с заболеваниями пищеварит. и
др. органов, при нарушениях обмена в-в
и др.; лизин, метионин, треонин, триптофан
- в животноводстве для обогащения кормов;
глутамат натрия и лизин - в пищ. пром-сти.
аминокислот
(аланин, аргинин, аспарагин и др.), входящих
в состав белковых молекул. Смеси
L-аминокислот., а также индивидуальные
аминокислоты (напр., метионин)применяют
в медицине для парэнтерального питания
больных с заболеваниями пищеварит. и
др. органов, при нарушениях обмена в-в
и др.; лизин, метионин, треонин, триптофан
- в животноводстве для обогащения кормов;
глутамат натрия и лизин - в пищ. пром-сти.
![]() и их лактамы служат для пром. произ-ва
полиамидов.
и их лактамы служат для пром. произ-ва
полиамидов.
![]() Аминомасляная
к-та (аминалон) - медиатор в центр. нервной
системе, применяется как лек. ср-во при
сосудистых заболеваниях головного
мозга. Ароматич. аминокислоты используют
в синтезе красителей и лек. ср-в. На
основе аминокарбоновых и аминофосфоновых
к-т синтезируют селективные комплексоны,
комплексообразующие иониты, лигандообменные
сорбенты, ПАВ.
Аминомасляная
к-та (аминалон) - медиатор в центр. нервной
системе, применяется как лек. ср-во при
сосудистых заболеваниях головного
мозга. Ароматич. аминокислоты используют
в синтезе красителей и лек. ср-в. На
основе аминокарбоновых и аминофосфоновых
к-т синтезируют селективные комплексоны,
комплексообразующие иониты, лигандообменные
сорбенты, ПАВ.
Пептидная связь, вид амидной связи; возникает при образовании белков и пептидов в результате взаимодействия a-аминогруппы (—NH2) одной аминокислоты с a-карбоксильной группой (—СООН) др. аминокислоты:


Группа —СО—NH— в белках находится в состоянии кето-енольной таутомерии.
Наличие П. с. в белках и пептидах было предположено А. Я. Данилевским и Э. Фишером и затем подтверждено химическими и физическими данными. Благодаря таутомерии П. с. имеет частично (на 40%) характер двойной (сопряжённой) связи, что проявляется в уменьшении её длины (1,32Å), по сравнению с длиной одинарной —С—N— связи (1,47Å) (см. Химическая связь). Частично сопряжённый характер — С—N— связи обусловливает плоскую конфигурацию —СО—NH— группы (все 4 атома компланарны, то есть находятся в одной плоскости) и существование транс- и цис-форм:
Экспериментально доказана большая устойчивость транс-формы (см. Изомерия). Ферментативное образование П. с. в живых клетках происходит в процессе биосинтеза белка. Разработаны методы химического и ферментативного лабораторного синтеза и расщепления П. с., позволившие синтезировать ряд биологически активных пептидов, а также установить аминокислотную последовательность для многих белков и пептидов.
СТРУКТУРА БЕЛКОВ
Пептидные цепи содержат десятки, сотни и тысячи аминокислотных остатков, соединённых прочными пептидными связями. За счёт внутримолекулярных взаимодействий белки образуют определённую гфостранственную структуру, называемую "конформация белков". Линейная последовательность аминокислот в белке содержит информацию о построении трёхмерной пространственной структуры. Различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертичной структурами (рис. 1-3). Существуют общие правила, по которым идёт формирование пространственных структур белков.
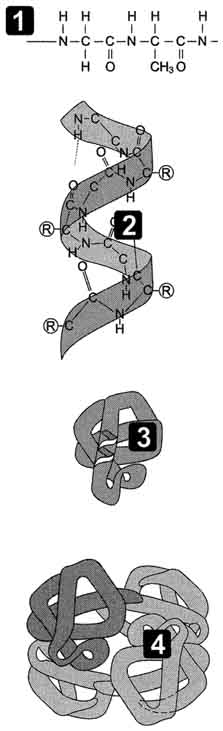
Рис. 1-3. Этапы формирования конформации белков. 1 - первичная структура; 2 - вторичная структура; 3 - третичная структура; 4 - четвертичная структура.
Первичная структура
Аминокислотные остатки в пептидной цепи белков чередуются не случайным образом, а расположены в определённом порядке. Линейную последовательность аминокислотных остатков в полипептидной цепи называют "первичная структура белка".
Первичная структура каждого индивидуального белка закодирована в участке ДНК, называемом геном. В процессе синтеза белка информация, находящаяся в гене, сначала переписывается на мРНК, а затем, используя мРНК в качестве матрицы, на рибосоме происходит сборка первичной структуры белка (см. раздел 4).
Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для данного белка первичную структуру. Все молекулы данного индивидуального белка имеют одинаковое чередование аминокислотных остатков в белке, что в первую очередь отличает данный индивидуальный белок от любого другого.
Вторичная структура белков
Вторичная структура белков - пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: ?-спираль и ?-структура.
?-Спираль
В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали (рис. 1-5). На один виток ?-спирали приходится 3,6 аминокислотных остатка.
В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате ?-спираль "стягивается" множеством водородных связей. Несмотря на то, что данные связи относят к разряду слабых, их количество обеспечивает максимально возможную стабильность ?-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) ?-спиралей уменьшается, а их гидрофобность увеличивается.
?-Спиральная структура - наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования ?-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится.
Радикалы аминокислот находятся на наружной стороне ?-спирали и направлены от пептидного остова в стороны. Они не участвуют в образовании водородных связей, характерных для вторичной структуры, но некоторые из них могут нарушать формирование ?-спирали. К ним относят:
пролин. Его атом азота входит в состав жёсткого кольца, что исключает возможность вращения вокруг -N-CH- связи. Кроме того, у атома азота пролита, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовать водородную связь в данном месте пептидного остова, и ?-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб;
участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания;
участки с близко расположенными объёмными радикалами, механически нарушающими формирование ?-спирали, например метионин, триптофан.
?-Структура
?-Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями, ?-Структура образует фигуру, подобную листу, сложенному "гармошкой", - ?-складчатый слой (рис. 1-6).

Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В ?-структурах водородные связи расположены перпендикулярно полипептидной цепи.
Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная ?-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного ?-складчатого слоя (рис. 1-7).
В отличие от ?-спиралей, разрыв водородных связей, формирующих ?-структуры, не вызывает удлинения данных участков полипептидных цепей.
Как ?-спираль, так и ?-структуры обнаружены в глобулярных и фибриллярных белках
Третичная структура белков
Третичная структура белков - трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Связи, участвующие в формировании третичной структуры белков
Гидрофобные взаимодействия
При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков. Между ними возникают так называемые гидрофобные взаимодействия, а также силы ван дер Ваальса между близко прилегающими друг к другу атомами. В результате внутри белковой глобулы формируется гидрофобное ядро. Гидрофильные группы пептидного остова при формировании вторичной структуры образуют множество водородных связей, благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка.
Ионные и водородные связи
Гидрофильные радикалы аминокислот стремятся образовать водородные связи с водой и поэтому в основном располагаются на поверхности белковой молекулы.
Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей (рис. 1-11).
Ионные связи могут возникать между отрицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и положительно заряженными (катионными)
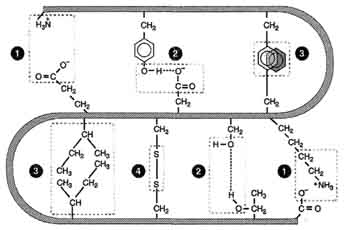
Рис. 1-11. Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка. 1 - ионные связи; 2 - водородные связи; 3 - гидрофобные связи; 4 - дисульфидные связи.
Четвертичная структура белков
Многие белки содержат в своём составе только одну полипептидную цепь. Такие белки называют мономерами. К мономерным относят и белки, состоящие из нескольких цепей, но соединённых ковалентно, например дисульфидными связями (поэтому инсулин следует рассматривать как мономерный белок).
В то же время существуют белки, состоящие из двух и более полипептидных цепей. После формирования трёхмерной структуры каждой полипептидной цепи они объединяются с помощью тех же слабых взаимодействий, которые участвовали в образовании третичной структуры: гидрофобных, ионных, водородных.
Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков". Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.
