
диаграмма состояний
.pdf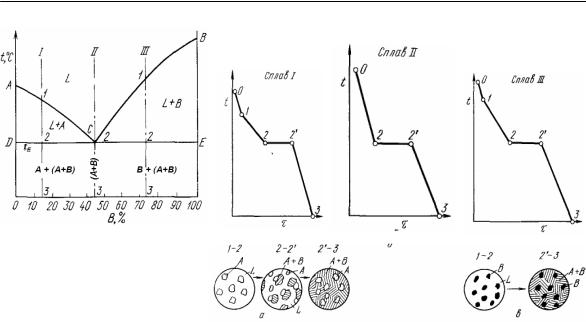
Диаграммы состояния двойных металлических сплавов |
21 |
|
а |
б |
в |
Рис. 11.
Диаграмма состояния сплава, образующего механическую смесь
чистых компонентов [1]
Рис. 12. Кривые охлаждения доэвтектического (I), эвтектического (II) и заэвтектического (III) сплавов. Внизу приведены схемы структур доэвтектического (слева) и заэвтектического (справа) сплавов [1]
Сплав II является особым. Кривая охлаждения этого сплава аналогична кривым охлаждения чистых металлов. После отрезка 0–2 (охлаждение жидкого сплава) имеется только одна температурная остановка 2–2′, т. е. кристаллизация происходит при постоянной температуре tE, меньшей, чем у компонентов A и B. Это объясняется отсутствием растворимости компонентов в твердом состоянии: происходит длительное перераспределение хорошо перемешанных в расплаве атомов элементов до тех пор, пока в определенных участках (с энергетической флуктуацией) не будет достигнута их концентрация, необходимая для формирования зародыша размером выше критического (r > rкр). Как только перераспределение элементов полностью закончится, произойдет их одновременная кристаллизация при постоянной температуре tE (С = 0), причем в одном участке ведущей фазой является металл А, а в другом – металл В. Рост зародыша ведущей фазы способствует обогащению окружающей его жидкости атомами другого компонента, и в ней происходит образование его

22 |
В. П. Ротштейн |
кристаллов. |
Так, попеременно жидкость то в одном месте, |
то в другом, пересыщаясь атомами А и В, кристаллизуется с образованием механической смеси их кристаллов.
Поскольку температура затвердевания данного сплава заметно ниже, чем исходных элементов, то диффузионное движение атомов затруднено. Поэтому формируется мелкозернистая однородная механическая смесь чистых компонентов (зерен) А и В.
Механическая смесь двух или более компонентов, кристаллизующаяся одновременно из жидкого сплава определенного химического состава при постоянной и минимальной для данной системы температуре, называется эвтектикой. Химический состав эвтектической смеси определенных компонентов всегда одинаков и определяется точкой С.
Эвтектику или эвтектическую структуру обозначают: Е = А + В. Она образуется по эвтектической реакции LC ↔ А + В при эвтектической концентрации (точка С) и эвтектической температуре tE.
эвтектическим («эвтектика» – от др. греч.:
легкоплавкий).
Сплавы I (левее точки С) и III (правее точки С) называются
доэвтектическими и заэвтектическими, соответственно. Эти сплавы кристаллизуются в интервалах температур, соответствующих точкам перегиба 1 и 2 на кривых охлаждения (рис. 12). В точках 1 образуются кристаллы того элемента, которому легче сформировать устойчивый зародыш (r > rкр). Это легче сделать тому металлу, концентрация которого выше эвтектической.
Вдоэвтектических сплавах избыточным является металл А,
взаэвтектических – металл В. Постепенная кристаллизация избыточного металла уменьшает его концентрацию в остатках жидкой фазы. При этом происходит диффузионное разделение атомов, нерастворимых друг в друге в твердом состоянии. При температуре tE перераспределение заканчивается, остатки жидкой фазы достигнут эвтектической концентрации (точка С),
и на отрезках 2–2′ произойдет совместная кристаллизация компонентов по реакции LC → А + В.
Таким образом, в твердом состоянии сплавы данной системы делятся на три вида:
(I)доэвтектические: концентрация В – в интервале от 0 % до точки С; структура – зерна А + эвтектика (А+В)

Диаграммы состояния двойных металлических сплавов |
23 |
(II)эвтектический: концентрация В – точка С; структура – эвтектика (А+В)
(III)заэвтектические: концентрация В – от точки С до 100%; структура – зерна В+ эвтектика (А+В).
Последовательность формирования микроструктуры спла-
вов I и II показана на рис. 12. Схема финишных микроструктур показана на рис. 13.
Проверим правильность построения кривых охлаждения и диаграммы состояния с помощью правила фаз (С = К – Ф + 1) на примере сплава I:
•отрезок 1–2: С = 2 – 2 + 1 = 1, следовательно, температура
Тизменяется
•отрезок 2–2′ : С = 2 – 3 + 1 = 0, следовательно, температура
Т= const
•отрезок 2′ –3: С = 2 – 2 + 1 = 1, следовательно, температура
Тизменяется.
Таким образом, кривая охлаждения построена правильно.
а |
б |
в |
Рис. 13. |
|
|||
|
|
|
Схема микроструктур сплавов, |
|
|
|
образующих механические |
|
|
|
смеси чистых компонентов: |
|
|
|
а – доэвтектического, |
|
|
|
б – эвтектического, |
|
|
|
в – заэвтектического |
А(А+В) В
Структурные составляющие сплава. Следует различать фазовый и структурный состав сплавов. Структурными составляющими называют отдельные структурно обособленные части сплава, имеющие характерное строение. Для данной системы твердыми фазами являются зерна А и В, а структурными составляющими –
зерна А, зерна В и эвтектика (А+В).
5.4.Диаграмма состояния сплавов, образующих неограниченные твердые растворы (2-го рода)
Напомним условия образования неограниченных твердых растворов:
• компоненты имеют одинаковый тип решетки (изоморфизм)
24 |
В. П. Ротштейн |
•размеры атомов компонентов отличаются не более, чем на 15 %
•компоненты имеют одинаковую валентность. Исходные данные:
•компоненты: А, В (K = 2)
•оба компонента неограниченно растворимы в жидком и твердом состояниях и не образуют химических соединений
•фазы: жидкий сплав L, твердый раствор α.
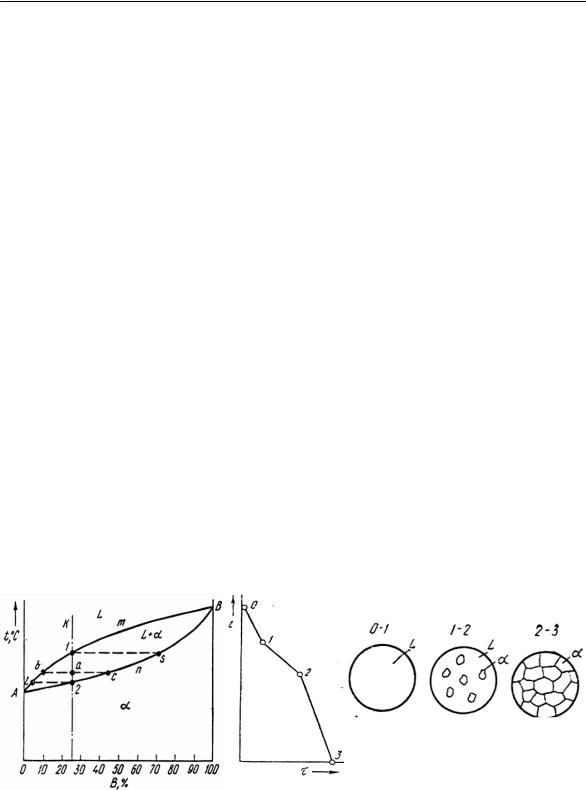
Диаграмма состояния показана на рис. 14. Точки А и В – тем-
пературы плавления (кристаллизации) чистых компонентов А и В. Линия АmВ – линия ликвидус, линия АnВ – линия солидус. В системах данного типа все сплавы кристаллизуются однотипно. Кривая охлаждения, описывающая процесс кристаллизации, показана на рис. 15. На отрезке 0–1 монотонно охлаждается жидкий сплав L. В точке 1 (на линии ликвидус) зарождаются первые кристаллы α, на отрезке 1–2 сплав находится в двухфазном состоянии L+α, а при достижении линии солидус (точка 2) кристаллизация заканчивается. Поскольку растворимость компонентов в твердом состоянии неограниченна и их решетки однотипны, то не имеет значения, на базе какого элемента образован твердый раствор. Поэтому между линиями ликвидус и солидус сплавы находятся в двухфазном (L+α) состоянии.
Проверим правильность построения кривой охлаждения (рис. 15) с помощью правила фаз. На отрезке 1–2: С = К – Ф + 1 = 2
– 2 + 1 = 1. Следовательно, на данном отрезке температура Т изменяется, что и требовалось подтвердить.
Рис. 14. |
Рис. 15. |
Диаграмма состояния сплава, |
Кривая охлаждения и схема формирования |
образующего неограниченные |
структур сплава, образующего неограниченные |
твердые растворы [1] |
твердые растворы [1] |
Диаграммы состояния двойных металлических сплавов |
25 |
5.5. Правило отрезков и правило рычага
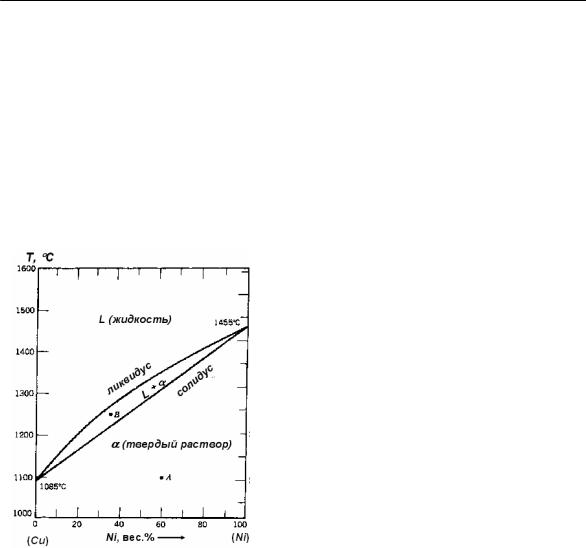
Рассмотрим диаграмму состояния Cu-Ni с неограниченной растворимостью компонентов в твердом состоянии (рис. 16). Выберем две рабочих точки на диаграмме состояния: А и В. Точка А расположена ниже линии солидус, и состояние сплава полностью определено: сплав на 100 % состоит из одной фазы (α– твердый раствор) и имеет состав 40 % Cu – 60 % Ni (вес. %). Полностью известно состояние сплава и в любой точке выше линии ликвидус (жидкость).
Рис. 16.
Диаграмма состояния Cu-Ni [4]
Теперь рассмотрим точку В. Из диаграммы состояния видно, что сплав состоит из двух фаз: L и α. Однако концентрация Ni в каждой фазе и их весовая (массовая) доля неизвестны. Эти величины находят с помощью правила отрезков (концентрация) и правила рычага (массовая доля).
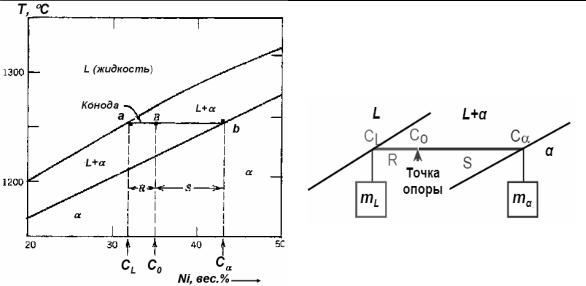
Правило отрезков. Через выбранную рабочую точку В
(см. рис. 17) проводят горизонтальную прямую (изотерму) до пересечения с линиями ликвидус и солидус. Эту линию называют конодой.
Правило отрезков:
•точка а на линии ликвидус дает концентрацию Ni в жидкости: СL = 32 вес. % Ni
•точка b на линии солидус дает концентрацию Ni в твердой фазе
(в α – твердом растворе): Сα = 43 вес. % Ni.
26 |
В. П. Ротштейн |
Рис. 17. |
Рис. 18. |
Диаграмма состояния Cu-Ni |
Механическая аналогия, |
(к правилу отрезков |
поясняющая правило рычага |
и правилу рычага) [4] |
|
Правило рычага. Используем то же построение, что и для правила отрезков (рис. 17). Пусть концентрация Ni рабочей точке В равна С0. Рабочая точка В (точка опоры) делит коноду ав (рычаг) на два плеча аВ и Вb.
Применим для коноды условие равновесия рычага (см. рис. 18): отношение масс обратно пропорционально отношению длин плеч рычага:
mα |
aB |
C0 −CL |
|
|
||
|
= |
|
= |
|
, |
(9) |
|
|
|
||||
mL |
Bb |
Cα −C0 |
|
|||
где mα и mL – массы α – твердого раствора и жидкости, соответственно. Массовая доля α – твердого раствора будет равна
Wα = |
mα |
= |
aB |
|
= |
C0 |
−CL |
. |
(10) |
|
m |
+ m |
ab |
|
|
||||||
|
|
C |
−C |
|
||||||
|
α |
L |
|
|
|
|
α |
L |
|
|
Массовая доля жидкости будет равна
WL = |
mL |
|
= |
Bb |
= |
Cα −C0 |
(11) |
|
m + m |
ab |
|
||||||
|
|
|
C −C |
L |
|
|||
|
α |
L |
|
|
|
α |
|
|
Правило отрезков и правило рычага справедливы для любой двухфазной области, независимо от типа диаграммы состояния.

Диаграммы состояния двойных металлических сплавов |
27 |
Вывод правила рычага. Рассмотрим диаграмму состояния Cu–Ni (рис. 17) и сплав состава C0 при T = 1250°C (точка В). Здесь Cα , CL , Wα и WL – те же параметры, что и выше. Для вывода используем два уравнения сохранения массы.
Сумма массовых долей жидкости (L) и α–твердого раствора в двухфазной области равна 1, т. е.
Wα + WL = 1 |
(12) |
Сумма относительных масс одного из компонентов (Cu или Ni) в обеих фазах должна быть равна относительной массе этого же компонента во всем сплаве, т. е. концентрации С0 или
|
|
|
WαCα + WLCL = Co |
|
(13) |
||||
Решая эту систему уравнений, получим правило рычага |
|||||||||
для данного частного случая: |
|
|
|
|
|||||
W = |
C |
0 |
- C |
L |
и |
WL = |
Cα |
−C0 |
(14) |
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||
α |
|
|
|
|
|
Cα −CL |
|
||
|
Cα - C |
L |
|
|
|||||
Задача 1. Определить массовые доли обеих фаз для точки В (рис. 17).
Решение. В точке В : С0 = 35 %Ni; Cα = 43 %Ni; CL = 32 %Ni (вес. %). Подставляя эти данные в формулы (10) и (11) получим:
|
|
C0 −CL |
|
35 − 32 |
Cα −C0 |
43 − 35 |
|||||
Wα |
= |
|
|
= |
|
= 0.27 и WL = |
|
|
= |
|
= 0.73 |
C −C |
|
|
|
|
|||||||
|
|
|
43 − 32 |
C −C |
43 − 32 |
||||||
|
|
α |
L |
|
|
|
α |
L |
|
|
|
5.6. Внутрикристаллитная (дендритная) ликвация
Рассмотрим формирование микроструктуры при затвердевании изоморфного сплава 65 % Cu – 35 % Ni (вес. %) (рис. 19) в двух случаях, отличающихся скоростью охлаждения расплава.
Случай 1. Расплав охлаждается очень медленно, и поэтому фазовое равновесие в двухфазной области L + α поддерживается непрерывно.
При 1300°С (точка а) сплав полностью находится в жидком состоянии L; его микроструктура схематически изображена
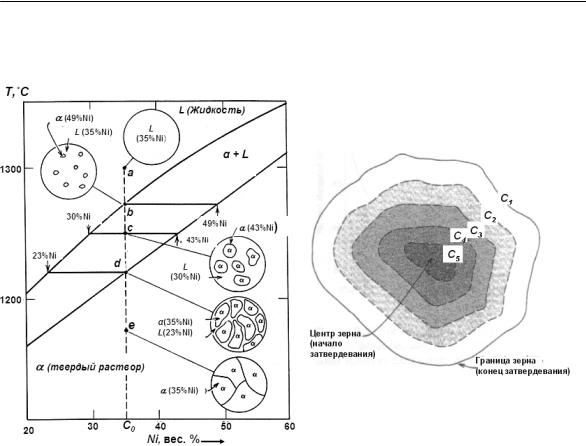
28 |
В. П. Ротштейн |
на круговой вставке. Начнем охлаждать этот сплав от данной температуры, что соответствует движению вниз по вертикальной пунктирной линии.
Рис. 19. |
Рис. 20. |
Диаграмма состояния Cu-Ni |
Схема образования |
и схема микроструктур, формируемых |
внутрикристаллитной ликвации |
согласно правилу отрезков [4] |
(в отдельном зерне) при затвердевании. |
|
В поперечном сечении зерна |
|
устанавливается градиент концен- |
|
трации. Пунктирные линии – |
|
контуры постоянной концентрации |
|
(С1, С2, С3 и т. д.) [4] |
До точки b (на линии ликвидус) микроструктура и химический состав жидкости не изменяются. При достижении точки b (~ 1270°C) в жидкости возникнут первые кристаллы α–твердого раствора, которые, в соответствии с правилом отрезков, имеют состав 51 %Cu–49 %Ni. В то же время состав жидкости остается примерно тем же (65 %Cu–35 %Ni), т. е. заметно отличается от состава α–твердого раствора.
При дальнейшем охлаждении состав обеих фаз и относительная доля каждой фазы будут изменяться. Состав жидкой и твердой фаз будет изменяться по линиям ликвидус и солидус,

Диаграммы состояния двойных металлических сплавов |
29 |
соответственно. Доля α–фазы будет расти по мере охлаждения. При этом общий состав сплава (65 %Cu – 35 %Ni, точка С0) остается неизменным; происходит только перераспределение Ni между фазами. При 1250°С (точка с на рис. 19) жидкая фаза (L) будет иметь состав 70 %Cu – 30 %Ni, а твердая фаза (α) – 57%Cu – 43 %Ni.
При 1220°С (точка d) затвердевание полностью заканчивается. Состав α–фазы будет примерно 65 %Cu – 35 %Ni (общий состав сплава), в то время как последние остатки жидкости будут иметь состав 77 %Cu – 23 %Ni. Сразу после пересечения линии солидус эти остатки жидкости затвердевают; формируется окончательная поликристаллическая структура, состоящая из зерен α–твердого раствора с однородным составом 65 %Cu – 35 %Ni (точка е). Последующее охлаждение не приводит к каким-либо изменениям микроструктуры и химического состава сплава.
Такие условия равновесного затвердевания реализуются только при очень медленном охлаждении. Причина состоит в том, что по мере уменьшения температуры составы обеих фаз должны в каждой точке установиться в соответствии с диаграммой состояния. Изменение составов при охлаждении происходит в результате диффузионных процессов, т. е. массопереноса атомов в каждой из фаз и через межфазную границу жидкость–кристалл. Диффузия – процесс, требующий времени; поэтому для установления равновесного состава каждой фазы необходимо достаточное время при каждом значении температуры. Скорость диффузии в твердой фазе очень мала; при этом она быстро уменьшается с уменьшением температуры для обеих фаз. Именно поэтому для установления равновесия, т. е. формирования однофазной (однородной по химическому составу) структуры необходимо
очень медленное охлаждение.
Случай 2. Затвердевание сплава того же состава протекает при скоростях охлаждения, намного превышающих значения, требуемые для установления равновесного состояния. Именно такие режимы реализуются на практике при производстве отливок.
В этих условиях необходимого времени для выравнивания концентрации по всему сечению зерна за счет диффузии атомов не хватает. В результате при ускоренном затвердевании формируется неоднородная микроструктура с градиентом концентрации обоих компонентов внутри зерна. Эта неоднородность состава

30 |
В. П. Ротштейн |
называется |
внутрикристаллитной ликвацией. Действительно, |
из рис. 19 следует, что центральная область (сердцевина) зерна, которая первой начинает затвердевать, обогащается тугоплавким элементом (Ni в системе Cu–Ni), в то время как легкоплавкий элемент (Cu) оттесняется от центра к границе зерна. В результате устанавливается определенный градиент концентрации по сечению зерна, который схематически показан на рис. 20.
На рис. 21а приведена микроструктура сплава 70 % Сu – 30 %Ni (вес. %), полученного при литье в кокиль (металлическую форму). Стенки металлической формы довольно быстро отводят тепло от расплава, что обеспечивает его ускоренное охлаждение. Это приводит к формированию дендритной микроструктуры, четко выявляемой на протравленном микрошлифе (рис. 21а, б). Светлые области, являющиеся центрами дендритов (осями первого порядка), обогащены никелем. Причина состоит в том, что центры дендритов, согласно рис. 19, затвердевают первыми вблизи линии ликвидус; поэтому концентрация никеля (примеси) максимальна. Внешние области дендритов затвердевают при более низких температурах, поэтому они обогащены медью (темные области).
Внутрикристаллитную (дендритную) ликвацию можно устранить путем диффузионного или гомогенизирующего отжига
при температуре ниже линии солидус для сплава данного состава (см. рис. 21в). При таком отжиге происходит диффузия атомов, которая обеспечивает выравнивание химического состава внутри зерен.
Влияние внутрикристаллитной ликвации на свойства сплавов. Внутрикристаллитная ликвация играет отрицательную роль, особенно, если на границу зерна оттесняются вредные легкоплавкие примеси. Эти примеси попадают в конструкционные сплавы из руды или в процессе выплавки.
В сталях вредной примесью является сера. Несмотря на то, что общая концентрация серы не превышает 0.06 вес. %, ее локальная концентрация может оказаться очень высокой за счет преимущественного вытеснения на границы зерен. Сера, скапливаясь на границах зерен, образует с железом хрупкий сульфид железа FeS. При взаимодействии с железом образуется эвтектика (Fe + FeS) с температурой плавления 988°С. Поэтому при нагреве стальных заготовок выше 900°С с целью последующей пластической
