
диаграмма состояний
.pdf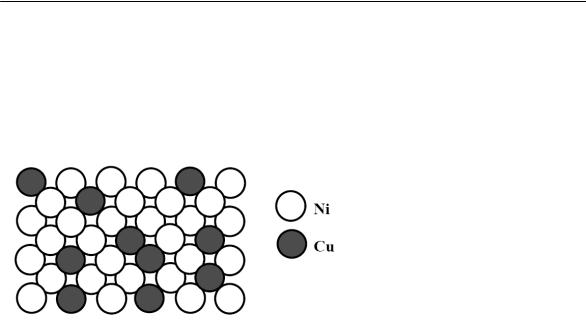
Диаграммы состояния двойных металлических сплавов |
11 |
•различие атомных радиусов компонентов не превышает 15 %
•атомы компонентов А и В имеют одинаковую валентность, т. е. одинаковое число электронов, которое атом может потерять из валентной оболочки, образуя ион.
•взаимодействие между атомами А и В слабое, т. е. силы притяжения и отталкивания малы.
Рис. 5.
Двумерная модель неограниченного твердого раствора замещения Cu-Ni
Непрерывный ряд твердых растворов замещения, помимо Cu-Ni, образуют системы: золото–серебро (Au–Ag), золото– платина (Au–Pt), титан–цирконий (Ti–Zr), ниобий–вольфрам (Nb –W), молибден–вольфрам (Mo-W).
3.2. Химические соединения
Химические соединения – это кристаллические фазы, образующиеся в системах металл-неметалл и металл–металл, когда при затвердевании между атомами компонентов возникает сильное притяжение. Примером химического соединения является карбид железа Fe3C (цементит) – фаза, образующаяся в железоуглеродистых сплавах (сталях и чугунах).
Химические соединения имеют следующие особенности, отличающие их от твердых растворов:
•соединение имеет строго определенное соотношение между числом атомов элементов А и В, соответствующее стехиометрическому составу, выраженному формулой АmВn
•соединение имеет специфическую решетку, отличную от решеток исходных компонентов
•соединение имеют постоянную температуру плавления (диссоциации)

12 |
В. П. Ротштейн |
•свойства соединения существенно отличаются от свойств исходных компонентов; например, соединение Fe3C имеют высокую твердость, но очень хрупкое, что связано с наличием ковалентной связи между атомами Fe и C.
Если химическое соединение АmВn является устойчивым, т. е. не диссоциирует вплоть до температуры плавления, то его можно рассматривать как самостоятельный компонент С, способный образовывать сплавы с исходными компонентами А и В.
Соединения между металлами называются интерметаллидными фазами или интерметаллидами. Интерметаллиды образуются в системах медь–цинк (Cu-Zn), титан–алюминий (Ti-Al), ти- тан–никель (Ti-Ni), никель–алюминий (Ni-Al). Это фазы: CuZn, TiNi, Ni3Al и др. Некоторые из них обладают уникальными свойствами. Например, интерметаллид TiNi эквиатомного состава обладает сверхэластичностью и эффектом памяти формы.
4. Виды металлических сплавов
Микроструктура и свойства сплавов зависят от характера взаимодействия компонентов при кристаллизации. В твердом состоянии сплавы могут образовывать следующие типы структур:
1)двухфазную механическую смесь зерен чистых компонентов
2)непрерывный ряд неограниченных твердых растворов замещения (однофазный сплав)
3)ограниченные твердые растворы и их механическую смесь
4)химические соединения и их механические смеси с исходными компонентами или ограниченными твердыми растворами.
Условия образования твердых растворов и химических соединений были рассмотрены выше. Остановимся на особенностях строения механических смесей.
Механическая смесь двух компонентов A и B образуется, если они не способны к взаимному растворению в твердом состоянии и не вступают в химические реакции друг с другом с образованием химического соединения. При таких условиях сплав будет состоять из кристаллов A и B (рис. 6а), отчетливо выявляемой с помощью металлографии (рис. 6б). В общем виде механические смеси обозначают: A + B.
|
Диаграммы состояния двойных металлических сплавов |
13 |
||
а |
б |
Bi |
Cd |
|
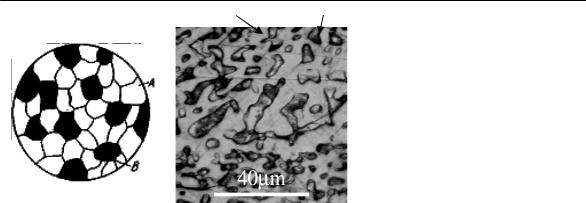
Рис. 6. (а) Микроструктура
механической смеси (схема);
(б) микроструктура сплава Bi-40 вес. % Cd.
Травление в спиртовом растворе FeCl3.
Источник: www.doitpoms.ac.uk University of Cambridge
Рентгенограмма сплава содержит линии решеток компонентов A и B. Свойства кристаллитов (зерен) A и B тождественны свойствам объемных чистых металлов A и B. Химический анализ также показывает, что сплав состоит из двух химических элементов A и B. При этом весовая доля компонента В в сплаве соответствует исходной (до сплавления). Примеры сплавов, образующих механические смеси: свинец–сурьма (Pb-Sb), висмут–кадмий (BiCd), бериллий–алюминий (Be-Al), медь–свинец (Cu-Pb).
На практике механические смеси чистых исходных компонентов встречаются редко. Как правило, существует небольшая взаимная растворимость компонентов. В этом случае образуется двухфазная механическая смесь зерен ограниченных твердых растворов α + β, где α = A(B), β = B(A) – ограниченные твердые растворы на основе компонентов A и B, соответственно.
5. Диаграммы состояния двойных сплавов
Диаграмма состояния сплава – это графическое изображение состояния сплава в зависимости от температуры и химического состава. В каждой точке диаграммы можно определить состояние сплава, а именно:
•фазовый состав сплава (тип и число фаз)
•химический состав каждой фазы
•массовую долю каждой фазы (в двухфазных областях).
Диаграмма состояния показывает только устойчивые или равновесные состояния. Поэтому диаграммы состояния называют также диаграммами фазового равновесия. При равновесии состояние сплава данного состава при данной температуре и давлении
14 |
В. П. Ротштейн |
термодинамически стабильно, т. е. отсутствует стремление к изменению этого состояния во времени. Состояние системы (сплава) определяется тремя параметрами: температура, давление и концентрация.
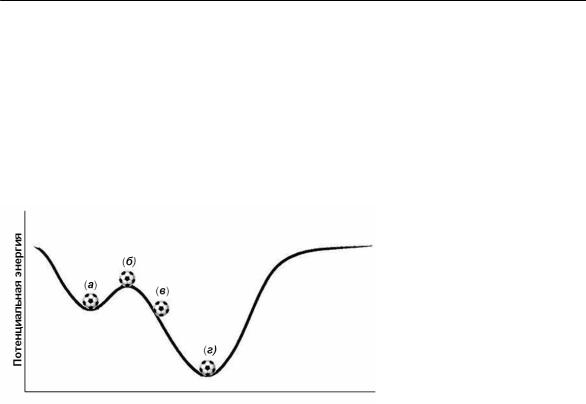
Условие минимальной свободной энергии. Различие между равновесным (стабильным) и неравновесным (нестабильным) состоянием можно пояснить с помощью механической модели (рис. 7), на которой показана зависимость потенциальной энергии тела от координаты.
Рис. 7.
Механическая модель, иллюстрирующая возможность существования материала в различных энергетических состояниях.
Источник:
www.msm.cam.ac.ukTeachingce
sindex.html
Тело (система) может находиться в одном из четырех состояний: (а) состояние метастабильного равновесия: состояние равновесия, которое остается стабильным только при небольших внешних возмущениях, поскольку оно не обладает минимальной
потенциальной энергией
(б) состояние нестабильного равновесия: состояние неустойчивого равновесия, нестабильного при любых малых возмущениях
(в) неустойчивое состояние: имеется движущая сила вправо (г) состояние стабильного равновесия: это состояние остается ста-
бильным при больших возмущениях, так как обладает минимальной энергией.
Пример: чистый твердый углерод может существовать в двух аллотропических формах: графита с гексагональной решеткой и алмаза со сложной ГЦК решеткой. Графит стабилен при обычных условиях (атмосферное давление и комнатная температура). Алмаз стабилен только при высоких давлениях; тем не менее, он существует и при обычных условиях. Из механической модели (рис. 7) следует, что при обычных условиях метастабильное состояние (а) будет соответствовать алмазу, а стабильное

Диаграммы состояния двойных металлических сплавов |
15 |
(равновесное) состояние (г) – графиту. Для того, чтобы оба состояния существовали при обычных условиях энергетический барьер между ними должен быть очень большим.
В термодинамике любое состояние системы (жидкость, твердый раствор, химическое соединение) может быть охарактеризовано свободной энергией (энергией Гиббса) G:
G = H – TS, |
(5) |
где H– энтальпия, T – абсолютная температура, S – энтропия системы. Энтальпия H = U + PV, где U – внутренняя энергия системы, P– давление, V– объем. Энтропия – это мера беспорядка системы. Например, при затвердевании сплава энтропия заметно уменьшается, поскольку твердое тело имеет упорядоченную решетку, а в жидкости ее нет. После окончания кристаллизации энтропия кристаллического состояния уменьшается незначительно, что связано с плотной упаковкой атомов в решетке.
Внутренняя энергия системы U определяется энергией тепловых колебаний атомов и энергией связи между атомами. Для конденсированного состояния (жидкого и твердого), которое обычно используется в технологии материалов, U » PV, поэтому H ≈ U. Таким образом, свободную энергию можно записать в виде
G = U – TS. |
(6) |
Равновесное состояние сплава при данной концентрации, температуре и давлении – это такое состояние, которое имеет минимальную свободную энергию (рис. 7). Оно реализуется при равновесных условиям, т.е. при медленном нагреве и охлаждении, когда отсутствуют перегрев или переохлаждение.
Если система выведена из равновесия, то свободная энергия изменяется на величину ΔG, и это изменение является «движущей силой», приводящей систему к равновесию.
Вряде сплавов, как и в случае твердого углерода, наряду
сравновесными состояниями, формируемыми при медленном нагреве и охлаждении, существуют так называемые неравновесные или метастабильные состояния, которые образуются, например, при быстром охлаждении (закалке). Эти состояния изменяются

16 |
В. П. Ротштейн |
со временем в определенном интервале температур. На рис. 7 им соответствуют локальные минимумы свободной энергии. Для перевода в равновесное состояние одной «движущей силы» ΔG недостаточно: для этого необходимо фазовое превращение.
Примером метастабильного состояния в сплавах является мартенсит – пересыщенный твердый раствор внедрения углерода в ОЦК-железе, формируемый при закалке стали.
В отличие от равновесных состояний, неравновесные фазы не описываются диаграммой состояния. Однако равновесные состояния являются базовыми, и во многих случаях они позволяют предсказать неравновесные состояния данной системы.
5.1. Правило фаз Гиббса
Состояние сплава зависит от внешних (температура, давление)
ивнутренних (концентрация) параметров. Это состояние характеризуется числом образовавшихся фаз, их составом (концентрацией)
иотношением масс (массовой долей фаз). Закономерности изме-
нения числа фаз в гетерогенных системах (с числом фаз ≥ 2) определяются правилом фаз Гиббса.
Правило фаз устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз. Оно выражается уравнением
С = К – Ф + 2, |
(7) |
где С – число степеней свободы (или вариантность); К – число компонентов, образующих систему; 2 – число внешних параметров (температура и давление); Ф – число фаз, находящихся в равновесии.
Под числом степеней свободы (вариантностью системы) понимают число независимых внутренних (концентрация) и внешних (температура, давление) параметров, значение которых можно изменять без изменения числа фаз, находящихся в равновесии.
Если число степеней свободы С = 0, то это означает, что для сохранения фазового равновесия (Ф=const) необходимо, чтобы все параметры оставались постоянными, т. е. концентрация n = const, температура T= const и давление P = const .

Диаграммы состояния двойных металлических сплавов |
17 |
Если же число степеней свободы С = 1, то это означает, что для сохранения фазового равновесия (Ф = const) необходимо, чтобы только один из параметров изменялся в некоторых пределах, а два других оставались постоянными.
Если принять, что все фазовые превращения в металлах и сплавах происходят при постоянном давлении (P = const), то число внешних факторов будет равно 1 (температура), и правило фаз примет вид
С = К – Ф + 1. |
(8) |
Правило фаз позволяет проверять правильность построения кривых охлаждения и диаграмм состояния на тех отрезках и в тех областях, где число фаз Ф ≥ 2. Примеры использования правила фаз будут приведены при рассмотрении диаграмм состояния сплавов (см. пп. 5.3, 5.4, 5.7).
5.2. Построение диаграмм состояния
Диаграмму состояния системы А–В строят с помощью термического анализа в координатах температура–концентрация.
Установка для построения диаграмм состояния термическим методом показана на рис. 8.
Рис. 8.
Установка для изучения процесса кристаллизации с целью построения диаграмм состояния термическим методом.
Источник: www.doitpoms.ac.uk University of Cambridge
18 |
В. П. Ротштейн |
Температуру измеряют с помощью термопары. Термопара состоит из двух проволок из разных металлов, сваренных на одном конце (горячий спай). Два других конца подключены к цифровому милливольтметру, отградуированному в °С.
Рассмотрим метод построения диаграмм состояния на примере системы, образующей неограниченные твердые растворы. Суть метода сводится к следующему:
•готовят набор сплавов различного состава, включая чистые компоненты А и В
•каждый состав помещают в огнеупорный тигель и нагревают в печи или с помощью газовой горелки до полного расплавления
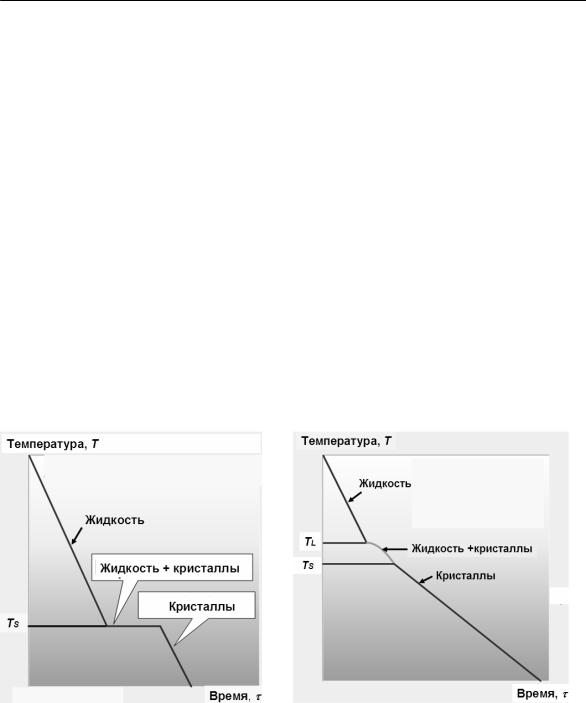
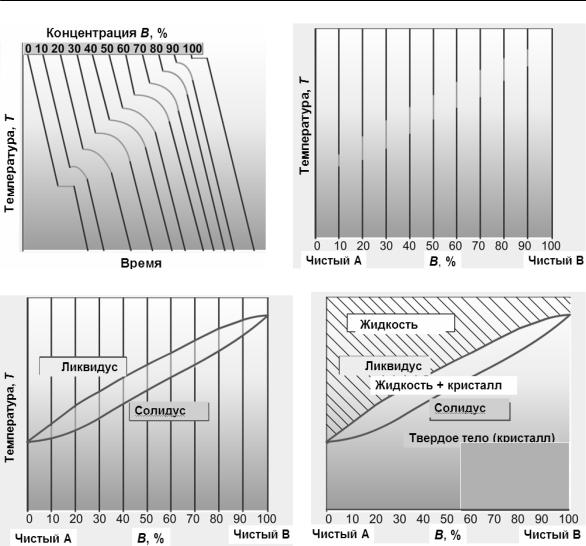
•после расплавления каждый состав медленно охлаждают, измеряя температуру в каждый момент времени. По этим данным строят кривые, описывающие процесс кристаллизации – кривые охлаждения (в координатах температура–время) (рис. 9 и 10а)
а |
б |
Рис. 9. Кривые охлаждения: а – для чистого металла; б – для сплава со структурой твердого раствора.
TL и TS – температуры начала и конца кристаллизации, соответственно.
Источник: www.materials.ac.uk.elearning.matter
|
Диаграммы состояния двойных металлических сплавов |
19 |
а |
б |
|
в |
г |
Рис. 10. Построение диаграммы состояния сплава (на примере сплава, образующего неограниченные твердые растворы).
Источник: www.materials.ac.uk.elearning.matter
•на каждой кривой находят точки остановки температуры или точки перегиба (рис. 9 и 10а). Это так называемые критические точки, т. е. температуры, при которых происходят фазовые превращения. Причиной остановки температуры на кривой охлаждения чистого металла (рис. 9а) является выделение скрытой теплоты кристаллизации, компенсирующее отвод тепла при охлаждении. Этим же эффектом объясняется замедление падения температуры (перегиб на кривой охлаждения) при затвердевании сплава (рис. 9б).

20 |
В. П. Ротштейн |
•поскольку диаграмма состояния, по определению, описывает равновесные состояния (фазы), не зависящие от времени, то шкалу времени на кривых охлаждения можно отбросить (рис. 10б)
•критические точки для каждого состава наносят на диаграмму в координатах температура – концентрация (рис. 10б)
•линия, проведенная по точкам начала кристаллизации, называется линией ликвидус. Выше этой линии сплав находится
вжидком состоянии. Линия, проведенная по точкам конца кристаллизации, называется линией солидус. Ниже линии солидус сплав находится в твердом (кристаллическом) состоянии (рис. 10в). Между линиями ликвидус и солидус сплав находится
вдвухфазном состоянии: жидкость + кристалл. Полученная картина и является диаграммой состояния данной системы (рис. 10г).
5.3.Диаграмма состояния сплавов, образующих механические смеси чистых компонентов (1-го рода)
Исходные данные:
•компоненты: химические элементы А и В (K=2)
•оба компонента неограниченно растворимы в жидком состоянии, а в твердом состоянии нерастворимы и не образуют химических соединений
•фазы: жидкость L, кристаллы А и В; максимальное число фаз
Фmax = 3.
Общий вид диаграммы состояния приведен на рис. 11. Точки А и В – температуры плавления (кристаллизации) чистых компонентов А и В. Линия АСВ – линия ликвидус (начало кристаллизации). Выше этой линии все сплавы находятся в жидком состоянии. Линия DCE – линия солидус (конец кристаллизации). Ниже этой линии все сплавы находятся в твердом состоянии. Между линиями ликвидус и солидус сплавы находятся в двухфазном состоянии: жидкость + кристаллы А или жидкость +кристаллы В.
На рис. 12 показаны кривые охлаждения сплавов I, II, III с различным содержанием компонента В, восстановленные по диаграмме состояния. Температуры начала кристаллизации у них различные (точки 1, 2 и 1, соответственно), но заканчивают кристаллизацию они при одной и той же температуре tE (точка 2′, линия ДСЕ), а сплав II кристаллизуется только при tE.
